Sulfite de diméthyle
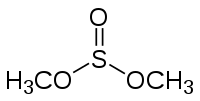
Le sulfite de diméthyle est un composé organique de la famille des esters de sulfite de formule (CH3O)2SO.
| Sulfite de diméthyle | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | méthoxysulfinyloxyméthane | ||
| Synonymes |
sulphite de diméthyle, ester diméthylique de l'acide sulfurique, DMSO3[1] |
||
| No CAS | |||
| No ECHA | 100.009.529 | ||
| No CE | 210-481-0 | ||
| No RTECS | WT3512000 | ||
| PubChem | 69223 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore[2] | ||
| Propriétés chimiques | |||
| Formule | C2H6O3S [Isomères] |
||
| Masse molaire[3] | 110,132 ± 0,008 g/mol C 21,81 %, H 5,49 %, O 43,58 %, S 29,12 %, |
||
| Propriétés physiques | |||
| T° ébullition | 126 à 127 °C | ||
| Masse volumique | 1,294 g·cm-3 (25 °C[2] | ||
| Point d’éclair | 38 °C (coupelle fermée)[2] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,410[2] | ||
| Précautions | |||
| SGH | |||
  |
|||
| Directive 67/548/EEC[2] | |||
 Xi |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il est utilisé comme additif dans certains polymères pour prévenir leur oxydation[4]. Il est aussi considéré comme potentiel solvant électrolyte pour des batteries à haute énergie[5].
Structure et conformation
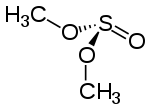
Le sulfite de diméthyle peut prendre diverses conformations, la plus stables étant le conformère GG [1], où chaque liaison C-O est gauche à la liaison S=O, comme le montre le schéma ci-dessous :
Synthèse
Même s'il est formellement l'ester diméthylique de l'acide sulfureux, le sulfite de diméthyle est préparé comme la plupart des autres esters de sulfite, par réaction entre le chlorure de thionyle et un alcool, ici le méthanol :
- OSCl2 + 2CH3OH → OS(OCH3)2 + 2HCl
Notes et références
- (en) A. Borba, A. Gómez-Zavaglia, P. N. N. L. Simões et R. Fausto, « Matrix Isolation FTIR Spectroscopic and Theoretical Study of Dimethyl Sulfite », J. Phys. Chem. A, vol. 109, no 16, , p. 3578–3586 (DOI 10.1021/jp050020t)
- Fiche Sigma-Aldrich du composé Dimethyl sulfite, consultée le 15 mai 2012.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Guenther, A.; Koenig, T.; Habicher, W. D.; Schwetlick, K., « Antioxidant action of organic sulfites. I. Esters of sulfurous acid as secondary antioxidants », Polymer Degradation and Stability, vol. 55, no 2, , p. 209–216 (DOI 10.1016/S0141-3910(96)00150-4)
- (en) N. P. Yao, E. D'Orsay, and D. N. Bennion, « Behavior of Dimethyl Sulfite as a Potential Nonaqueous Battery Solvent », J. Electrochem. Soc., vol. 115, no 10, , p. 999–1003 (DOI 10.1149/1.2410917)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dimethyl sulfite » (voir la liste des auteurs).
- Portail de la chimie
