Sulfure de bismuth(III)
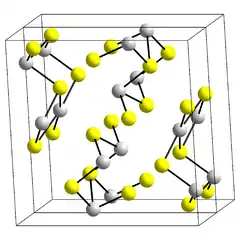
Le sulfure de bismuth(III) est un composé chimique de formule Bi2S3. Il se présente sous la forme d'un solide gris cristallisant dans le système orthorhombique avec le groupe d'espace Pnma (no 62) et les paramètres cristallins a = 1 126,9 pm, b = 397,2 pm et c = 1 112,9 pm[4]. Il est isostructurel du trisulfure d'antimoine Sb2S3, constitutif de la stibine. Il peut être obtenu par précipitation de sels de bismuth(III) avec une solution de sulfure d'hydrogène H2S :
| Sulfure de bismuth(III) | |
| |
| __ Bi3+ __ S2− Structure cristalline du sulfure de bismuth(III) |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.014.287 |
| No CE | 215-716-0 |
| No RTECS | EB3105000 |
| PubChem | 16682960 |
| SMILES | |
| InChI | |
| Apparence | poudre grise non combustible pratiquement insoluble dans l'eau[1] |
| Propriétés chimiques | |
| Formule | Bi2S3 |
| Masse molaire[2] | 514,156 ± 0,015 g/mol Bi 81,29 %, S 18,71 %, |
| Propriétés physiques | |
| T° fusion | > 600 °C[1] (thermolyse) |
| Solubilité | pratiquement insoluble dans l'eau[1] |
| Masse volumique | 7,7 g/cm3[1] |
| Précautions | |
| SGH[3] | |
 Attention |
|
| Écotoxicologie | |
| DL50 | 5 000 mg/kg (souris, oral)[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est présent dans le milieu naturel sous forme d'un minéral appelé bismuthinite. On pense qu'il précipiterait également dans l'atmosphère de Vénus pour entrer dans la composition de dépôts de « neige de métaux lourds » réfléchissants — dans les longueurs d'onde des radars — sur certains sommets vénusiens tel que Maxwell Montes[5],[6].
Le sulfure de bismuth(III) peut réagir avec des acides en libérant du sulfure d'hydrogène H2S. Il peut être produit dans le corps humain à la suite de l'absorption de sous-salicylate de bismuth, médicament employé pour traiter certaines affections de l'appareil digestif humain. Il est employé comme point de départ de la production de nombreux composés du bismuth[7].
Notes et références
- Entrée « Bismuth(III) sulfide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 décembre 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Bismuth(III) sulfide 99%, consultée le 22 décembre 2021.
- (en) L. F. Lundegaard, E. Makovicky, T. Boffa-Ballaran et T. Balic-Zunic, « Crystal structure and cation lone electron pair activity of Bi2S3 between 0 and 10 GPa », Physics and Chemistry of Minerals, vol. 32, nos 8-9, , p. 578-584 (DOI 10.1007/s00269-005-0033-2, Bibcode 2005PCM....32..578L, lire en ligne)
- (en) Laura Schaefer et Bruce Fegley Jr., « Heavy metal frost on Venus », Icarus, vol. 168, no 1, , p. 215-219 (DOI 10.1016/j.icarus.2003.11.023, Bibcode 2004Icar..168..215S, lire en ligne)
- (en) S. T. Port, V. F. Chevrier et E. Kohler, « Investigation into the radar anomaly on Venus: The effect of Venus conditions on bismuth, tellurium, and sulfur mixtures », Icarus, vol. 336, , article no 113432 (DOI 10.1016/j.icarus.2019.113432, Bibcode 2020Icar..33613432P, lire en ligne)
- (en) Pradyot Patnaik, Handbook of Inorganic Chemicals, McGraw-Hill, 2002. (ISBN 0-07-049439-8)
- Portail de la chimie