Surveillance épidémiologique
La surveillance épidémiologique est une activité de santé publique qui a pour objet de collecter, de façon continue, des informations sur les événements de santé, d’analyser ces informations pour construire des indicateurs chiffrés et de les cartographier, puis de diffuser ses résultats, afin de produire une aide aux décideurs dans le domaine de la santé humaine et animale. Essentiellement développée depuis les années 1950, elle est devenue au fil des décennies, avec la succession des crises sanitaires, un outil indispensable à l'élaboration et la conduite de toutes politiques de santé.
Définitions et objectifs
La définition élaborée dans les années 1950 par les Centres pour le contrôle et la prévention des maladies (CDC) des États-Unis est : « la surveillance épidémiologique est un processus systématique de collecte, d'analyse et d'interprétation de données sur des événements de santé spécifiques importants pour la planification, la mise en œuvre et l'évaluation des pratiques de santé publique, étroitement associée à leur juste diffusion à ceux qui ont besoin d'être informés »[1]. Elle est peu différente de celle retenue par l'Organisation mondiale de la santé, reprise dans de nombreux documents de cette agence, comme par exemple le Règlement sanitaire international : la « surveillance s’entend de la collecte, de la compilation et de l’analyse systématiques et continues de données à des fins de santé publique et de la diffusion d’informations de santé publique en temps voulu à des fins d’évaluation et aux fins d’une action de santé publique, selon les besoins »[2]. Il n'y a pas de définition standardisée, mais celles-ci correspondent à un certain consensus international. En France, il est admis en complément de la définition, que la surveillance épidémiologique doit faire l'objet d'évaluations régulières[AA 1]. Aux États-unis la dénomination préférée est celle de Surveillance en santé publique[3].
Les principaux objectifs des systèmes de surveillance épidémiologique sont de décrire, alerter et évaluer. Décrire la dynamique d'un phénomène de santé (maladie, syndrome, symptôme, comportement, etc.) dans une population aux limites connues (agglomération, région, pays, groupe de pays) sur des périodes de temps. Alerter, voire donner l'alarme, par la détection la plus précoce possible dans la population surveillée de tout phénomène inattendu, anormal, épidémique. Évaluer sur une période de temps et dans la population surveillée, les effets des programmes et politiques de santé publique (programmes de prévention, éducation, dépistage, traitements, etc.)[AA 2].
Historique

L'histoire de la surveillance épidémiologique prend ses racines aux XVIIIe siècle en Europe pour y revenir dans la seconde moitié du XXe siècle.
En 1774, une épizootie affecta le cheptel bovin dans la région de Bayonne. Félix Vicq d'Azyr est un anatomiste qui fut missionné pour identifier la maladie et proposer des mesures de contingentement. Vicq d’Azyr prit conscience que les maladies suivent des cours différents selon les circonstances et les régions et de l’intérêt qu’il y a à étudier les maladies là où elles apparaissent et quand elles s’y développent. Il obtient alors du Roi la création en 1776 de la Commission royale des épidémies et des épizooties. Il voulait par là encourager « une correspondance suivie entre tous les médecins des provinces et ceux de la capitale qui en transmettant les observations relatives aux maladies de chaque canton, mettent sous les yeux des ministres le tableau des règlements utiles, indiquent les moyens que l’Administration peut employer pour faire cette espèce de bien et empêcher cette espèce de mal »[4]. C’est ainsi que Vicq d’Azyr correspond avec environ 150 médecins français qui lui donnent régulièrement des informations sur la nature et l’étendue des maladies observées. C'est le premier réseau connu de médecins sentinelles et la première étude de morbidité au niveau d'un pays. L'entreprise montre l'intérêt pour les acteurs en périphérie de faire remonter l'ensemble des données d'une statistique sanitaire pour en débattre, pour faire progresser les connaissances et prévenir les fléaux épidémiques. Déjà les fondements d'une stratégie de surveillance basée sur le recueil en continu des données collectées, consultation après consultation, sont présents, tout autant que le besoin d'analyses, de confrontations des résultats, puis de leur diffusion vers les décideurs[5].
Pierre-Charles Alexandre Louis fut au XIXe siècle un grand clinicien de l’Hôpital de la Charité à Paris. Ayant suivi les enseignements de Pierre-Simon de Laplace à l'Académie des sciences sur la théorie des probabilités, il fut le premier à appliquer la méthode numérique à la résolution d’un problème thérapeutique. Ces travaux publiés en 1835 constituent la genèse mondialement reconnue de l’épidémiologie clinique comparative. À l’époque de très nombreux jeunes praticiens anglo-saxons venaient parfaire leur formation en France. Son influence auprès de ces derniers fut immense[5]. William Farr est justement l’un des élèves de Louis. Il s’intéresse tôt aux statistiques médicales. En 1838 à la création du General Register Office d’Angleterre et du Pays de Galles, il est chargé de compiler les statistiques de mortalité. C’est pendant les trois épidémies londoniennes de choléra entre 1848 et 1867 que son travail incarne l’apport de la surveillance au contrôle des maladies. L’histoire a retenu le nom de John Snow, son disciple, à la fin de 1854 lors de la deuxième vague épidémique. John Snow a alors montré le rôle de la fontaine publique de Broad Street dans l’épidémie au sud de Londres. Mais c’est oublier que John Snow utilisait les données collectées par William Farr qui, six ans auparavant, dès l’émergence de 1848, avait publié un tableau hebdomadaire des cas de décès attribués au choléra répartis, non pas par quartier, mais par réseau d’adduction d’eau, où il apparaissait déjà que les taux de mortalité les plus élevés étaient déplorés dans les quartiers dont l’approvisionnement en eau était le plus pollué par la Tamise. À cette occasion il avait déjà interpellé les autorités et les sociétés concessionnaires pour qu’elles accélèrent les investissements en cours. Ainsi William Farr a su concentrer ses efforts sur la mise en place d’une stratégie de collecte de données pertinentes, leur fusion, leur analyse et la diffusion des résultats aux autorités et au grand public[5],[6].

Il faut attendre les années 1950 pour qu’Alexander Langmuir (en) développe le paradigme de la surveillance moderne des maladies. Alexander Langmuir est à l’origine du bureau des enquêtes de l' Epidemic Intelligence Service créé en 1951 au début de la guerre de Corée, pour être un système de réponse rapide aux alertes biologiques que pouvait générer la guerre froide. Langmuir est partisan de l’épidémiologie de terrain, celle qui se préoccupe des collectivités et des lieux où les éclosions épidémiques se produisent, mais qui a besoin de maîtriser des outils statistiques et de disposer de données de références[5]. Car c'est généralement sur la constatation statistiquement avérée que le nombre de cas observés, là et maintenant, est supérieur au nombre de cas attendu ici même, que se base l'alerte en épidémiologie[5]. Or pour estimer justement le nombre de cas attendu, il faut dans l’idéal disposer d’un système préalable de surveillance. Ainsi donc, en pleine guerre froide, pour répondre à l’objectif de l' Epidemic Intelligence Service de dépister au plus vite et de contrôler aussitôt, toute éclosion épidémique intentionnelle, Alexander Langmuir conceptualise la surveillance épidémiologique[1]. En , alors que sévit une épidémie de poliomyélite aux États-Unis, les premiers lots de vaccins sont mis sur le marché. Mais rapidement l’euphorie suscitée par cette découverte tourne au drame car surviennent les premiers cas de poliomyélite dus au vaccin. En pleine crise, Alexander Langmuir met en place un système de recueil et de déclaration quotidienne des cas aux CDC d'Atlanta. L'analyse des données y est faite immédiatement et les résultats diffusés en retour vers les états. Cette surveillance a pour seul but l'action. Les données analysées permettent d'orienter les enquêtes qui identifient bientôt que deux lots de vaccin ont été contaminés par du poliovirus vivant, ce qui a causé 79 cas primaires (chez les vaccinés) et 126 cas secondaires (dans l'entourage des vaccinés)[7]. Cet emploi quasi extemporané de données pertinentes est à la base des systèmes de surveillance modernes[5].
Étapes
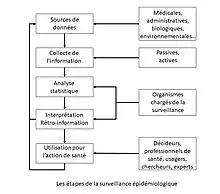
Le processus de la surveillance épidémiologique comporte classiquement cinq étapes. À partir d'une source de données (qui peuvent être médicales, biologiques, démographiques, environnementales voire administratives), la première étape est celle de la collecte de ces informations, la deuxième étape est celle de l'analyse statistique des données, la troisième étape celle de l'interprétation de l'analyse et de la restitution de celle-ci à ceux qui ont à en connaître, la quatrième étape est l'utilisation de ces résultats par les décideurs de santé et responsables politiques pour mener une action de santé publique, tandis que la dernière étape consiste à informer en retour tous les producteurs initiaux de données[AA 3].
La collecte de données peut être passive (tous les professionnels concernés sont réglementairement tenus de déclarer les cas observés) ou active (seuls les membres volontaires de réseaux spécialisés collectent des données, on parle parfois de sentinelles)[8],[9].
L'analyse et l'interprétation sont réalisées par des organismes spécialisés et dédiés, souvent de niveau national. Les utilisateurs des résultats, outre les décideurs de santé, sont aussi les professionnels de santé, les experts, les chercheurs, les réseaux d'usagers des systèmes de soins et les médias. La rétro-information vers les producteurs de données est aussi indispensable pour maintenir leur niveau d'implication et de motivation. Enfin, tout processus de surveillance doit faire l'objet d’évaluations régulières[AA 4].
Organisation

La complexité et la charge de travail que représente la maintenance permanente des systèmes de surveillance, ainsi que la capacité nécessaire à mobiliser des ressources humaines en situation d'alerte, nécessitent des professionnels spécialisés (épidémiologistes médicaux ou non-médicaux, statisticiens, professionnels de la maintenance des systèmes informatiques) et des ressources financières qui font que cette activité est le plus souvent le fait d'organismes publics ou en partenariat public-privé.
Ainsi ce sont les CDC qui en sont principalement responsables aux États-Unis, même si chaque état de l'Union dispose de sa propre structure[AA 5]. En France, c'était la mission première de l'ex-Institut de veille sanitaire, aujourd'hui intégré à l'Agence nationale de santé publique[AA 6] dite Santé publique France qui a aussi reçu la mission de conduire la politique d'éducation et prévention pour la santé et celle de préparation de la réponse aux situations d'urgence. Au Canada la mission revient à la Division de surveillance de la santé et de l'épidémiologie de Santé Canada. En Belgique c'est l'Institut scientifique de santé publique, devenu Sciensano[10] en 2018, qui est le point focal réunissant la surveillance des santés humaine et animale traduisant une implication forte de l'initiative One health. En Suisse existe un partenariat entre le réseau Sentinella et l'Office fédéral de la santé publique. Au Royaume-Uni l'organisme public coordonnateur de la surveillance est l'Agence de protection de la santé (en)[AA 7].
Dans de nombreux pays en développement, en particulier francophones, le développement des systèmes de surveillance se heurte à des difficultés multiples dont la faiblesse des moyens financiers et des ressources humaines spécialisées. La mise en œuvre du Règlement sanitaire international et de la stratégie de « surveillance intégrée des maladies »[11] prônée par l'Organisation mondiale de la santé, doivent constituer une base pour la mise en place de ces systèmes[AA 8]. En pratique les missions d'organisation, et de gestion des systèmes de surveillance épidémiologique sont réalisées par des directions spécifiques du ministère chargé de la santé ou parfois par un institut national de santé publique.
Outils et méthodes
La surveillance épidémiologique évolue en permanence en fonction des problèmes qu'elle doit résoudre (maladies émergentes, extension au domaine des maladies non transmissibles et aux problèmes socio-sanitaires, etc.), des méthodes d'analyse mises à disposition, de l'évolution des techniques d'information et du corpus législatif et normatif.
La surveillance passive
Elle utilise des données existantes, recueillies en routine par des soignants ou des laboratoires d'analyses médicales, et constitutives de dossiers médicaux, d'actes pris en charge par les assurances maladie ou de certificats à visée administrative (par exemple les certificats de décès). Encadrée par des lois et règlements elle ne fait pas appel au volontariat mais impose à une catégorie de professionnels de déclarer les informations dont ils disposent. L'exemple type est celui des maladies à déclaration obligatoire. Son statut réglementé implique que l'autorité sanitaire se charge de la gestion du système et donc de l'analyse et l’interprétation des données[AA 9].
La surveillance active
Elle utilise aussi des données existantes mais est basée sur le volontariat des collecteurs de données organisés autour d'une structure de coordination qui peut être indépendante de l'autorité sanitaire. Les déclarants étant volontaires ils doivent trouver un avantage à participer à ce système. L'exemple type historique est celui des registres de cancers, apparus pour la surveillance des cancers en 1935 dans le Connecticut puis en 1942 au Danemark et depuis étendus à d'autres types de problèmes de santé (malformations, accidents vasculaires cérébraux, etc.)[AA 10].
C'est aussi le principe des centres nationaux de référence, chacun spécialisé pour un agent pathogène infectieux, coordonnant l'ensemble des données recueillies par les laboratoires d'analyses dans un pays, et financés pour cela par l'autorité publique[AA 11].
Contrôle de qualité
Avant toute analyse des données collectées (voir ci-après), tout système de surveillance épidémiologique doit d'abord en contrôler en permanence la qualité. Un système qui se veut exhaustif dans la collecte des cas l'est-il réellement ? Un système qui se veut représentatif d'un phénomène l'est-il continûment ? La régularité, le délai de collecte des données est-il régulier et acceptable ? Tous les cas déclarés d'une maladie correspondent-ils à cette maladie (recours à des définitions standardisées des cas) ? Comment traite-t-on les données manquantes[AA 12]?
Analyse temporelle
Elle consiste a décrire la répartition des données collectées au cours du temps. Elle se fait en deux étapes, d'abord une analyse descriptive qui consiste essentiellement en l'établissement de graphiques dont le plus simple est la courbe de répartition du nombre de cas dans le temps (par jour, semaine, mois, année, décennie). Pour mieux appréhender les effets des tendances de fond (variations lentes sur de grandes périodes dites variations séculaires), de la saisonnalité (variations répétées chaque année), et des accidents à court terme (épidémies, etc.) des techniques de lissage des données sont utilisées comme le recours aux moyennes mobiles. La seconde étape de l'analyse temporelle consiste à tester des hypothèses élaborées à partir de l'observation des courbes. Cette analyse ne compare pas entre elles les données brutes mais les données cumulées d'une période de temps (nombre de cas d'une semaine, d'un mois, etc.). Or chaque petite période est liée (dépendante) aux autres périodes en fonction des tendances constatées à la première étape de l'analyse temporelle. L'analyse doit donc prendre en compte d'une part l’existence possible de facteurs de confusion, et d'autre part contrôler les dépendances temporelles[AA 13].
Analyse spatiale
L'analyse spatiale des données a pour but de chercher et d'identifier les groupements de cas dans l'espace. L'hypothèse de départ étant que normalement les cas sont répartis au hasard dans l'espace et que tout groupement de cas peut être le fait d'un facteur de risque présent dans un lieu particulier. L'outil de cette analyse est donc la cartographie des cas. Encore récemment les cas étaient rapportés manuellement sur des cartes imprimées ou dessinées sur papier. L'irruption des systèmes d'information géographique a profondément modifiée les capacités d'analyse spatiale en épidémiologie. Un des problèmes essentiels à prendre en compte pour l'interprétation des cartes reste la densité de la population qui varie d'un espace géographique à l'autre et doit donc être contrôlée dans l'analyse des données, par exemple par la technique du cartogramme. Le but de l'analyse est donc de repérer des agrégats de cas dans l'espace et dans le temps (encore appelés agrégats spatio-temporels, grappes ou en anglais cluster)[AA 14].
Calculs d'indicateurs en population
Il est illusoire d'évaluer l'importance épidémiologique d'une maladie dans une population par le seul dénombrement des cas sans tenir compte de la variabilité des effectifs de population (dans le temps et dans l'espace), de la variabilité de la structure des populations (répartition par âge, sexe, etc.). Ce principe de l'épidémiologie s'applique tout autant à la surveillance épidémiologique. C'est pourquoi les données déclarées dans un système de surveillance sont, à l'étape d'analyse, rapportées sous forme de taux d'incidence (et ses dérivés : taux de mortalité, taux de natalité, taux d'attaque, etc.), de ratio, ou de densité d'incidence qui permettent des comparaisons et de tester des hypothèses[13]. Outre leur intérêt pour l'alerte devant tout phénomène inattendu, l'établissement des indicateurs et leur suivi dans le temps est indispensable à la gestion et l'évaluation des programmes de santé publique[AA 15].
La surveillance syndromique
L'objectif principal de la surveillance étant d'identifier le plus tôt possible l'apparition d'un phénomène anormal, la recherche de techniques faisant "gagner du temps" préoccupe les décideurs comme les spécialistes. Le développement des outils de calculs automatisés des données disponibles en routine d'une part et la mise en évidence de phénomènes précurseurs du diagnostic étiologique des épidémies d'autre part ont permis de faire émerger le concept de surveillance syndromique. L'exemple inaugural a été celui d'une épidémie de gastro-entérite dans le Milwaukee en 1993. Le diagnostic formel de celle-ci étaient fait le par deux laboratoires d'analyses médicales. A posteriori la recherche de données de routine produites par d'autres sources moins conventionnelles (au sens de la surveillance épidémiologique) a montré que les statistiques de vente des médicaments anti-diarrhéiques délivrés sans ordonnance en pharmacie avaient plus que triplé et que cette élévation était visible dès [14]. Les chiffres de vente d'un médicament ne constituent pas une certitude de diagnostic, mais leur brutale variation interroge sur l'existence d'un phénomène anormal. Si ces données sont collectées en routine et qu'elles peuvent être analysées immédiatement grâce à des outils de calculs automatisés, on peut disposer là d'un outil d'alerte. C'est le principe de la surveillance syndromique dont la définition (trop récente pour être universellement acceptée) est « une surveillance fondée sur des données enregistrées en routine... de façon automatique et transmises (et analysées) sans délai »[AA 16]. Bien que contestable, le qualificatif de "syndromique" s'est progressivement imposé, alors que les données ainsi utilisées et surveillées puissent être certes un syndrome dont le diagnostic final n'est pas établi (par exemple les syndromes grippaux, qui ne sont pas tous des vraies grippes) ou un simple symptôme (fièvre, diarrhée, etc.) mais aussi des données de consommation de santé (boites de tel médicament, passages aux services d'urgences, nombre de consultations de ville, appels à des numéros gratuits d'aide aux malades, etc.) d'absentéisme (scolaire, reçus par les assurances maladie), de surveillance environnementale (surveillance des eaux de consommation, des aliments manufacturés, etc.) ou du nombre de décès. Avec l'irruption sur la scène politique et sanitaire du risque biologique provoqué, à la suite de la crise des enveloppes contaminées au bacille du charbon survenue aux États-Unis après les attentats du 11 septembre 2001 le développement des stratégies de surveillance syndromique s'est rapidement développé aux États-Unis comme en Europe[AA 17].
Détection et investigation des épidémies
Une épidémie se définit simplement comme la survenue d'un nombre de cas supérieur au nombre attendu dans un espace donné et une période donnée. Si la maladie est réellement nouvelle, inconnue jusque là (on parle de maladie émergente) le premier cas est déjà un phénomène anormal. Mais si la maladie est connue et sévit de façon ordinairement modérée dans une région donnée, c'est alors l'augmentation au-delà du nombre habituellement observé qui constitue une alerte[AA 18].
Dès lors la surveillance doit répondre à deux questions : quel est le nombre attendu de cas ici et maintenant et, à partir de quel dépassement de ce nombre on considère que la situation est anormale. La première question nécessite que la surveillance d'une maladie donnée soit en place et efficace avant la survenue d'une épidémie, si possible depuis plusieurs années, pour avoir fourni suffisamment de données permettant de calculer en moyenne le nombre de cas attendu dans chaque région pour chaque période. La seconde question nécessite de déterminer un seuil d'alerte, lequel doit être assez performant, c'est-à-dire capable de reconnaître au plus tôt une situation qui se dégrade (seuil sensible) mais sans engendrer de fausses alertes (seuil spécifique)[AA 19].
Il faut ensuite prévoir au plus tôt l'ampleur et la durée possible de l'épidémie ce qui se fait en établissant le «temps de doublement des cas» et le «taux de reproduction de base» lesquels se calculent à partir des données de la surveillance épidémiologique. Une fois l'alerte confirmée il faut investiguer l'épidémie d'une part au moyen d'enquêtes (le plus souvent enquête cas-témoins ou enquête de cohorte rétrospective) dont le but est de tester des hypothèses relatives aux causes du phénomène, et d'autre part, dans le cas des maladies infectieuses, en mobilisant les laboratoires d'analyses biologiques experts pour typer précisément l'agent responsable.[AA 20]
Domaines d'utilisation
Initialement apparue pour surveiller les maladies épidémiques et en contrôler la diffusion, le champ d'intérêt de la surveillance épidémiologique n'a cessé de se développer depuis la seconde moitié du XXe siècle. Sans entrer dans les détails et pour la seule France, on recense un système de surveillance épidémiologique : des maladies infectieuses en général[AA 21] et tout particulièrement celles pouvant être prévenues par la vaccination[AA 22] et celles liées aux soins (infections nosocomiales)[AA 23], et de tous les événements indésirables (pas seulement infectieux) liés aux soins[AA 24], des maladies liées à l'environnement (surveillance de l'air et de l'eau, des insectes vecteurs de maladies, saturnisme, l'intoxication au monoxyde de carbone)[AA 25], des maladies chroniques (historiquement les cancers, puis plus récemment les maladies cardio-vasculaires, le diabète, la bronchopneumopathie chronique obstructive, etc.)[AA 26], des maladies professionnelles[AA 27], de la périnatalité[AA 28], des traumatismes et accidents[AA 29], des conséquences des catastrophes naturelles et industrielles[AA 30], la surveillance sanitaire des grands rassemblements humains (sportifs, culturels, religieux, réfugiés, etc.)[AA 31], et la circulation des souches bactériennes résistantes aux antibiotiques[AA 32], etc.
Par pays
- En France, la surveillance épidémiologique est assurée par l'Agence nationale de santé publique, appelée aussi Santé Publique France.
Notes et références
Notes
Références
- Ouvrage de Pascal Astagneau et Thierry Ancelle (cf. Bibliographie),
- p. 7.
- p. 8.
- p. 7.
- p. 109-112.
- p. 16-18.
- p. 14-17.
- p. 16-17.
- p. 321-324.
- p. 8.
- p. 9, 177-179.
- p. 9.
- p. 74-80, 109-112.
- p. 35-56.
- p. 57-67.
- p. 303-309.
- p. 95-108.
- p. 95-108.
- p. 81.
- p. 81-83.
- p. 83-85.
- p. 115-130.
- p. 131-138.
- p. 139-150.
- p. 158-165.
- p. 166-176.
- p. 177-188.
- p. 189-201.
- p. 202-212.
- p. 213-220.
- p. 231-236.
- p. 237-250.
- p. 152-157.
Autres références
- (en) Alexander Langmuir, « The surveillance of communicable diseases of national importance », New England Journal of Medicine, vol. 268, , p. 182-192 (ISSN 0028-4793).
- OMS, Règlement sanitaire international : 2005, Genève, Organisation mondiale de la santé, , 3e éd., 100 pages (ISBN 978-92-4-258049-5, lire en ligne).
- (en) Stephen B Thacker et Ruth L. Berkelman, « Public Health surveillance in the United States », Epidemiologic Reviews, vol. 10, , p. 164-190 (ISSN 0193-936X).
- Félix Vicq d'Azyr (s.l.), Mémoire instructif sur l’établissement fait par le Roi d’une commission ou société et correspondance de Médecine, , 60 p. (lire en ligne).
- Jean-Paul Boutin, Livre de l'École du Val-de-Grâce : Annales 2009, Paris, La documentation française, , 337 p. (ISBN 978-2-11-007824-7), « La surveillance sanitaire des combattants », p. 269-289.
- (en) Alexander Langmuir, « William Farr: founder of modern concepts of surveillance », International Journal of Epidemiology, vol. 5, , p. 13-18 (ISSN 0300-5771).
- (en) Luis Barreto et al., « Polio vaccine development in Canada : contributions to global polio eradication », Biologicals, vol. 34, , p. 91-101 (ISSN 1045-1056).
- (en) David L. Streiner et Geoffrey R. Norman, PDQ Epidemiology, Hamilton (Ontario), B.C. Decker Inc., , 2e éd., 160 p. (ISBN 1-55009-077-1), p. 4-6.
- Pierre Brès, L'action de santé publique dans les situations d'urgence créées par des épidémies : guide pratique, Genève, Organisation mondiale de la santé, , 314 p. (ISBN 92-4-254207-5), p. 27-33.
- « À propos de Sciensano », sur Sciensano (consulté le ).
- Surveillance Intégrée des Maladies et Riposte dans la Région Africaine : Manuel de formation à la surveillance à base communautaire, Bureau régional de l’OMS pour l’Afrique, , 50 p. (ISBN 978-92-9023-298-8, lire en ligne).
- (en) Julia R. Gog et al., « Spatial Transmission of 2009 Pandemic Influenza in the US », PLOS Computational Biology, (e-ISSN 1553-7358, lire en ligne, consulté le ).
- Milos Jenicek et Robert Cléroux, Épidémiologie : Principes, techniques, applications, Paris et Québec, Maloine S.A. et Edisem, , 2e éd., 454 p. (ISBN 2-224-00814-7 et 2-89130-069-6), p. 43-77.
- (en) Mary E. Proctor, « Surveillance data for waterborne illness detection: an assessment following a massive waterborne outbreak of Cryptosporidium infection », Epidemiology Infection, vol. 120, , p. 43-54.
Voir aussi
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- Pascal Astagneau et Thierry Ancelle, Surveillance épidémiologique : Principes, méthodes et applications en santé publique, Paris, Lavoisier, Médecine Sciences Publications, , 360 p. (ISBN 978-2-257-20426-4, lire en ligne).
 .
.
Articles connexes
Liens externes
- Portail de la médecine
- Portail des probabilités et de la statistique
- Portail des maladies infectieuses