Syndrome du défilé thoracobrachial
Le syndrome du défilé thoracobrachial ou de la traversée thoraco-brachiale (STTB), en anglais : thoracic outlet syndrome, est une atteinte du paquet vasculaire et nerveux[1] excessivement comprimé dans son passage entre les muscles scalènes antérieurs et moyens.
| Spécialité | Neurologie, chirurgie vasculaire et chirurgie thoracique |
|---|
| CISP-2 | N94 |
|---|---|
| CIM-10 | G54.0 |
| CIM-9 | 353.0 |
| DiseasesDB | 13039 |
| MedlinePlus | 001434 |
| eMedicine | 316715 |
| MeSH | D013901 |
| Patient UK | Cervical-ribs-and-thoracic-outlet-syndrome |
![]() Mise en garde médicale
Mise en garde médicale
Diverses dénominations
Des noms différents peuvent être employés pour décrire le même syndrome[2] :
- Syndrome costo-claviculaire ;
- syndrome de traversée thoraco-cervico-brachiale (STTB) ;
- syndrome du défilé thoraco-brachial ;
- syndrome costoclaviculaire ;
- syndrome du défilé cervico-thoraco-axillaire ;
- syndrome de compression costo-claviculaire ;
- syndrome du défilé costo-claviculaire ;
- syndrome de compression costoclaviculaire ;
- syndrome du défilé costoclaviculaire.
En anglais :
- aperture syndrome, thoracic outlet ;
- nerve compression syndrome, thoracic outlet ;
- outlet syndrome, thoracic ;
- syndrome, costoclavicular ;
- syndromes, thoracic outlet ;
- thoracic outlet syndrome, neurogenic ;
- arterial thoracic outlet syndrome ;
- neurogenic thoracic outlet syndrome ;
- outlet syndromes, thoracic ;
- syndrome, scalenus anticus ;
- thoracic outlet nerve compression syndrome ;
- thoracic outlet syndromes ;
- costoclavicular syndrome ;
- neurologic syndrome, thoracic outlet ;
- scalenus anticus syndrome ;
- syndrome, thoracic outlet ;
- thoracic outlet neurologic syndrome ;
- venous thoracic outlet syndrome ;
- costoclavicular syndromes ;
- neurovascular syndrome, thoracic outlet ;
- superior thoracic aperture syndrome ;
- syndromes, costoclavicular ;
- thoracic outlet neurovascular syndrome.
Historique
Le traitement des syndromes de la traversée thoracobrachiale (STTB) fait l’objet de controverses.
L’une d’entre elles concerne le principe de la résection systématique de la première côte.
De 1910 à 1927
Plusieurs résections costales, effectuées avec succès, sont rapportées.
De 1927 à 1962
À la suite des publications d’Adson et Coffey[réf. souhaitée], la scalénectomie isolée est devenue la technique de choix.
À partir de 1962
Devant les échecs de la scalénectomie, les résections de la première côte connaissent un nouvel essor.
Plusieurs voies d'abord sont décrites presque simultanément :
- postérieure par Clagett[réf. souhaitée] ;
- thoracique par Servelle[réf. souhaitée] et
- axillaire par Roos[réf. souhaitée] en 1966.
Années 1980
Le débat est relancé
à la suite de la publication de complications graves liées à la résection de la première côte.
2007
Ce débat demeurait d’actualité, ainsi que la question du choix de la voie d’abord, au moins chez les chirurgiens orthopédistes…
Physiopathologie
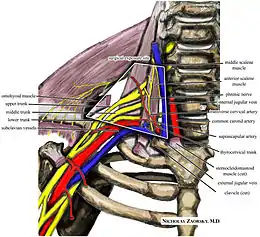
Anatomie normale
La traversée cervicothoracobrachiale peut être définie comme la succession de cinq espaces parcourus par les éléments vasculonerveux :
- le défilé intercostoscalénique ;
- le défilé préscalénique ;
- le canal costoclaviculaire ;
- le tunnel sous-pectoral et
- le billot huméral.
Défilé intercostoscalénique
C’est un espace prismatique triangulaire délimité par le bord postérieur du muscle scalène antérieur, le bord antérieur du muscle scalène moyen et la face supérieure de la première côte. L’obliquité de la face supérieure de la première côte dépend de la morphologie du sujet. L’angle supérieur du défilé est très étroit (souvent inférieur à 20°) et le bord inférieur est comblé par des fibres arciformes émanant des muscles scalènes antérieur et moyen, et se perdant sur le périoste costal. Les trois muscles scalènes forment une masse unique en haut, mais se divisant en bas pour faire place aux organes de passage.
Des anomalies de division musculaire expliquent la présence de formations musculaires qui peuvent rétrécir en permanence le défilé intercostoscalénique. On distingue :
- les muscles interpédiculaires supérieurs (entre le muscle scalène moyen et antérieur, 2 % des sujets) ;
- les muscles interpédiculaires inférieurs, correspondant au petit scalène de Winslow (présent chez 3 % des sujets) qui traverse les racines inférieures du plexus brachial ou s’interpose entre ces racines et l’artère sous-clavière.
L’artère et les troncs nerveux sont amarrés par trois types de ponts fibreux infra-artériels. Les premiers siègent au niveau de la berge interne du défilé. Ils relient les muscles scalènes antérieur et moyen. Cette formation n’adhère pas à l’artère. Les deuxièmes siègent au niveau de la berge externe du défilé. Ils sont très adhérents à l’artère. Les troisièmes sont plus constants, situés à l’intérieur même du défilé, ils fixent l’artère aux parois de ce dernier par un tissu cellulofibreux lâche mais ferme. La méconnaissance de ces éléments fibreux, lors des sections des insertions costales des scalènes ou des résections de la première côte sans artériolyse, rend insuffisant le geste curateur et peut même aggraver une éventuelle compression artérielle.
En effet, l’artère est alors sous-tendue par un anneau fibreux non amarré et soulevée par les muscles rétractés. De plus, les muscles scalènes tendent à se rapprocher une fois leurs attaches costales disparues. Des amarres fibreuses solidarisant les racines plexiques aux parois existent à tous les niveaux du défilé. Elles sont particulièrement denses à la partie haute du défilé. Il faut inciser cette expansion fibreuse pour découvrir et libérer les nerfs. Il existe également des attaches entre l’adventice artérielle, les muscles et le plexus brachial. L’artère sous-clavière chemine dans l’angle antéro-inférieur de l’espace interscalénique. Les troncs nerveux ont une disposition très variable. Ils sont presque toujours aplatis selon un plan frontal, et non pas cylindriques ; d’autre part, la racine C7 a tendance à se placer au-dessus de l’artère, la racine C8-T1 étant en arrière.
Défilé préscalénique
Le défilé préscalénique correspond au passage de la terminaison de la veine sous-clavière et se situe entre l’extrémité antérieure de la première côte, en bas, l’extrémité sternale de la clavicule doublée du muscle sousclavier et du tendon du scalène antérieur. Ce défilé se modifie considérablement avec les mouvements de la clavicule.
Canal costoclaviculaire
Ce canal est situé entre la face inférieure de la moitié interne de la clavicule et la face supérieure des segments moyen et antérieur de la première côte. Les variations du muscle subclavier conditionnent la forme de son orifice antérieur. Dans 25 % des cas seulement, il s’agit d’un muscle peu épais, cylindrique. Il se présente, le plus souvent, comme une véritable lame musculaire, débordant vers l’avant la face inférieure de la clavicule. Suivant son importance et sa longueur, le rebord tendineux inférieur du muscle transforme l’orifice antérieur du canal costoclaviculaire en un orifice ostéotendineux pratiquement indéformable et vulnérant pour les éléments vasculonerveux qui viennent à son contact. Le canal costoclaviculaire est long et le muscle scalène antérieur glisse sous sa berge postérieure. Il est difficile de discerner une ligne de démarcation nette entre la berge externe du défilé intercostoscalénique et l’orifice postérieur du canal costoclaviculaire. Le canal costoclaviculaire est divisé en un compartiment antéro-interne lymphoveineux et un compartiment postéroexterne neuroartériel. Ces deux compartiments ont un diamètre très réduit avec de grandes variations liées aux mouvements de la clavicule. La veine est surtout comprimée dans le compartiment antéro-interne, entre le muscle sous-clavier et la première côte. Il existe en effet des adhérences constantes entre la gaine du muscle sous-clavier et la veine axillaire qui rendent celle-ci solidaire des mouvements de la clavicule. Il faut également noter la présence de valvules veineuses qui sont constantes et importantes, leur rôle hémodynamique pouvant expliquer en partie certaines thromboses veineuses du membre supérieur. Elles sont situées au croisement de la veine sous-clavière avec la première côte.
Tunnel sous-pectoral
Le tunnel sous-pectoral est limité, en arrière, par la paroi dorsale de la fosse axillaire et, en avant, par le muscle petit pectoral. Dans 15 % des cas, le bord externe du muscle petit pectoral est fibreux, épais et peut former un arceau ou un rebord rectiligne agressif pour les vaisseaux. Les branches du plexus brachial cheminent avec l’artère et la veine axillaires dans un espace relativement large, comblé par un tissu cellulograisseux et ganglionnaire. Ce tissu de glissement peut manquer chez les sujets maigres ou longilignes.
Billot huméral
En position indifférente, le paquet vasculonerveux occupe le grand axe du creux axillaire, demeurant ainsi à distance de la tête humérale. En abduction du bras, à partir de 90°, l’artère se plaque contre la tête humérale.
Ce mécanisme de compression intermittente, dynamique, serait à l’origine d’un nombre sous-estimé de complications artérielles du STTB[5].
Âge
L’âge joue un rôle évident, comme tendrait à le prouver la plus grande fréquence des compressions vasculonerveuses observées chez l’adulte jeune. La descente de la paroi antérieure du thorax, avec l’âge, entraînerait un déplacement postérieur et inférieur de la clavicule. De plus, la cage thoracique s’élargit transversalement à partir de la puberté, jusqu’à l’âge adulte. On constate également une convergence des deux mors de la pince costoclaviculaire.
Sexe
La plus grande fréquence du syndrome de la traversée thoracobrachiale chez les femmes est plus difficile à expliquer. Il n’existe en effet que de discrètes différences dans les mensurations thoraciques entre les deux sexes. En revanche, l’imprégnation œstroprogestative chez la femme pourrait être responsable d’une laxité musculoligamentaire entraînant la chute de l’épaule.
Type somatique
Les variations selon le type somatique sont plus évidentes.
Chez les sujets longilignes, les clavicules sont nettement tombantes et le diamètre biacromial réduit, prédisposant ainsi aux syndromes de la traversée thoracobrachiale.
À l’inverse, chez les brévilignes, le thorax est large, les clavicules sont horizontales ; le risque de compression serait moindre.
Certains sportifs de haut niveau peuvent présenter un STTB, du fait de l’hypertrophie des muscles scalènes. C’est notamment le cas de nageurs de compétition.
Au repos, le paquet vasculonerveux franchit sans difficulté la traversée cervicothoracobrachiale ; il n’en va pas de même au cours des mouvements de la ceinture scapulaire et du membre thoracique. En abduction, la taille du canal costoclaviculaire diminue par rotation axiale de la clavicule, venant comprimer les éléments vasculonerveux contre la première côte.
Les éléments vasculonerveux qui traversent cette région n’ont qu’un jeu physiologique très étroit, qui est encore réduit en cas d’anomalie musculoligamentaire ou osseuse.
Certaines études anatomiques relèvent un taux d’anomalies de 70 %, mais elles ne sont pas toujours symptomatiques[6].
Au niveau du défilé intercostoscalénique
Les irrégularités de perforation de la masse scalénique par le pédicule vasculonerveux, déjà évoquées plus haut, expliquent les différentes possibilités de brides ou frondes interscaléniques pouvant passer dans le plexus brachial, au-dessus ou sous l’artère.
Elles correspondent aux brides de type IV de Roos.
Les faisceaux fibreux interscaléniques situés au-dessus de la première côte peuvent être particulièrement développés et se prolonger jusqu’à la jonction costo- ou chondrosternale, ce qui correspond aux brides de type VII et VIII de Roos.
Il s’agit, le plus souvent, d’un fort ligament transversocostal (type III de Roos).
Au niveau du canal costoclaviculaire
Le pédicule vasculonerveux n’est menacé dans le compartiment externe qu’en cas de prolongement hypertrophique du ligament coracoclaviculaire.
Au niveau du compartiment interne, ce sont les anomalies du muscle sous-clavier, évoquées plus haut, qui peuvent être en cause.
Congénitales
De telles anomalies sont fréquentes (de l’ordre de 1 % des sujets) et sont en cause dans 10 % des STTB[7].
Les côtes cervicales
Présentes chez 0,6 à 5 ‰ des sujets, et bilatérales dans 50 % des cas.
On distingue deux grands types de côtes cervicales :
- les côtes complètes, se rattachant au manubrium sternal par un cartilage individualisé ou bien confondu avec celui de la première côte ;
- les côtes incomplètes, pouvant
- présenter une extrémité libre qui flotte dans le creux sus-claviculaire ou
- être prolongée en avant par un trousseau fibreux qui s’attache à la première côte.
En arrière, la côte cervicale peut être unie à la septième vertèbre par une articulation avec tête et tubercule costaux, ou par une soudure entre la vertèbre et la côte.
Dans le premier cas, la libération de la côte se fait par désarticulation, et dans le second par section osseuse.
Les apophysomégalies de C7
Plus fréquentes (1 % des sujets) et souvent associées à une côte cervicale.
Les anomalies de la première côte
Présentes chez environ 3 % des sujets. L’anomalie la plus fréquente est l’agénésie de l’arc antérieur de la première côte. Elle s’accompagne d’une surélévation de la première côte agénésique, de trousseaux fibreux qui prolongent la première côte et, dans la moitié des cas, d’une néoarthrose C1-C2 qui réalise un tubercule volumineux et rétrécit encore le défilé. Les exostoses et les synostoses sont plus rares. Seule une minorité de ces anomalies devient symptomatique ; 5 à 10% des côtes cervicales seraient pathogènes. La mise en cause d’une anomalie osseuse congénitale dans les STTB varie entre 10 et 20 % selon les auteurs.
Autres anomalies congénitales
Sont plus rarement en cause : pseudarthroses congénitales de la clavicule ou surélévations congénitales de l’omoplate.
Pathologie claviculaire
Une étiologie claviculaire n’est retrouvée que dans 0,5 à 9 % des séries de STTB. Il s’agit essentiellement des conséquences de traumatismes, cal vicieux ou hypertrophiques, pseudarthroses après fractures, ainsi que de luxations sternoclaviculaires ou acromioclaviculaires.
Autres causes acquises diverses
Exceptionnelles, elles sont publiées sous forme de cas isolés (tumeurs de la clavicule, hyperostose sternocostoclaviculaire ou encore ostéomyélite de la clavicule).
Post-traumatique
Le rôle favorisant ou déclenchant d’un traumatisme dans la survenue d’un STTB est signalé dans de nombreux travaux ; il varie entre 16 et 92 % des cas[8].
Les traumatismes minimes mais répétés peuvent avoir les mêmes conséquences.
En dehors des lésions osseuses déjà envisagées, on peut retenir le rôle des lésions musculaires (étirement, déchirure, hématome, désinsertion) évoluant vers une fibrose cicatricielle.
Le délai d’apparition de la symptomatologie peut toutefois être suffisamment long pour que la relation de causalité soit douteuse. Il se pose alors des problèmes médicolégaux et thérapeutiques qui doivent rendre prudent dans la conduite thérapeutique.
Chirurgie « à la carte »
De nombreuses formations anatomiques sont ainsi susceptibles de provoquer des compressions vasculonerveuses.
Les syndromes de la traversée cervicothoracobrachiale apparaissent dès lors trop complexes pour être attribués à la seule première côte.
Plutôt que de procéder systématiquement à une résection costale, il faudrait tenter de définir, par des explorations dynamiques, les éléments anatomiques compressifs responsables de la symptomatologie, et proposer une chirurgie « à la carte »
Diagnostic
Le diagnostic repose essentiellement sur l’interrogatoire et l’examen clinique.
Symptomatologie dite « neurologique »
La compression intermittente des structures vasculonerveuses provoque, le plus souvent, une symptomatologie dite « neurologique ».
Ce syndrome comporte alors des douleurs et des paresthésies du cou, de l’épaule, du bras, de la main, de la paroi antérieure du thorax et de la région interscapulo-thoracique. Il s’agit souvent de signes bilatéraux.
La symptomatologie n’est pas tronculaire à la différence de compressions du nerf ulnaire, au coude, ou du nerf médian, au poignet, à rechercher de principe, parfois associées.
La symptomatologie dépend du niveau de la compression radiculaire, avec distinction entre :
- STTB hauts impliquant les racines C5, C6 et C7, et
- STTB bas concernant plutôt les racines C7,C8 et T1.
Des céphalées, fréquemment décrites, ne doivent pas être trop rapidement mise sur le compte d’une « contracture secondaire des muscles trapèze et paravertébraux ».
Les symptômes sont déclenchés tantôt par des mouvements d’abduction et d’antépulsion prolongés, tantôt par la position allongée.
Examen clinique
Il recherche des troubles sensitifs ou une amyotrophie, en fait rares.
La palpation de la fosse sus-claviculaire et du triangle inter-scalénique peut déclencher la douleur.
Compression artérielle
Un STTB est plus rarement le fait d’une compression artérielle qui, localisée et répétée, peut entraîner une sténose et parfois une dilatation post-sténotique ou anévrysme.
L’altération de la paroi artérielle provoque l’apparition de microembolies digitales, d’embolies tronculaires graves ou d’une thrombose de l’artère sous-clavière.
Manifestations cliniques
Elles comprennent la claudication intermittente du membre supérieur, les douleurs de repos de la main et des doigts, la pâleur et le refroidissement de ceux-ci, la présence d’hémorragie sous les ongles, d’ulcères ou de gangrènes digitaux.
Diagnostic précoce
Ces signes d’ischémie très évoluée (nécrose tissulaire!) sont, presque toujours, la conséquence d’épisodes emboliques multiples, à répétition (« épisodes »), qui peuvent être évités par un diagnostic précoce.
Moins de 5 % des ischémies aiguës du membre supérieur sont dues à un STTB[9].
Phénomène de Raynaud unilatéral
Tous ces symptômes peuvent s’associer à un phénomène de Raynaud unilatéral, mais sans qu’un lien de cause à effet soit démontré.
Causalgie
Dans quelques cas, les symptômes du STTB peuvent avoir évolué jusqu’à ressembler à ceux d’une causalgie (dystrophie sympathique réflexe) avec vasospasme, œdème diffus et hypersensibilité.
Compression veineuse
Un STTB avec compression veineuse peut provoquer un œdème, une cyanose, une fatigabilité rapide de l’avant-bras à l’effort, en absence de toute lésion artérielle et des douleurs du membre supérieur.
Une compression chronique peut aboutir à une thrombose, avec d’éventuelles séquelles post-phlébitiques.
Associations
Ces différents syndromes, a minima, « nerveux », artériel et « veineux », se combineraient volontiers chez un même sujet.
Manœuvres classiques
L’examen clinique cherche à reproduire le phénomène de compression par les manœuvres classiques : Kalb, Roth, Wright…
Manœuvre d’Adson
L’abolition du pouls radial en inspiration forcée et rotation cervicale opposée met en évidence une compression artérielle. Elle est souvent positive en cas de STTB « neurologique ».
Manœuvre du « chandelier »
Elle aurait la meilleure valeur diagnostique. Il est demandé au patient d’ouvrir et de fermer les poings de façon répétée, les bras en position « haut-les-mains ». Le test, pour être positif, doit reproduire rapidement la symptomatologie.
Examen para-cliniques ou d’imagerie
Les examens doppler et échographique, artériel et veineux, statique et surtout dynamique, complètent cet examen. Aucun examen para-clinique ou d’imagerie ne peut se substituer au diagnostic clinique de STTB.
Les radiographies standards du rachis cervical et du thorax recherchent d’éventuelles anomalies osseuses.
L’angiographie en abduction permet de faire le diagnostic de compression, mais elle est surtout réservée à l’exploration des complications artérielles (sténoses, anévrisme).
La réalisation d’une tomodensitométrie (TDM) cervicale ou d’une imagerie par résonance magnétique (IRM) est généralement peu utile en cas de STTB neurologique.
Ces examens permettent le diagnostic différentiel de discopathie, de cervicarthrose, voire de lésion du système nerveux central (syringomyélie).
L’étude comparative des images du scanner spiralé et des constatations anatomiques montrerait une bonne corrélation anatomo-radiologique.
Images d’IRM 3D
Les images d'IRM 3D seraient un apport utile pour mettre en évidence les compressions vasculaires (veineuses et/ou artérielles) en réalisant des séquences en manœuvres dynamiques[10],[11].
Mais un aspect de compression n’est pas toujours pathologique.
La phlébographie dynamique serait utile dans le bilan d’une compression veineuse.
Elle peut montrer des images de compression ou de sténose avec dilatation d’amont.
L’échographie endovasculaire donnerait des résultats comparables à ceux de la phlébographie, dans l’exploration des STTB veineux[12].
Examens électrophysiologiques
Ils représentent une aide au diagnostic en montrant des signes positifs (atteinte motrice des petits muscles de la main, diminution du potentiel sensitif distal du nerf ulnaire) et en éliminant des diagnostics différentiels (syndrome du canal carpien ou de compression du nerf ulnaire au coude).
Il en est de même pour les potentiels évoqués somato-sensitifs, qui permettent de mieux sélectionner les malades candidats à une intervention chirurgicale et d’en apprécier plus objectivement les résultats.
La principale limite des examens électrophysiologiques est de présenter un taux élevé de faux négatifs[13].
Le bloc anesthésique du muscle scalène sous contrôle électrophysiologique permettrait de mieux sélectionner les malades pouvant bénéficier d’une décompression chirurgicale[14].
Bilan psychologique
Une part doit être accordée au bilan psychologique[15] que le diagnostic soit douteux ou non et que les examens électro-physiologiques soient “normaux” ou non.
Prise en charge
Indications opératoires
Comme toujours en matière de « douleur », pure ou prédominante, les indications opératoires seraient posées avec une grande prudence[16], tenant compte de la « composante émotionnelle »…
De façon générale, et sauf s’il existe une anomalie osseuse ou une forme compliquée évidentes, l'intervention chirurgicale ne serait décidée qu'après échec d'une gymnastique rééducatrive « ouvrant » la ceinture scapulaire, par une kinésithérapie, au fait des problèmes que posent le STTB[17].
Pour les formes nerveuses et vasculaires
L’indication opératoire est posée assez aisément lorsqu’il existe des anomalies ostéoligamentaires ; ailleurs elle repose sur un faisceau d’arguments.
Dans tous les cas l’indication doit être prudente et retenue avec beaucoup de précautions dans les formes post-traumatiques.
Thrombose veineuse aiguë sous-clavière
Si la thrombose veineuse aiguë sous-clavière est vue précocement, elle peut être traitée par thrombectomie, fibrinolyse et/ou recanalisation[18].
Formes chroniques
Dans les formes chroniques, la reconstitution directe de la veine sous-clavière est souvent décevante.
Une éventuelle sténose veineuse résiduelle peut être traitée par angioplastie transluminale après la décompression chirurgicale.
Indication opératoire préventive controlatérale
L’intérêt d’une indication opératoire préventive controlatérale même en présence de signes de compression veineuse modérés n’est pas prouvé.
Anévrisme, ulcération, thrombose
La zone pathologique est réséquée et la continuité artérielle est rétablie soit par résection.
Anastomose directe
En l’absence de tension, ce qui est souvent le cas après résection de la première côte.
Interposition d’un greffon saphène
l’emploi de prothèse étant dangereux dans cette zone très mobile
Lésions distales (embolies, troubles vasomoteurs)
Les tentatives d’embolectomies tardives et les pontages distaux sur les artères de l’avant-bras donnent des résultats décevants.
On peut alors avoir recours à une sympathectomie dorsale supérieure qui peut être réalisée par voie sus claviculaire.
Voies d’abord
Elle ou elles sont à choisir en fonction de quatre facteurs :
- la symptomatologie prédominante,
- les gestes qui doivent être associés (résection de côte cervicale, d’apophysomégalie, de trousseau ligamentaire, restauration artérielle ou veineuse, sympathectomie thoracique),
- le morphotype (obésité et gros muscles rendant dangereuse la voie axillaire) et
- l’expérience de l’opérateur.
Pour les formes nerveuses
Pour les formes plexiques basses, deux voies se discutent : sus-claviculaire et axillaire.
La voie postérieure peut être envisagée dans les récidives des manifestations nerveuses et dans les échecs d’interventions incomplètes menées par d'autres abords.
En cas de compression plexique diffuse, on peut être amené à associer les voies sus-claviculaire et axillaire.
Pour les formes artérielles non compliquées
Voie axillaire ou sus-claviculaire selon l’expérience de l’opérateur et en évitant la première chez le sujet musclé.
Anévrysme, ulcération, thrombose
La voie sus-claviculaire est la plus utilisée pour faire la résection costale[15] et la réparation vasculaire.
Une courte voie sous-claviculaire peut être nécessaire, selon l’étendue de la lésion artérielle.
Lésions distales (embolies, troubles vasomoteurs)
La résection costale est menée par une voie axillaire ou thoracique trans-pleurale.
Pour les formes veineuses
La résection costale pourrait être menée par voie antérieure sous-claviculaire, de préférence pour certains à une voie axillaire, en raison du risque nerveux iatrogène moindre, surtout chez le sujet obèse ou musclé.
Cette voie serait particulièrement utile en cas de récidive veineuse après résection costale axillaire.
Il est possible d’utiliser une voie combinée sus- et sous-claviculaire.
Scalénectomie ou résection de la première côte
La voie d’abord supra-claviculaire est plus facile à réaliser que la voie axillaire, surtout pour un opérateur débutant.
L’exposition des racines nerveuses, de l’artère sous-clavière et d’une éventuelle côte cervicale est meilleure que par voie axillaire.
En revanche, la résection de la partie antérieure de la première côte est plus difficile[19].
La voie sus-claviculaire doit donc être évitée dans les cas où la symptomatologie veineuse est prédominante.
Les traumatismes du nerf phrénique, les plaies veineuses et celles du canal thoracique sont plus fréquents par une voie sus-claviculaire que par voie axillaire.
Problèmes diagnostique et technique de résection de la première côte par voie axillaire
Cette voie[20] d'abord permet un certain nombre de gestes associés, mais il faut souligner la relative difficulté de l’intervention pour un chirurgien peu habitué à cette voie.
Cette difficulté est majorée chez le sujet obèse ou musclé, ainsi qu’en présence d’une néo-arthrose entre les première et deuxième côtes ou entre une côte cervicale longue et la première côte.
Il est difficile, sinon impossible, de réaliser un geste vasculaire élaboré par cette voie.
Évolution et complications
Complications de la chirurgie
Le traitement chirurgical du STTB expose à des complications rares mais graves qui ont été observées parfois entre des mains très expérimentées[21] :
- thrombose artérielle ou veineuse ;
- paralysie :
- du plexus brachial,
- du nerf phrénique ou
- du nerf grand dentelé,
- hémothorax ;
- chylothorax…
L’opération ne doit être entreprise qu’avec un diagnostic certain et quand la kinésithérapie est inefficace ou inappropriée.
Aucun geste ne doit être effectué sans le contrôle de la vue.
Chez les sujets très musclés, la voie axillaire serait volontiers dangereuse, selon certains opérateurs (orthopédistes plus que généralistes ou vasculaires).
En cas de thrombose artérielle, l’emploi d’une prothèse est déconseillé dans cette région très mobile.
Récidives ou rechutes post-opératoires dans les formes dites "nerveuses"
La fréquence des récidives serait de l’ordre de 10 % des cas[22]. Leur délai d’apparition varie de quelques semaines à plusieurs années après l’intervention.
L’excision complète de la première côte ou de la côte cervicale diminuerait l’incidence de ces récidives.
La ténotomie du muscle petit pectoral devrait faire partie du geste de décompression totale du STTB.
Le bloc du muscle scalène antérieur permettrait de mieux sélectionner les malades à réopérer.
Prévention
Formes veineuses compliquées et indication opératoire préventive controlatérale
L’intérêt d’une indication opératoire préventive controlatérale même en présence de signes de compression veineuse modérés n’est pas prouvé.
Prévention des récidives post-opératoires
La prévention de ces récidives consiste[23]
- à faire une résection extrapériostée de la première côte tout en laissant un moignon costal aussi court que possible,
- à réséquer toutes les formations musculoaponévrotiques anormales,
- à faire une hémostase parfaite et
- à laver soigneusement la plaie avant la fermeture.
La limitation des mouvements de l’épaule et du bras pendant trois mois après l’intervention n’est plus recommandée par de nombreux auteurs et n’a fait l’objet d’aucune évaluation.
Notes et références
- Becker F., « Syndromes de la traversée thoraco-brachiale [Thoracic outlet syndrome] », Rev Med Suisse., vol. 1, no 4, , p. 306, 308-11. (PMID 15771361, lire en ligne, consulté le )
- « Syndrome du défilé thoracobrachial (Descripteur MeSH) », sur http://www.hetop.eu/ (consulté le )
- (en) Sanders RJ, Monsour JW, Gerber WF, Adams WR, Thompson N., « Scalenectomy versus first rib resection for treatment of the thoracic outlet syndrome », Surgery, vol. 85, no 1, , p. 109-21. (PMID 758710)
- (en) Dale WA., « Thoracic outlet compression syndrome. Critique in 1982. », Arch Surg., vol. 117, no 11, , p. 1437-45. (PMID 7138303)
- (en) Durham J.R., Yao J.S., Pearce W.H., Nuber G.M., Mc Carthy W.J. « Arterial injuries in the thoracic outlet syndrome » J Vasc Surg. 1995;21:57-69.
- (en) Juvonen T, Satta J, Laitala P, Luukkonen K, Nissinen J. « Anomalies at the thoracic outlet are frequent in the general population » Am J Surg. 1995;170:33-37.
- Dumeige F, Flageat J, Bauchu JY, Schoenenberger P, Paris E, Rignault D. « Les anomalies osseuses congénitales de la traversée thoraco-brachiale » In : E. Kieffer ed. Les syndromes de la traversée thoraco-brachiale, A.E.R.C.V. Paris : 1989, p. 81-91.
- Fieve G. « Les syndromes post-traumatiques de la traversée thoraco-brachiale » In E. Kieffer ed. Les syndromes de la traversée thoraco-brachiale, A.E.R.C.V. Paris : 1989, p. 103-112.
- (en) Aburahma AF, White JF. « Thoracic outlet syndrome with arm ischemia as a complication of cervical rib » W V Med J. 1995;91:92-4.
- (en) Charon JP, Milne W, Sheppard DG, Houston JG. « Evaluation of MR angiographic technique in the assessment of thoracic outlet syndrome » Clin Radiol. 2004 ; 59 : 588-595.
- (en) Ersoy H, Steigner ML, Coyner KB. et al. « Vascular thoracic outlet syndrome: protocol design and diagnostic value of contrast-enhanced 3D MR angiography and equilibrium phase imaging on 1.5- and 3-T MRI scanners » Am J Roentgenol. 2012;198:1180-7.
- (en) Chengelis D.L., Glover J.L., Bendick P., Ellwood R., Kirsch M., Fornatoro D. -The use of intravascular ultrasound in the management of thoracic outlet syndrome. Am Surg 1994 ; 60 : 592-596.
- Komanetsky R.M., Novak C.B., McKinnon S.E., Russo M.H., Padberg A.M., Louis S. Somatosensory evoked potentials fails to diagnose thoracic outlet syndrome. J Hand Surg (Am.) 1996 ; 21 : 662-666.
- Sheldon E.J., Herbert I.M. Diagnostic des syndromes de la traversée thoraco-brachiale par infiltration du muscle scalène antérieur sous contrôle électrophysiologique. Ann Chir Vasc1998 ; 3 : 260-264.
- Hempel G.K., Shultze W.P., Anderson J.F., Bukhari H.I. Résection de la première côte par voie sus-claviculaire pour syndrome de la traversée thoraco-brachiale : 770 cas consécutifs. Ann. J. Vasc. 1996 ; 10 : 456-463.
- Patra P., Ledoyer G., Pistorius M.A. Chirurgie des syndromes de compression du défilé thoracobrachial. EMC Elsevier Masson 2012.
- Aligne C., Barral X. La rééducation des syndromes de la traversée thoraco-brachiale. Ann Chir Vasc 1992 ; 6 : 381-389.
- (en) Azakie A., McElhinney D.B., Thompson R.W., Raven R.B., Messina L. M., Stoney R.J. Surgical management of subclavian-vein effort thrombosis as a result of thoracic outlet compression. J Vasc Surg 1998 ; 5 : 775-786.
- Sanders R.J., Monsour J.W., Gerber W.F. Scalenectomy versus first rib resection for treatment of thoracic outlet syndrome. Surgery 1979;85:109-20.
- Thompson R.W., Petrinec D. Traitement chirurgical des syndromes de la traversée thoraco-brachiale : problèmes diagnostique et technique de résection de la première côte par voie axillaire. Ann Chir Vasc 1997 ; 11 : 315-323.
- (en) Melliere D, Becquemin JP, Etienne E, Le Cheviller B. « Severe injuries resulting from operations for thoracic outlet syndrome: can they be avoided? » J Cardiovasc Surg. (Torino) 1991;32:599-603.
- (en) Ambrad-Chalela E, Thomas GI, Johansen KH. « Reccurrent neurogenic thoracic outlet syndrome ». Am J Surg. 2004;187:505-510.
- (en) Mingoli A, Feldhaus RJ, Farina C. et al. « Long-term outcome after transaxillary approach for thoracic outlet syndrome » Surgery 1995;118:840-844.