Tétrafluoroborate de ferrocénium
Le tétrafluoroborate de ferrocénium est un composé organométallique de formule chimique [Fe(C5H5)2]BF4. Il s'agit d'un sel paramagnétique de couleur bleu marine constitué du cation ferrocénium [Fe(C5H5)2]+ et de l'anion tétrafluoroborate BF4−. Ses propriétés sont semblables à celles de l'hexafluorophosphate de ferrocénium [Fe(C5H5)2]PF6, réactif apparenté couramment utilisé. Le cation est souvent abrégé Fc+ ou Cp2Fe+.
| Tétrafluoroborate de ferrocénium | |||
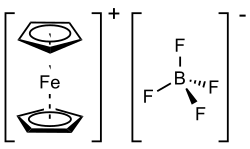
| |||
| Structure du tétrafluoroborate de ferrocénium | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.156.161 | ||
| No CE | 627-836-4 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C10H10BF4Fe |
||
| Masse molaire[1] | 272,836 ± 0,018 g/mol C 44,02 %, H 3,69 %, B 3,96 %, F 27,85 %, Fe 20,47 %, |
||
| Propriétés physiques | |||
| T° fusion | 178 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Les sels de ferrocénium sont des oxydants à un électron tandis que le ferrocène, qui correspond au ferrocénium réduit, est relativement inerte et facilement séparé des produits ioniques. Le couple ferrocène/ferrocénium est souvent utilisé comme référence en électrochimie. Son potentiel d'oxydoréduction est de 0,400 V par rapport à l'électrode standard à hydrogène[3] et est généralement considéré comme invariant entre différents solvants.
Le tétrafluoroborate de ferrocénium peut être acheté dans le commerce. Il peut également être préparé en oxydant du ferrocène à l'aide de sels ferriques puis en ajoutant de l'acide tétrafluoroborique[4] HBF4. On peut également utiliser une grande variété d'autres oxydants, comme le tétrafluoroborate de nitrosyle[5] (NO)BF4. On connaît de nombreux sels de ferrocénium analogues[6].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Ferrocenium tetrafluoroborate technical grade, consultée le 21 juin 2018.
- (en) Allen J. Bard, Roger Parsons et Joseph Jordan, Standard Potentials in Aqueous Solution, CRC Press, 27 août 1985. (ISBN 9780824772918)
- (en) Neil G. Connelly et William E. Geiger, « Chemical Redox Agents for Organometallic Chemistry », Chemical Reviews, vol. 96, no 2, , p. 877-910 (PMID 11848774, DOI 10.1021/cr940053x, lire en ligne)
- (en) Roger M. Nielson, George E. McManis, Lance K. Safford et Michael J. Weaver, « Solvent and electrolyte effects on the kinetics of ferrocenium-ferrocene self-exchange. A reevaluation », The Journal of Physical Chemistry, vol. 93, no 5, , p. 2152-2157 (DOI 10.1021/j100342a086, lire en ligne)
- (en) Jean Le Bras, Haijun Jiao, Wayne E. Meyer, Frank Hampel et J. A. Gladysz, « Synthesis, crystal structure, and reactions of the 17-valence-electron rhenium methyl complex [(η5-C5Me5)Re(NO)(P(4-C6H4CH3)3)(CH3)]+ B(3,5-C6H3(CF3)2)4−: experimental and computational bonding comparisons with 18-electron methyl and methylidene complexes », Journal of Organometallic Chemistry, vol. 616, nos 1-2, , p. 54-66 (DOI 10.1016/S0022-328X(00)00531-3, lire en ligne)
- Portail de la chimie
