Tétrahydrofurane
Le tétrahydrofurane (anciennement tétrahydrofuranne) ou 1,4-époxybutane ou oxolane ou oxacyclopentane ou encore oxyde de tétraméthylène, appelé souvent plus simplement THF, est un composé organique hétérocyclique. C'est un des éthers les plus polaires et il est utilisé en synthèse organique comme solvant et comme précurseur pour la synthèse de polymères.
Cet article concerne la molécule de tétrahydrofurane. Pour la famille des dérivés du tétrahydrofurane, voir oxolane.
| Tétrahydrofurane | |||
| |||
 | |||
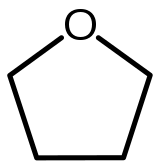
| Structure chimique du tétrahydrofurane. | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Oxacyclopentane | ||
| Synonymes |
Oxolane, tétrahydrofurane |
||
| No CAS | |||
| No ECHA | 100.003.389 | ||
| No CE | 203-726-8 | ||
| PubChem | 8028 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C4H8O [Isomères] |
||
| Masse molaire[2] | 72,105 7 ± 0,004 1 g/mol C 66,63 %, H 11,18 %, O 22,19 %, |
||
| Moment dipolaire | 1,75 ± 0,04 D[3] | ||
| Diamètre moléculaire | 0,504 nm[4] | ||
| Propriétés physiques | |||
| T° fusion | −108,5 °C[1] | ||
| T° ébullition | 66 °C[1] | ||
| Solubilité | dans l'eau : miscible[1] | ||
| Paramètre de solubilité δ | 18,6 MPa1/2 (25 °C)[5] | ||
| Masse volumique | 0,89 g cm−3[1] | ||
| T° d'auto-inflammation | 321 °C[1] | ||
| Point d’éclair | −14,5 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 2–11,8 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 19,3 kPa[1] | ||
| Viscosité dynamique | 0,48 cP à 25 °C[réf. souhaitée] | ||
| Point critique | 51,9 bar, 266,95 °C[6] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,38 ± 0,05 eV (gaz)[8] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,4050[4] | ||
| Précautions | |||
| SGH[9] | |||
   Danger |
|||
| SIMDUT[10] | |||
  B2, D2B, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 1 650 mg/kg (rat, voie orale) 2 300 mg/kg (souris, voie orale)[réf. souhaitée] |
||
| Seuil de l’odorat | bas : 0,09 ppm haut : 61 ppm[11] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il a une température d'ébullition plus grande que la plupart des éthers (Téb = 66 °C). Il est narcotique et toxique (VME de 150 mg/m3).
Synthèse
Environ 200 000 tonnes de THF sont produites chaque année dans le monde[12]. Le procédé le plus utilisé est la déshydratation du butane-1,4-diol par catalyse acide.
Dupont a développé un procédé basé sur l'oxydation du butane en anhydride maléique suivi d'une hydrogénation[13].
Il est difficile de le conserver sec car il est relativement miscible à l'eau.
Purification : élimination des peroxydes dangereux
En outre, il a tendance à former des peroxydes lors du stockage (comme tous les éthers) : il convient donc de tester la présence de peroxydes et le cas échéant de les éliminer avant tout usage car ce sont des composés particulièrement explosifs. Pour cela, on prélève un petit volume de THF à tester et on l'agite avec une solution acidifiée d'iodure de potassium à 10 % : si le test est positif (coloration jaune), il faut alors détruire les peroxydes en agitant la totalité du THF avec 1/5 de son volume d'une solution de disulfite de sodium à 5 %. On refait le test et l'on recommence si nécessaire le lavage au disulfite de sodium jusqu'à ce que le test soit négatif.
Cette précaution est indispensable avant tout usage du THF et en particulier avant la distillation, opération qui est souvent pratiquée à des fins de purification juste avant l'emploi d'un solvant : en effet, à la fin de la distillation, les résidus seront constitués presque exclusivement de ces peroxydes, lesquels vont s'échauffer et exploser. Une méthode pour éviter ce phénomène est de distiller le THF sous atmosphère inerte (azote ou argon) et sur sodium et benzophénone ((C6H5)2CO). Celle-ci forme avec le sodium un radical qui réagit avec les peroxydes de THF, l'eau et l'oxygène présents dans le THF et les élimine, produisant ainsi par distillation un THF pur, sec et désoxygéné. De plus, le radical ((C6H5)2C∙–O−) possède une couleur violet profond qui, quand elle est observée, garantit que tous les peroxydes, eau et O2 ont été éliminés.
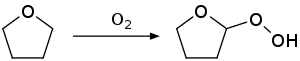
Utilisations
Le tétrahydrofurane est utilisé, entre autres, comme solvant ou comme monomère. En tant que monomère, il peut lui-même polymériser et former le polyéther polytétraméthylène glycol.
Notes et références
- TETRAHYDROFURANNE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- ECHA, (28 janvier 2021).
- « Tétrahydrofurane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Tetrahydrofuran », sur hazmap.nlm.nih.gov (consulté le )
- (en) Karas, Lawrence et Piel, W. J., « Ethers », Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, .
- Budavari, Susan, éd., The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, Merck, , 13e éd. (ISBN 0911910131).
Liens externes
- Portail de la chimie
