Tétraméthylammonium
Le cation tétraméthylammonium est une espèce chimique de formule (CH3)4N+. Il s'agit de l'ammonium quaternaire le plus simple, constitué de quatre groupes méthyle –CH3 liés à un atome d'azote central chargé positivement. Il nécessite la présence d'un contre-ion, formant le plus souvent un sel simple tel que les chlorure, bromure, iodure ou encore hydroxyde de tétraméthylammonium.
| Tétraméthylammonium | |
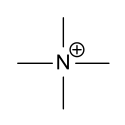  Structure du cation tétraméthylammonium |
|
| Identification | |
|---|---|
| Nom UICPA | tetraméthylazanium |
| No CAS | |
| No CE | 235-626-5 |
| PubChem | 6380 |
| ChEBI | 46020 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H12N+ |
| Masse molaire[1] | 74,144 8 ± 0,004 2 g/mol C 64,8 %, H 16,31 %, N 18,89 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Les sels de tétraméthylammonium sont utilisés en synthèse chimique et sont très employés en recherche pharmaceutique ; les dérivés du tétraméthylammonium ont couramment un effet mimétique de l'acétylcholine CH3COOCH2CH2N+(CH3)3.
Ils sont également présents dans des composés naturels toxiques, qu'on appelle souvent tétramines, bien que les contre-ions puissent être difficiles à identifier ; la nature de l'anion associé a généralement peu d'importance par rapport à une réaction ou une action biologique particulière, mais ce n'est pas toujours le cas.
De manière générale, le cation tétraméthylammonium est utilisé en solution aqueuse, en proportions massiques variables pouvant aller de 2 à 40%, les solutions les plus utilisées ne dépassant généralement pas 20~25%. Dans l'eau, on forme souvent de l'hydroxyde de tétraméthylammonium mais on peut également combiner ce cation aux anions bromure et iodure ; en outre, il arrive d'utiliser le méthanol comme solvant dans des cas plus rares.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Portail de la chimie