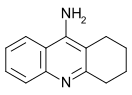
Tacrine
La tacrine (ou tétrahydroaminacrine) est une substance médicamenteuse utilisée dans le traitement palliatif de la maladie d'Alzheimer[2].
| Tacrine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,2,3,4-tétrahydroacridin-9-amine | |
| Synonymes |
tétrahydroaminacrine |
|
| No CAS | ||
| No ECHA | 100.005.721 | |
| No CE | 206-291-2 | |
| Code ATC | N06 N06 | |
| DrugBank | APRD00690 | |
| PubChem | 1935 | |
| SMILES | ||
| InChI | ||
| Apparence | Solide | |
| Propriétés chimiques | ||
| Formule | C13H14N2 [Isomères] |
|
| Masse molaire[1] | 198,263 7 ± 0,011 8 g/mol C 78,75 %, H 7,12 %, N 14,13 %, |
|
| Propriétés physiques | ||
| T° fusion | 183,5 °C[réf. souhaitée] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Mais elle peut être également employée dans le dopage sportif.
La tacrine est un principe actif seulement utilisé dans le médicament Cognex sous sa forme de chlorhydrate de tacrine, ou chlorhydrate de 1,2,3,4-tétrahydro-9-acridinamine.
À température ambiante, le chlorhydrate de tacrine prend la forme d'une poudre blanche, de saveur amère. Il est soluble dans l'eau distillée, l'acide chlorhydrique 0,1 M, le tampon acétate (pH 4), le tampon phosphate (pH 7,0-7,4), le méthanol, le diméthylsulfoxyde, l'éthanol et le propylène glycol.
Historique
Dans les années 1940, en Australie, la tacrine fut utilisée pour limiter les dépressions respiratoires entraînées par la morphine sans modifier ses effets analgésiques. En 1945, la molécule de tacrine est synthétisée pour la première fois par Albert et Gledhill. En 1953, Shaw et Bentley découvrent que la molécule a des propriétés anticholinestérasiques. Ce sont ces propriétés de la tacrine qui seront à l'origine d'essais cliniques chez des patients atteints de la maladie d'Alzheimer quelques années plus tard. Ces essais seront controversés.
Le médicament contenant la tacrine est utilisé pour la première fois dans les années 1960 comme anesthésiant, puis dans les années 1980 pour des essais cliniques. Il est distribué depuis 1993 aux États-Unis et depuis 1994 en France.
C'est à cause de son hépatotoxicité que le médicament Cognex, à base de tacrine, est retiré de la vente le . Il est remplacé par le donezepil (Aricept), la galantamine (Reminyl) et la rivastigmine (Exelon) qui n’ont pas montré de toxicité hépatique.
Avant la commercialisation du Cognex, la tacrine a été sujet à controverse. En , William Koopmans Summers (en) (psychiatre californien) a publié un article (expliquant un essai clinique sur la tacrine et ses effets bénéfiques sur 17 patients atteints de la maladie d’Alzheimer) dans le New England Journal of Medicine. Celui-ci est accompagné d’un éditorial signé par Kenneth L. Davis (en), sommité mondiale de la maladie d’Alzheimer.
Dans les jours suivants, W.K. Summers reçoit des milliers d’appels de médias, de scientifiques, car il n’a pas encore obtenu l’aval de la Food and Drug Administration (FDA).
Dans les semaines qui suivent, il reçoit la visite d’un inspecteur de la FDA, pour l’avertir de l’examen de ses dossiers.
Pendant plusieurs années, il y a une bataille entre le psychiatre et la FDA, avec l’intervention de hauts fonctionnaires du gouvernement, industriels, personnes de la haute société et médias. La FDA dénonce W.K. Summers pour ne pas avoir été rigoureux dans son essai clinique et ne pas avoir respecté la confidentialité et la proportionnalité des patients placebo avec les patients réellement traités.
Trois mois après la publication, il y a une réunion de scientifiques, des représentants de l’industrie pharmaceutique et des autorités de contrôle du médicament à Bethesda (Maryland) pour mettre au point un nouvel essai clinique dans plusieurs établissements, en attendant la validation ou non de la FDA.
C’est cette attente qui conduit à plusieurs événements dans les années qui suivent :
- des personnes âgées malades faisant une veille sur la pelouse de la FDA, encerclées par des policiers ;
- des personnes campent nuit et jour devant la porte de W.K. Summers pour avoir le traitement ;
- des associations de patients intentent des procès à la FDA ;
- la FDA fait un procès au fabricant de la tacrine ;
- WK Summers menace de se suicider devant le bâtiment de la FDA.
Il faut également savoir que pendant que la FDA et WK Summers se livraient bataille, la tacrine ne pouvait pas être commercialisée mais les patients arrivaient à se procurer le traitement, avant même que le processus réglementaire ne soit fini, en passant par le « club d’acheteurs » localisé notamment au Canada, au Costa Rica et aux Bahamas. En , avant même la publication de l’article, WK Summers avait créé une société à but lucratif, la « Solo Research Inc. », dont la brochure offrait l’accès au traitement pour 12 000 dollars par an. WK Summers affirme l’avoir créée pour financer ses recherches et par la suite l’avoir transformée en fondation à but non lucratif. En 1992, la FDA n’a toujours pas autorisé le lancement de la tacrine et demande à WK Summers d’écrire une lettre de rétractation, ce qu’il refuse et donne une lettre de « clarification » qui ne sera jamais publiée. En 1992, la FDA n’a toujours pas autorisé le lancement de la tacrine, ce qui entraine une nouvelle manifestation des familles de malades devant l’immeuble de la FDA le . À la mi-1993, les divers essais sur une dizaine de milliers de patients montrent que le médicament est relativement efficace et sans danger sérieux. C’est en que la FDA donne son feu vert pour le laboratoire Parke-Davis. Jusqu’au mois de , la tacrine est le seul médicament contre la maladie d’Alzheimer. Après celui-ci, une molécule concurrente est autorisée aux États-Unis.
Forme et présentation du médicament
Le médicament à base de tacrine se présente sous forme de gélules dosées différemment : 10 mg, 20 mg, 30 mg ou 40 mg. Ce sont des gélules sécurisées, de type C et de taille 7,33/7,64 mm. Elles sont produites par le laboratoire Parke-Davis, et suivent un code couleur en fonction du dosage :
- pour 10 mg, les gélules sont vert foncé et chair ;
- pour 20 mg, les gélules sont bleues et chair ;
- pour 30 mg, les gélules sont orange et chair ;
- pour 40 mg, les gélules sont violettes et chair.
Pharmacocinétique
La demi-absorption est de 10 à 37 minutes, qui est due au principe actif lipophile.
La biodisponibilité est réduite de 30 à 40 % en cas de prise concomitante avec des aliments, non modifiée pour une prise une heure avant le repas ou la prise d'antiacides.
La concentration plasmatique est au maximum pour 1,5 heure. L'augmentation de la posologie se fait par palier.
Les gélules ne peuvent être prescrites que par un neurologue, un psychiatre, un médecin polyvalent gériatre, ou un médecin exerçant en gériatrie répondant aux conditions fixées par l'article L.356 du code de la santé publique (CSP)[3]. La première prescription nécessite une fiche d'initiation de traitement en plus d'une ordonnance de prescription de tacrine et de dosage des ALAT. La délivrance de la tacrine se fait par période de deux semaines pendant les 3 mois de traitement puis mensuellement.
Usages
- Maladie d'Alzheimer.
- Retour à la normale à la suite d'une dépression respiratoire due à l'administration de morphine pour des fins analgésiques.
- Retour à la normale à la suite d'une sédation postopératoire.
- Prolongement du relâchement musculaire médié par la succinilcholine.
- Antagonisation de la tubocurarine.
- Antagonisation de la surdose de barbiturique (pays scandinaves).
- Retour à la normale à la suite du « delirium » provoqué par des agents anticholinergiques.
- En addition de la morphine pour le traitement des stades de douleurs chroniques intraitables.
- Traitement de la dyskinésie tardive.
- Traitement de la sclérose latérale amniotrophique.
- Sida.
Essais cliniques
| Étude | Année | Pays | Nombre de patients | Doses de THA | Durée |
|---|---|---|---|---|---|
| Summers | 1986 | États-Unis | 12 | Dose unique | 4 mois |
| Chatellier | 1990 | France | 67 | T125 + L400
T125 + L400 THA ou non |
4 semaines
4 semaines 4 mois |
| Gauthier | 1990 | France | 52 | TM400 + L775
arrêt traitement T ou P (+L) arrêt |
10 semaines
4 semaines 8 semaines 4 semaines |
| Eagger | 1991 | Angleterre | 89 | Groupe A :
T + L arrêt PT + PL Groupe B : inverse TM150 + L10800 |
13 semaines
4 semaines 13 semaines |
| Davis | 1992 | États-Unis | 632 | P – T40 – T80
T40 – P – T80 T40 – T80 – P P P ou T40 ou T80 T (dose optimale) |
6 semaines 2 semaines 6 semaines 6 semaines |
| Farlow | 1992 | États-Unis | 468 | 1. b=P
d=T20 f=T40 2. b=P ou T20 d=T20 pi T40 f=T40 ou T80 groupe a, c, e= même posologie pendant 2 semaines |
6 semaines 6 semaines |
| Knapp | 1994 | États-Unis | 663 | a=P
b, c, d=T40 a=P b, c, d=T80 a=P b=T80 c, d=T120 a=P b=T80 c=T120 d=T160 |
6 semaines
6 semaines 6 semaines 12 semaines |
| Solomon | 1996 | États-Unis | 12 patients de l’étude Knapp | T120 ou T160 | 21 mois |
| Marseille | 1995 | France | 144 | T40 ou T80 ou T120 ou T160 | 6 mois minimum |
| Grenoble | 1996 | France | 66 | T80 ou T120 ou T160 | 12 mois |
Légende :
Mécanisme d'action
Le mécanisme d'action de la tacrine reste méconnu.
Sur le système cholinergique
- Inhibe de façon réversible et non compétitive les cholinestérases.
- Se fixe en tant qu'agoniste aux récepteurs muscariniques.
- Présente une faible affinité avec les récepteurs nicotiniques.
- Inhibe de la capture des molécules d'acétylcholine.
- Diminue la libération d'acétylcholine.
Sur les systèmes de neurotransmission
- Diminue l'effet de l'acide glutamique.
- Bloque l'entrée du calcium.
- Inhibe partiellement les monoamines endogènes.
- Diminue la lyse des neurones.
Sur les canaux sodopotassiques
La tacrine bloque les canaux sodium et potassium.
Action
Il a été démontré que les patients atteints de la maladie d'Alzheimer présentent un déficit cholinergique. C'est-à-dire, que l'activité de l'acétylase et de l'acétylcholinestérase est réduit. Or l'acétylcholinestérase est une enzyme qui assure la synthèse d'acétylcholine à partir de choline et d'acétyl Co-A, dans les terminaisons axonales. Il y a donc un déficit en neurotransmetteurs. La tacrine est un inhibiteur réversible et non compétitif des cholinestérases. En empêchant l'action de l'acétylcholinestérase qui se fixe sur les récepteurs muscariniques, la tacrine permet à l'acétylcholine de rester plus longtemps dans la terminaison axonale et ainsi d'agir sur les sites postsynaptiques. La stimulation postsynaptique entraîne un rétablissement de la conduction nerveuse améliorant ainsi les capacités cognitives du patient. Cependant la stimulation présynaptique entraîne une libération d'acétylcholine moins importante mais puisque la tacrine agit en coopération avec l'acétylcholine (fixation sur un site allostérique des récepteurs), cela diminue les pertes en acétylcholine et offre un meilleur résultat en présence de tacrine.
Le calcium joue également un rôle dans la dégénérescence et la mort neuronale. Or la tacrine inhibe la partie ionophore du récepteur NMDA (acide N-méthyl-D-aspartique) qui correspond à l'échangeur Na+/Ca2+. Le récepteur de la phéncyclidine (PCP) est également antagonisé par la tacrine. Ces conditions entraînent une diminution de la concentration en calcium libre dans les neurones, ce qui retarde la mort neuronale.
Distribution
À la suite de l'administration et de l'absorption la tacrine passe rapidement la barrière hémato-encéphalique pour se diffuser principalement dans le cortex cérébral, le système limbique, le thalamus et le striatum.
Métabolisme
Métabolisme hépatique intense impliquant la voie du cytochrome P-450 (ou isoenzyme P-450 1A2). Ce sont majoritairement des hydroxylations. La tacrine forme principalement un métabolite du nom de 1-hydroxytacrine ou velnacrine, qui est présent à environ 5,5 % dans la dose administrée. Elle forme également la 2-hydroxytacrine en quantité quantifiable dans la dose, et la 4-hydroxytacrine en plus faible quantité.
Effets sur l'organisme
Effets thérapeutiques
La tacrine est indiquée dans le traitement de la maladie d'Alzheimer des formes légères à modérées. Les résultats sont évalués selon trois critères : la sous échelle cognitive de l'échelle d'évaluation de la maladie d'Alzheimer (ADAs-Cog), l'impression clinique globale de changement évaluée par clinicien (CIBI) et l'échelle qualité de vie appréciant les activités du patient.
Contre-indications
- Grossesse et allaitement
- Maladies hépatiques évolutives et séquelles de maladies hépatiques
- Ulcères gastroduodénaux évolutifs non traités
- Hypersensibilité aux substances cholinomimétiques et composés chimiques apparentés à l’acridine
- Ictère avec une bilirubinémie supérieure à 30 mg/l (51 µmol/l) lors d’un premier traitement à la tacrine
- Augmentation de la transaminasémie supérieure à 3M persistante après réduction posologique de la tacrine ou après arrêt de traitement et tentative de réintroduction du produit
- Antécédents d'épilepsie
- Antécédents d'ulcères gastro-intestinaux
- Antécédents d'hépatites virales ou médicamenteuses
- Antécédents d'asthme
- Pathologie du péristaltisme intestinal
- Dysfonctionnement sphinctérien
- Risque d'aggraver les troubles du rythme cardiaque par effets vagotoniques
Non indiqué
- Formes débutantes, ni dans les formes graves de la MA
- Autres démences
- Troubles bénins de la mémoire
- Troubles neuropsychologique du sida
Interactions médicamenteuses
Il est nécessaire d'être vigilant aux interactions que pourrait avoir la tacrine avec d'autres médicaments, d'autres traitements en cours :
- la théophylline est un bronchodilatateur. Associée à la tacrine, elle entraîne une augmentation des effets indésirables comme nausées, vomissements et tachycardie ;
- la cimétidine est un anti-ulcéreux qui diminue la sécrétion gastrique. Un de ses effets indésirables consiste en des troubles gastro-intestinaux, tout comme la tacrine. Si ces médicaments sont pris ensemble, ces effets s'ajoutent (nausées, diarrhée, vomissement) ;
- le bétanéchol est un agoniste cholinergique. L'utilisation de ce médicament et de la tacrine est à éviter car elle peut entraîner une addition des effets indésirables.
Il est nécessaire de réévaluer, voire de supprimer les doses à administrer dans le cas où ces médicaments sont pris en même temps que la tacrine.
Effets secondaires et indésirables
La tacrine est mutagène et hépatotoxique. Il est donc nécessaire de surveiller la survenue d'atteintes hépatiques chez un individu suivant ce traitement. Ces effets hépatocytaires dépendent de la susceptibilité individuelle des patients, la dose administrée et le temps de traitement. L'hépatotoxicité consiste en la destructions des cellules du foie et se caractérise par une augmentation des transaminases.
Chez plus de 50 % des patients, il a été constaté des effets indésirables : l'élévation des transaminases sériques chez 40 % à 50 % des patients, des vertiges, dyspepsies, douleurs abdominales, diarrhées, nausées, vomissements, anorexie, myalgie dans 10 % à 15 % des cas, et dans moins de 10 % des cas de l'asthénie, de l'ataxie, des troubles du sommeil, des manifestations cutanées, des céphalées, des douleurs thoraciques, des confusions, des agitations et des dépressions.
Surdosage
En cas de surdosage, les effets indésirables et secondaires sont amplifiés. Il peut se produire une exagération des nausées, des vomissements, des diarrhées, des sécrétions (larmes, salive, sueur), l'apparition d'une faiblesse musculaire croissante pouvant aller jusqu'à la paralysie des muscles, mortelle par atteinte respiratoire. Les anticholinergiques atropiniques sont des antidotes en cas de surdosage. La dose initiale d'atropine recommandée est de 0,4 à 1 mg, à renouveler si nécessaire. Cette prise se fait par intraveineuse.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Smith F, Talwalker S, Gracon S et Srirama M, « The use of survival analysis techniques in evaluating the effect of long-term tacrine (Cognex) treatment on nursing home placement and mortality in patients with Alzheimer’s disease », J. Biopharm. Stat., 1996, 6:395-409.
- Article L.356, sur legifrance.gouv.fr.
Voir aussi
Bibliographie
- John Maurice, « La saga de la Tacrine », La Recherche, no 303
- Florence Paillard, « La bataille pharmaceutique » La Recherche, no 303
- (en) Bagne, C.A. ; Pomara, N. ; Crook, T. et Gershon, S., Alzheimer's disease: Strategies for treatment and Research. Dans Treatment Development Strategies for Alzheimer's disease, édité par Crook, T. ; Bartus R. ; Ferris S. et Gershon S., chap. 26, p. 585-638, 1986
- R.T. Bartus, R.L. Dean, S.K. Fisher, Cholinergic Treatment for Âge-related Memory Disturbancies: Dead or Barely coming of Âge ?. Dans Treatment Development Strategies for Alzheimer's disease, chapitre 17, 1986, p. 421–450
- K. Bouras, Atteinte hépatique et iatrogénique des médicaments à visée neurologique : exemple de trois familles médicamenteuses, thèse de doctorat en pharmacie, Faculté de pharmacie, université Henri-Poincaré - Nancy-I, 1996.
- I. Bourdier, Traitements actuels de la maladie d'Alzheimer, thèse de doctorat en pharmacie, Faculté de pharmacie, université Paris-XI, 1993.
- G. Chatellier, L. Lacomblez et coll., Tacrine (tetrahydroaminoacridine;THA) and Lecithin in Senile Dementia of the Alzheimer Type: a Multicentre Trial, Br. Med. J., no 300, 1990, p. 495–499.
- B. Cordell, Beta-Amyloid Formation as a Potential Therapeutoc Target for Alzheimer's Disease, Annual Revue in Pharmacology and Toxicologie, no 34, 1994, p. 69–89
- N.R. Culter, A.J. Sedman et coll., Steady-state pharmacokinetics of tacrine in patients with Alzheimer's disease, dans Psychopharmacology Bulletin, vol. 26, no 2, 1990, p. 231–234
- A. Dhanani, Place de la tacrine (Cognex) dans le traitement de la maladie d'Alzheimer : bilan sur douze mois de prescription et de dispensation au CHU de Grenoble, thèse de doctorat en pharmacie, Faculté de pharmacie, université Grenoble-I, .
- F. Dietsh, Traitement actuel de la maladie d'Alzheimer et perspectives d'avenir, thèse de doctorat en pharmacie, Faculté de pharmacie, université Henri-Poincaré - Nancy-I, .
- S.A. Eagger, R. Levy, B.J. Sahakian, Tacrine in Alzheimer's Disease, The Lancet, vol. 337, no 8748, 1991, p. 989–992.
- S. Erlinger, La tolérance hépatique de la tacrine, La Lettre du Pharmacologue, vol. 8, supplément no 6, , p. 26–28
- M. Farlow, S.I. Gracon et coll., A controlled Trial of Tacrine in Alzheimer's disease, JAMA, vol. 268, no 18, 1992, p. 2523–2529
- M. Farlow, Traitement de la maladie d'Alzheimer : des résultats prometteurs avec la tacrine, JAMA, vol. 18, no 258, 1993, p. 85–88.
- L.J. Fitten, JF. Flood, C.F. Baxter et coll., Long Term Oral Administration of Memory-Enhancing Doses of Tacrine in Mice: A Study of Potential Toxicity and Side Effects, Journal of Gerontology, vol. 42, no 6, 1987, p. 681–685
- F. Forette, L'histoire du développement de la tacrine, La lettre du Pharmacologue, vol. 8, supplément au no 6, .
- D.R. Forsyth, G.K. Wilcock, R.A. Morgan, C.A. Truman, J.M. Ford et C.J.C. Roberts, Pharmacokinetics of tacrine hydrochloride in Alzheimer's disease, Clin. Pharmacol. Ter., no 46, , p. 634–641.
- S. Gauthier, R. Bouchard, A. Lamontagne et coll., Tetrahydroaminoacridine-Lecithin Combination Treatment in Patients with Intermediate-Stage Alzheimer's disease, N. Eng. J. Med. no 322, 1990, p. 1272–1276.
- J.H. Growdon, Treatment for Alzheimer's Disease?, New England Journal of Medecine, , p. 1306–1308.
- P. Hartvig, P. Asmark, S.M. Aqualarius et coll., Clinical pharmacokinetics of intravenous and oral beta-amino-1,2,3,4-tetrahydroacridine, tacrine,
- L. Jullian, La Tacrine : un correcteur des déficits mnésiques, thèse de doctorat en pharmacie, Faculté de pharmacie, université de Marseille, .
- H. Kerdoncuff, Intérêt de la tacrine dans la maladie d'Alzheimer, thèse de doctorat en pharmacie, Faculté de pharmacie, université Rennes-I, .
- M.J. Knapp et coll., A 30-Week Randomized Controlled Trial of High-Dose Tacrine in Patients with Alzheimer's Disease, JAMA, vol.271, no 13, , p. 985–991
- Y. Lamour, M-H. Bassaut, P. Dutar, Pharmacologie expérimentale et clinique de la tacrine, La lettre du pharmacologue, vol. 8, supplément au no 6, , p. 10–14
- C. Machou, La tacrine (Cognex) : premier traitement symptomatique de la maladie d'Alzheimer dans ses formes légères à modérées. Expérience de l'assistance publique de Marseille, thèse de doctorat en pharmacie, Faculté de pharmacie, université Marseille-II, .
- C. Manson, La maladie d'Alzheimer et son traitement à visée cholinergique ; la tacrine, thèse de doctorat en pharmacie, Faculté de pharmacie, université de Caen, 1995.
- Ministère des Affaires sociales, de la Santé et de la Ville, Modalité de prescription de dispensation, de prise en charge et de surveillance du bon usage et des effets indésirables du Cognex (tacrine) du laboratoire Parke-Davis, Circulaire DGS/DH/DSS no 68 de la Direction départementale des affaires sanitaires et sociales, .
- Laboratoire Parke-Davis, Maladie d'Alzheimer : De la recherche fondamentale à la thérapeutique, actualités Innovation Médecine, hors-série, , p. 1–22
- H. Petit, F. Pasquier, Étude critique des essais de la tacrine, La Lettre du Pharmacologue, vol. 8, supplément au no 6, , p. 21–25
- H. Petit, F. Pasquier, Place de la tacrine dans le traitement de la maladie d'Alzheimer, La revue du Praticien, Médecine Générale, t. 8, no 273, , p. 19-22
- F. Riffault, Maladie d'Alzheimer - Aspects clinique et thérapeutique - Place de la tacrine, thèse de doctorat en pharmacie, Faculté de pharmacie, université Clermont-Ferrand-I, .
- M.D. Small, Le traitement de la maladie d'Alzheimer par la tacrine, JAMA, vol. 8, no 258, , p. 75–76
- P.R. Solomon, M.J. Knapp et coll., Oral tetrahydroaminoacidrine in long term treatment of senile dementia of Alzheimer's type, New England Journal of Medecine, vol. 315, 1986, p. 1241–1245
- P.B. Watkins, H.J. Zimmerman et coll., Hepatotoxicity Effects of Tacrine Administration in Patients with Alzheimer's Disease, JAMA, vol. 271, no 13, 1994, p. 992–998.
- Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie