Testicule
Les testicules (testes) sont les gonades mâles des animaux. Ils appartiennent à l'appareil reproducteur masculin, ce sont les homologues des ovaires. Ils ont une double fonction, plus ou moins exprimée selon les périodes de la vie :
- spermatogenèse (production de spermatozoïdes) ;
- stéroïdogenèse (fonction hormonale, active in utero lors de la différenciation sexuelle, puis brièvement dans les premiers mois suivant la naissance, puis à partir de la puberté jusqu'à la fin de la vie).
« Burne » redirige ici. Pour les autres significations, voir Burne (homonymie).
| Type | |
|---|---|
| Vascularisation | |
| Drainage veineux | |
| Drainage lymphatique |
Lumbar lymph nodes (en) |
| Nom latin |
Testis |
|---|---|
| MeSH |
D013737 |
| TA98 |
A09.3.01.001 |
| TA2 |
3576 |
| FMA |
7210 |
La majorité des vertébrés possèdent des testicules jumelés. Chez les oiseaux, les reptiles, les poissons et les amphibies, ils sont internes (testicules intra-abdominaux). Chez les premiers mammifères, ils sont également internes (caractère plésiomorphe), en position intra-abdominale (Afrothériens[1], Insectivores, Siréniens). Puis ils migrent lors de l'embryogenèse (descente des testicules, descensus testiculorum) et deviennent externes, dans une poche qui s'appelle le scrotum, phénomène apparu il y a 147 millions d'années chez les marsupiaux[2]. Chez quelques espèces de mammifères (xénarthres, mammifères marins tels que les cétacés[3]), l'ascension secondaire des gonades explique leurs testicules internes en position intra-abdominale[4].
Anatomie humaine
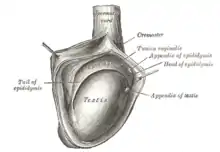
Les testicules de l'homme sont des organes pairs et parfois asymétriques situés à l'extérieur du pelvis dans le scrotum afin d'être à une température inférieure à celle de l'abdomen (2 °C en moins). Chaque testicule adulte mesure environ 3 cm de haut, 2 cm de large et 5 cm de profondeur pour un poids d'environ 20 grammes[5].
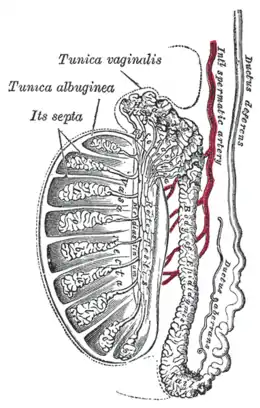
Les testicules comportent une coque lisse et blanc nacré appelée albuginée du testicule (tunica albuinea testis), elle est épaisse, solide et inextensible. Sur ses faces latérale et caudale, le testicule est entouré par une « cavité vaginale testiculaire », reliquat de cœlome interne. Au sommet du testicule on retrouve l'épididyme séparé du testicule par le « sillon épididymaire ». La disparition de ce dernier est le signe d'une pathologie de l'épididyme tel qu'un cancer. À son pôle caudal, le testicule est fixé au scrotum par le gubernaculum testis.
Le gubernaculum testis est constitué de deux faisceaux attachant le pôle distal du testicule, directement à l'albuginée, ainsi que la queue de l'épididyme le plus souvent. Son insertion distale à l'âge adulte est parfois scrotale ou crémastérienne, mais semble involuer. [6]
L'albuginée envoie des cloisons ou « septa » (pluriel de septum qui veut dire cloison) découpant le testicule en environ 300 lobules testiculaires contenant les tubes séminifères (tubuli seminiferi recti). Les tubes séminifères contenus dans l'albuginée sont le siège de la spermatogenèse. Ces tubes sont tapissés d'une couche de cellules nourricières (cellules de Sertoli). Ces tubes débouchent sur l'épididyme (epididymis), où les spermatozoïdes neufs maturent.
Entre les tubes séminifères se trouvent les cellules de Leydig, qui produisent différentes hormones stéroïdes.
Vascularisation
Elle est terminale, effectuée par trois artères.
- L’artère spermatique dérivant directement de l'aorte passe par le cordon spermatique.
- L’artère déférentielle dérivant de l'artère iliaque interne passe aussi par le cordon spermatique.
- L'artère crémastérienne inférieure dérivant de l'artère épigastrique inférieure, ne passant pas par le cordon spermatique.
En cas d'ectopie testiculaire, l’intervention consiste en l’abaissement testiculaire après section des vaisseaux spermatiques (Fowler-Stephens). L’existence d’une circulation collatérale entre les vaisseaux spermatiques, déférentiels et crémastériens autorise, après un clampage préalable, une ligature des vaisseaux spermatiques. Les collatérales doivent être préservées pour assurer la vascularisation du testicule.
Anatomie chez les mammifères
Les deux organes mâles se forment dans la cavité abdominale, près des reins. Uniquement pour les Monotrèmes, les testicules gardent cette position. Pour l'ensemble des autres Mammifères, ils émigrent durant leur développement et sortent même complètement de l'abdomen. Il existe plusieurs possibilités:
- Pour certains groupes,(Éléphants, Édentés, Cétacés), les testicules descendent un peu plus bas dans la cavité pelvienne.
- Chez d'autres (Primates, Ongulés, Marsupiaux), ils descendent plus bas encore et vont se loger dans une poche qui fait saillie à l'extérieur, au point d'être même parfois pendante, appelée le scrotum. Cette poche ne communique plus avec la cavité abdominale que par un orifice étroit, appelé le canal ou l'anneau inguinal.
- Enfin, chez d'autres (Rongeurs, Insectivores, Chauves-Souris), les testicules restent dans la cavité abdominale en temps ordinaire, mais franchissent l'anneau inguinal et descendent dans le scrotum au moment de l'accouplement, après quoi ils montent reprendre leur position primitive dans la cavité abdominale[7].
Histoire évolutive
Différentes hypothèses ont été proposées pour expliquer l'origine évolutive de la descente et l'externalisation des testicules chez la majorité des mammifères. L'hypothèse du refroidissement (la température des testicules qui permet une spermatogenèse optimale est de 2 à 4 °C inférieure à la température du corps)[8] a été réfutée par Adolf Portmann[9],[10]. L’hypothèse de l’étalage de Portmann (signal sexuel du mâle indiquant clairement son « pôle reproducteur ») est également réfutée[4] mais elle peut expliquer, comme celle du refroidissement, pourquoi ce trait biologique s'est maintenu au cours de l'évolution dans certaines lignées[11]. L'hypothèse de Portmann a été réinterprétée par Short qui considère que la descente testiculaire est un processus évolutif qui permet de maintenir le taux de mutation dans la lignée germinale mâle à un niveau acceptable[12], et par Bedford qui suppose qu'elle refroidit non pas les testicules mais les épididymes[13]. Scott Freeman émet également une hypothèse fragile[réf. souhaitée], celle de l'entraînement selon laquelle la mauvaise circulation sanguine dans le scrotum maintiendrait les testicules dans un environnement insuffisamment oxygéné, ce qui endurcirait les spermatozoïdes[14]. Cette descente pourrait s'expliquer par la théorie du handicap : les testicules placés dans une position aussi vulnérable à l’extérieur du corps (traumatismes, attaques de prédateurs) attireraient les femelles qui sélectionnent les mâles exprimant une plus grande vigueur et aptitude à survivre malgré ce handicap[15]. L'hypothèse du galop de Frey (1991)[4] et de Chance (1996)[16] est basée sur le fait que des pressions intra-abdominales sont néfastes pour la spermatogenèse chez les mammifères qui ont un mode de locomotion terrestre rapide. Les mammifères aux testicules intra-abdomniaux internes (Afrothériens, mammifères marins) ont une locomotion qui ne génère pas ces pressions. Enfin, la descente testiculaire serait un exemple de compromis évolutif entre la vulnérabilité du scrotum et les avantages de leur externalisation. Basée sur l'observation que les testicules externes ont tendance à être plus grands par rapport à la taille du corps, en comparaison avec les testicules internes, l'hypothèse la plus récente relative à la grande diversité des positions testiculaires chez les mammifères postule qu'elle résulterait d'un compromis évolutif entre la production de sperme et le stockage de sperme[17],[18].
Développement
Embryogenèse chez les mammifères
Les testicules se forment de manière précoce :
- les cellules de Sertoli sont les premières cellules à se différencier : elles englobent les cellules germinales, alors appelées gonocytes, pour former les cordons séminifères dès 12 jours de postconception (jpc) chez la souris, 13,5 jpc chez le rat et 42-45 jours chez l’homme ;
- peu après, les cellules de Leydig du fœtus se différencient. Elles sécrètent deux hormones nécessaires à la masculinisation du fœtus : la testostérone et l'INSL3[19].
La future qualité et quantité de spermatozoïdes produits de la puberté à la fin de vie dépendra en grande partie de la gamétogenèse fœtale et de la capacité des gonocytes à se transformer en spermatogonies souches ; la suppression expérimentale d'une partie de ces cellules chez l'embryon conduit à une diminution de la production spermatique chez l'adulte [20].
Maturation sexuelle
Les cellules de Sertoli se multiplient activement jusqu’à la puberté. Elles ne seront ensuite jamais renouvelées.
Physiologie

Comme les ovaires auxquels ils sont homologues, les testicules font partie de l'appareil reproducteur (en tant que gonades) et du système endocrinien (en tant que glandes endocrines). Leurs fonctions, respectivement, sont :
- la production des spermatozoïdes (spermatogenèse) ;
- la production des hormones sexuelles mâles, surtout la testostérone.
Les spermatozoïdes sont produits entre la puberté et la vieillesse à partir de cellules souches germinales (spermatogonie) qui subissent la méiose. Lors de la stimulation sexuelle, les spermatozoïdes sont expulsés des testicules et prennent part à la constitution du sperme, évacué par le pénis lors de l'éjaculation.
Les hormones stéroïdes sont la testostérone principalement et les autres androgènes. Il existe des hormones peptidiques comme Insulin-like 3.
Les deux fonctions du testicule, la spermatogenèse et la production de testostérone, sont régulées par des gonadostimulines : l'hormone lutéinisante (LH) et l'hormone folliculo-stimulante (FSH). Ces hormones sont produites, sur ordre de l'hypothalamus par l'hypophyse située à la base du cerveau.
Les bourses se rétractent et s'étendent afin de réguler leur température. Les spermatozoïdes doivent être produits à une température légèrement inférieure à celle du corps, environ 33 °C[21] ; c'est ce qui explique que les testicules sont suspendus en dehors du corps[21].
Des protéines tensioactives identiques à celles du mucus pulmonaire (protéines A, B, C et D) sont produites et/ou retrouvées dans le testicule humain sain (comme dans quelques autres tissus et fluides tels que tissus de l'appareil nasolacrymal, des voies respiratoires et du tube digestif).
Ces protéines tensioactives sont observées immunohistochimiquement combinées à la vimentine dans des cellules de Sertoli et les cellules de Leydig. Elles joueraient dans le testicule un processus à la fois immunologique et rhéologique. Une étude a recherché 4 variantes de la protéine D (SP-A, SP-B, SP-C, SP-D) ; la présence de SP-B et SP-C dans les cellules de Sertoli est corrélée à leur fonction de sécrétion liquide ; elle facilite probablement le transport des spermatozoïdes. On les retrouve dans la tumeur des cellules germinales, dite séminome, mais en moindre quantité. Elles sont aussi présentes dans le liquide séminal, mais pas dans les spermatozoïdes eux-mêmes ; notamment dans le séminome, tous les SP sont moins exprimés que dans la cellule germinale normale (ce qui pourrait inhiber les processus immunomodulateurs et de rhéologie dans la tumeur)[22]
Les testicules sont extrêmement sensibles au contact ; leur stimulation légère peut produire un plaisir sexuel intense, mais tout choc ou blessure tend à être extrêmement douloureux (sensibilité nociceptive élevée). Du fait de cette sensibilité, les testicules sont souvent la cible d'attaques dans les méthodes de combat à main nue (voir coup en dessous de la ceinture).
Testicule et système immunitaire
Les testicules ont un statut immunitaire particulier, probablement parce qu'ils sont le lieu de production et de stockage des spermatozoïdes qui sont des cellules particulières, libres et dotées d'un seul jeu de chromosome. Ces gamètes mâles ne sont produits à partir de l’adolescence, longtemps après la mise en place du « répertoire du soi » par le système immunitaire et pourraient être alors considérés comme des corps étrangers par l’organisme. Ils bénéficient de la production de protéines testiculaire spéciales qui inhibent le système immunitaire normal dans cet organe[23].
L'étude de l'immunogénicité du spermatozoïde et de l'immunité testiculaire humaine est encore incomplète, car rendue délicate par le fait qu'elle nécessite idéalement des testicules vivants (les rares dons ne provenant que d'opérations de réassignation sexuelle, et uniquement du sexe masculin vers le sexe féminin)[23]. Son histoire commence il y a plus d'un siècle à l'Institut Pasteur où l'on a peu à peu découvert la possibilité de réaction auto immune tuant les propres spermatozoides de certains patients (pour cette raison stériles)[24]. On a montré que des anticorps anti-spermatozoïdes (ASA) peuvent aussi nuire au spermatozoïde lors de sa migration dans la glaire et lors de la fécondation. Ces anticorps peuvent cibler divers antigènes et affecter la fertilité, la mobilité des spermatozoiïdes et la fusion des gamètes[24]. Leur présence et leurs caractéristiques sont à prendre en compte lors d'une assistance médicale à la procréation[24] ;
Il existe donc une protection immunitaire intra testiculaires pécifique des spermatozoïdes (immunotolérance du testicule) impliquant notamment[24] :
- la barrière hémato-testiculaire,
- la production de protéines immunosuppressives par les cellules de Sertoli
- le système fas
Enjeux : la tolérance immunitaire du testicule peut parfois profiter à certaines cellules cancéreuses, et être utilisée par certains microbes (virus notamment, du SIDA en particulier) qui peuvent persister dans le testicule en dépit d'un traitement ailleurs efficace (trithérapie par exemple dans le cas du VIH). Récemment, la détection de virus SARS-CoV-2 dans le sperme de quelques personnes infectées laisse penser que ce virus (responsable de la COVID-19) pourrait, au moins parfois, profiter de cet asile immunitaire. Ceci pose la question d'une éventuelle transmission sexuelle[23].
Des chercheurs tentent de rendre les cellules immunitaires actives dans les testicules, au moins provisoirement, le temps d’éradiquer de type d'intrus[23].
Techniques d'exploration
- La palpation permet d'apprécier l'absence de nodule et la relative symétrie de leur taille.
- La transillumination avec une simple lampe de poche est un examen très simple permettant de s'assurer de l'absence de corps étrangers (débris métalliques par exemple) ou d'épanchement liquidien (sanguin le plus souvent).
- Si besoin, on peut procéder à une échographie.
- Pour s'assurer de sa viabilité, faire pratiquer un spermogramme.
Il faut absolument éviter de pratiquer tout examen radiologique de cette zone, les rayons X nuisant gravement aux spermatozoïdes.
Pathologies
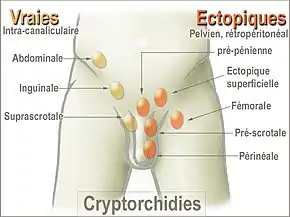
Les maladies les plus fréquentes des testicules sont :
- cryptorchidie ou absence de descente des testicules dans les bourses ;
- orchite (inflammation des testicules) banale fréquemment d'origine ourlienne ou X (virale le plus souvent) ;
- cancer du testicule ;
- hydrocèle (accumulation de fluide autour des testicules) ;
- éléphantiasis (atteinte parasitaire) ;
- épididymite (inflammation de l'épididyme) ;
- fonte purulente d'un testicule, à la suite d'une attaque infectieuse grave et tout à fait comparable ;
- Atrophie testiculaire (conséquence possible d'une infection à virus Zika chez la souris de laboratoire[25] ;
- torsion testiculaire ;
- microcalcifications intratesticulaires[26].
Des pathologies connexes (du scrotum) sont :
- dermites et dermatoses diverses ;
- varicocèle (dilatation des veines des bourses)
- microcalcifications extratesticulaires.
Des pantalons trop isolants (comme les pantalons de ski produisant une température trop élevée) ou trop serrés (jeans), ainsi que l'exposition prolongée à une source de chaleur (batterie d'ordinateur portable par exemple) sont une cause fréquente de stérilité transitoire.
Le syndrome de dysgénésie testiculaire (TDS) semble de plus en plus fréquent et pourrait avoir pour origine une contamination du fœtus par des perturbateurs endocriniens[27],[28].
Si un testicule est enlevé chirurgicalement (orchidectomie) ou détruit par maladie ou accident, on peut se servir de prothèses testiculaires pour simuler l'apparence du testicule perdu. Les premières prothèses, après la Première Guerre mondiale étaient faites d'une simple balle de ping-pong. L'ablation des deux testicules s'appelle la castration. La stérilisation masculine par vasectomie n'implique pas l'ablation des testicules ; ils poursuivent leurs fonctions normales. La vasectomie est l'enlèvement d'une partie du canal déférent, de façon à empêcher les spermatozoïdes de sortir lors de l'éjaculation.
Usage en gastronomie
Les testicules des animaux s'appellent animelles ou rognon blanc. Les animelles font partie des aliments à cuisiner dans certains pays (Italie, Espagne où on les nomme criadillas, Belgique, États-Unis (Rocky Mountain oysters)). On peut les servir avec des frites ou avec une sauce qui convient avec des tripes, chaudes ou froides. De nombreuses personnes pensent erronément que les choesels bruxellois sont préparés avec des animelles ; ce mets est en réalité composé de pancréas de bœuf.
Certains testicules d'animaux sont aussi consommés pour leurs prétendus effets aphrodisiaques.
Notes et références
- À l'exception des Tubulidentés dont les mâles ont des testicules inguinaux et sous cutanés.
- Bininda-Emonds O R P, Cardillo M, Jones K E, MacPhee R D E, Beck R M D, Grenyer R, Price S A, et Vos R A et al. 2007 « The delayed rise of present-day mammals »; Nature (Londres) 446, p.507–512
- L'internalisation permet de maximiser l'hydrodynamisme. Ces mammifères marins sont munis d'un échangeur de chaleur à contre-courant qui permet d'assurer une basse température favorisant une spermatogenèse optimale
- Frey R 1991 Zur Ursache des Hodenabstiegs (Descensus testiculorum) bei Säugetieren; Z. Zool. Sys. Evolut-Forsch. 29, p.40–65
- Voir ce site
- G. Cavalie, Alexandre Bellier, G. Marnas et B. Boisson, « Anatomy and histology of the scrotal ligament in adults: inconsistency and variability of the gubernaculum testis », Surgical and Radiologic Anatomy, vol. 40, no 4, , p. 365–370 (ISSN 0930-1038 et 1279-8517, DOI 10.1007/s00276-017-1904-1, lire en ligne, consulté le )
- Georges baron Cuvier, Constant Duméril, Georges Louis Duvernoy et Simon Charles Miger, Leçons d'anatomie comparée, Crochard, libraire ..., Fantin, libraire ..., Baudouin, imprimeur, (lire en ligne)
- Carl R. Moore, The biology of the mammalian testis and scrotum, The Quarterly Review of Biology, 1(1), 1926, p.4–50
- (en) Adolf Portmann, Animal forms and patterns, Schocken Books, , p. 181.
- Setchell BP (1998) The Parkes Lecture. Heat and the testis. J Reprod Fertil 114: 179-94
- Werdelin L and Nilsonne A 1999 The evolution of the scrotum and testicular descent in mammals: a phylogenetic view; J. Theor. Biol. 196, p.61–72
- Short R V 1997 The testis: the witness of the mating system, the site of mutation and the engine of desire; Acta. Paediatr. Suppl. 422, p. 3–7
- Bedford J M 1978 Anatomical evidence for the epididymis as the prime mover in the evolution of the scrotum; Am. J. Anat. 152, p. 483–507
- Freeman S 1990 The evolution of the scrotum: a new hypothesis; J. Theor. Biol. 145, p.429–445
- (en) Liam Drew, I, Mammal : The Story of What Makes Us Mammals, Bloomsbury Publishing, , p. 17
- A. Chance, Reasons for externalization of the testes of mammals, in «Journal of Zoology, London», 1996, 239, p. 691-695
- Bedford J M 2004 Enigmas of mammalian gamete form and function; Biol. Rev. Camb. Philos. Soc. 79, p.429–460
- Kleisner K, Ivell R, Flegr J. The evolutionary history of testicular externalization and the origin of the scrotum. J Biosci. 2010, 35(1), p.27-37.
- Habert R, Lejeune H, Saez JM. Origin, differentiation and regulation of fetal and adult Leydig cells. Mol Cell Endocrinol 2001 ; 179 : 47-74.
- Orth JM, Gunsalus GL, Lamperti AA. Evidence from Sertoli cell-depleted rats indicates that spermatid number in adults depends on numbers of Sertoli cells produced during perinatal development. Endocrinology 1988 ; 122 : 787-94.
- R Mieusset, L Bujan, A Mansat et F Pontonnier, « Hyperthermie scrotale et infécondité masculine », Progrès en Urologie, no 2, , p. 31-36 (lire en ligne)
- Beileke, S., Claassen, H., Wagner, W., Matthies, C., Ruf, C., Hartmann, A., ... & Bräuer, L. (2015) Expression and localization of lung surfactant proteins in human testis. PLoS One, 10(11).
- « La Covid-19, sexuellement transmissible ou pas ? », (consulté le ).
- Martine Albert, « Signification et traitement des anticorps anti-spermatozoïdes dans la glaire, le sang et le liquide séminal », Andrologie, vol. 13, no 1, , p. 62–62 (ISSN 1166-2654 et 1760-5377, DOI 10.1007/bf03034411, lire en ligne, consulté le )
- Ryuta Uraki & al. (2017), Zika virus causes testicular atrophy ; Science Advances 22 février 2017: Vol.3, n° 2, e1602899 DOI: 10.1126/sciadv.1602899 (résumé)
- X. Durand, M. Lahutte, "Calcifications testiculaires", EM-consulte, 08/03/11, consulté le 25/07/20
- Sharpe RM, Irvine DS. How strong is the evidence of a link between environmental chemicals and adverse effects on human reproductive health? Br Med J 2004 ; 328 : 447-51.
- Skakkebaek NE, Rajpert-De Meyts E, Main KM. Testicular dysgenesis syndrome: an increasingly common developmental disorder with environmental aspects. Hum Reprod 2001 ; 16 : 972-8.
Voir aussi
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- Uberon
- Xenopus Anatomy Ontology
- (en) Medical Subject Headings
- (en) NCI Thesaurus
- (la + en) TA98
- (cs + sk) WikiSkripta
- Cours de médecine pour étudiants 4e année, par le Dr Louis Guillou, de l'Institut universitaire de pathologie, Lausanne, CH
- Portail de l’anatomie
- Portail de la médecine
- Portail de la physiologie
- Portail de la sexualité et de la sexologie
