Théorie des histoires de vie
La théorie des histoires de vie est une branche de la biologie évolutive[1]. Elle tente d’expliquer comment l’évolution forme les différents organismes pour qu’ils atteignent le succès reproducteur[2]. Elle analyse ce qui cause les différences de valeur adaptative (« fitness ») entre les différents génotypes et phénotypes retrouvés dans la nature. Elle est essentielle à la compréhension de l’action de la sélection naturelle. De plus, la dynamique des populations d’espèces interagissant ensemble est déterminée par leurs traits d’histoire de vie ainsi que par la plasticité de ceux-ci. Les traits d’histoire de vie principaux sont : la taille à la naissance, le patron de croissance, l’âge à maturité, la progéniture (nombre de jeunes, taille et sexe-ratio), les investissements reproducteurs âge et taille-dépendants, la mortalité âge et taille-dépendante et la durée de vie[2],[3],[4].
Ces traits sont d’origine démographique et ils sont directement liés à la reproduction et à la survie des individus. Les organismes ont évolué plusieurs façons de combiner ces traits ce qui affecte leur valeur adaptative et c’est dans ce sens que l’évolution des histoires de vie est intéressante. Ces traits sont aussi liés par plusieurs compensations (« trade-offs »), par exemple la reproduction effective pour la survie[3]. La combinaison caractéristique de certains traits d’histoire de vie, par exemple le développement lent combiné à une longue durée de vie et un taux de fécondité faible, s’explique par la variation de ces compensations entre les espèces et groupes supérieurs[2]. La sélection naturelle favorise les individus qui allouent leur énergie et leur temps de manière optimale en balançant les coûts et les bénéfices selon les compensations affectant leur valeur adaptative. Ceci varie grandement en fonction de l’environnement et celui-ci est donc une source de variation menant à différentes histoires de vie. De plus, l’histoire de vie d’un organisme est ancrée dans un contexte écologique incluant d’autres organismes ce qui contribue aussi à la grande diversité des histoires de vie retrouvée dans le monde du vivant[1].
Méthodes d’analyse
Les analyses d’histoire de vie ont comme but général de comprendre la combinaison de traits démographiques que la sélection naturelle maximise. Les quatre questions principales en lien avec l’évolution des histoires de vie portent sur : les bases génétiques, les paramètres écologiques, la plasticité phénotypique et les interactions et compensations dans l’évolution des traits d’histoire de vie[4]. Il est possible de prédire l’évolution des traits d’histoire de vie en considérant leur impact sur les taux de mortalité et de fécondité ainsi que sur les compensations[2].
Les histoires de vie sont souvent analysées en ciblant les attributs démographiques des populations, ce qui est généralement corrélé avec des phénomènes écologiques basés sur les habitats. Ces analyses intègrent des composants génétiques, développementaux et écologiques. Au départ, elles consistaient plutôt en des analyses descriptives et comparatives mais elles sont passées à une forme expérimentale. Les effets des paramètres écologiques sur les histoires de vie, les bases génétiques et la nature de la plasticité menant aux différentes histoires de vie peuvent maintenant être testés expérimentalement[4].
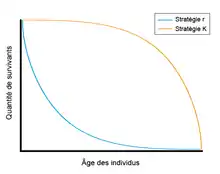
Les stratégies r et K sont souvent utilisées pour mettre en contexte les analyses des traits d’histoire de vie. Les espèces à stratégie r se reproduisent tôt et ont beaucoup de descendants qui atteignent la maturité vite. Les générations sont courtes et ces espèces présentent un haut taux de mortalité. De plus, elles ne font pas ou peu de soins parentaux et se retrouvent dans des environnements imprévisibles et changeants. Les espèces à stratégie K se reproduisent à un âge plus avancé, ont peu de descendants et atteignent la maturité tard. Les générations sont longues et ces espèces font des soins parentaux et se retrouvent dans des environnements stables et prévisibles[4].
Dans la théorie des histoires de vie, les coûts et les bénéfices sont mesurés en termes de valeur adaptative. La somme des coûts réduisant la valeur adaptative et des bénéfices augmentant la valeur adaptative donne l’équilibre évolutionnaire d’un trait[3].
Traits d’histoire de vie principaux
Âge au premier évènement de la reproduction
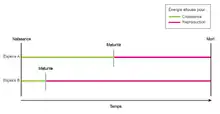
Chez les animaux, l’âge au premier évènement de la reproduction correspond à l’âge à la maturité. Chez les plantes, l’âge à maturité est définie par l’âge à laquelle les graines de la plantes sont mûres[3]. Aucun organisme n’est perfectionné pour la reproduction. Un tel individu serait mature à la naissance, ne mourrait jamais et produirait une grande quantité de jeunes de très haute qualité, ce qui est impossible. Les histoires de vie sont intimement liées à la reproduction et elles ne sont pas parfaites. En effet, les organismes n’ont pas nécessairement le temps ou la variation requis pour l’évolution d’une histoire de vie optimale[1].
Dans une perspective biologique et d’évolution de l’âge et de la taille à maturité, la vie d’un organisme est divisée par le processus de maturation en une partie de préparation et une partie de réalisation[3]. La préparation consiste en la croissance de l’individu et la réalisation correspond à la reproduction et propagation des gènes à la génération suivante. L’âge et la taille à maturité peuvent varier à même un taxon ou entre taxons ainsi qu’à l’intérieur d’une population d’une seule espèce. Chez les animaux, au sein d’une même espèce, les deux sexes peuvent aussi atteindre la maturité à différents âges et tailles. Ce phénomène est appelé la bimaturation (« bimaturism »). Par exemple, les mâles atteindront la maturité à une taille plus grande et un âge plus avancé que les femelles dans un contexte où ils doivent être en compétition pour contrôler l’accès à celles-ci[3].
Un organisme dispose d’un certain niveau d’énergie et de temps qu’il doit allouer pour les différents processus biologiques menant à sa croissance et à sa reproduction[1]. Il existe des bénéfices à se reproduire plus tôt, par exemple une plus grande probabilité de survivre jusqu’à la maturité, la possibilité d’avoir plus de juvéniles et un temps de génération plus court. D’un autre côté, il existe aussi des avantages à se reproduire plus tard. En effet, atteindre la maturité plus tard permet une plus grande fécondité puisque la taille du corps est plus grande et permet ainsi d’avoir des juvéniles de meilleure qualité et un taux plus élevé de survie des juvéniles si le parent est plus apte à prodiguer des soins parentaux. Dans de tels cas, il est avantageux de se reproduire plus tard et plusieurs organismes adoptent cette stratégie[2],[3].
Une étude comparant 547 espèces de mammifères à partir de données prises dans la littérature[5] a démontré que la taille de l’individu ainsi que l’histoire phylogénétique appliquaient une plus grande contrainte que les facteurs écologiques sur l’âge au premier événement de reproduction. La taille de l’animal pourrait donc imposer une pression de sélection sur l’âge à la première reproduction en déterminant le temps nécessaire pour que l’animal atteigne l’âge adulte. En enlevant le facteur de la taille, des différences significatives ont été trouvées entre les espèces selon l’habitat et la niche trophique ce qui correspond aux prédictions de la théorie des stratégies r et K. Les individus habitant des environnements instables (habitats arctiques, désertiques et savanes) se reproduisaient plus tôt que les individus habitant des environnements stables[5].
Durée de vie et vieillissement de la reproduction
La théorie du vieillissement peut expliquer les variations dans les histoires de vie entre populations et espèces[1]. Les effets du vieillissement (ou sénescence) sont une augmentation du taux de mortalité et une diminution du taux de fécondité vers la fin de la vie de l’individu[1],[2],[3]. Le vieillissement n’est donc pas adaptatif et entraîne une diminution de la force de sélection avec l’âge. Les effets génétiques contribuant au vieillissement sont la pléiotropie antagoniste, c’est-à-dire un gène ayant des effets négatifs en fin de vie mais qui avait un effet positif en début de vie, et l’accumulation de mutations, c’est-à-dire que certaines mutations délétères agissant à un âge plus avancé seront accumulées dans la population parce qu’elles n’ont pas été éliminées par la sélection[1],[3]. Le vieillissement consiste en une augmentation des composants intrinsèques de la mortalité avec l’âge. Ceux-ci sont influencés par les changements d’allocation parmi les comportements et les structures de reproduction, de maintenance et de défense. Ils sont donc sensibles aux changements dans les décisions de reproduction contrairement aux composants extrinsèques qui eux ne le sont pas[3].
La durée de vie varie grandement entre les différents taxons. Par exemple, chez les métazoaires, les rotifères ont une durée de vie d’environ une semaine tandis que certains animaux peuvent vivre jusqu’à 100 ans, entre autres certaines tortues, certains gros poissons et même certains mammifères. Chez les plantes, on retrouve une grande variation dans les durées de vie totales mais aussi dans les durée de vie reproductive. Par exemple, il existe des plantes n’ayant qu’un seul événement de reproduction dans leur vie. On parle alors de monocarpie, ou sémelparité chez les autres organismes, en opposition à la polypocarpie ou itéroparité lorsque l’individu a plusieurs évènements de reproduction au cours de sa vie. Les plantes monocarpes peuvent tout de même avoir une durée totale de vie longue bien que leur reproduction ait déjà été accomplie[3].
Les relations entre la moyenne et la variance de la mortalité adulte et juvénile contrôlent l’évolution de la durée de vie reproductive. Une diminution de la durée de vie reproductive serait entraînée par une augmentation de la mortalité adulte menant à la sémelparité et à l’inverse, une augmentation de la durée de vie reproductive serait entraînée par une augmentation de la mortalité juvénile menant à des organismes vivant longtemps et investissant dans les structures somatiques et les réparations de celles-ci[3].
Il existe un équilibre entre la sélection pour augmenter le nombre d’événements reproducteurs par durée de vie, ce qui allonge la durée de vie, et le coût entraîné par la reproduction augmentant les sources de mortalité avec l’âge, ce qui raccourcit la durée de vie. Un taux de mortalité adulte bas, un taux de mortalité juvénile élevé, une augmentation dans la variation des taux de mortalité des juvéniles entre les événements de reproduction et une diminution des taux de mortalité des adultes entre les événements de reproduction sont des pressions de sélection augmentant la durée de vie. Celles-ci augmentent la valeur des adultes mais diminuent celle des juvéniles. La conséquence est que la contribution reproductrice des adultes est augmentée mais que les juvéniles sont plus à risque[2].
Une étude sur le gobe-mouche à collier (Ficedula albicollis) effectué sur une durée de 20 ans[6] a démontré que la taille des nichées chez les individus plus âgés était affectée par leur effort reproducteur en début de vie. Les performances reproductives des femelles augmentaient lorsqu’elles atteignaient la maturité sexuelle mais diminuaient à des âges plus avancés malgré l’absence de changement significatif dans leurs probabilités de survie. La diminution des performances reproductives chez les individus plus âgés serait due à une détérioration innée de l’individu et non pas à des blessures ou autre problème physique. Ceci indiquerait donc qu’un coût de reproduction plus élevé plus tôt dans la vie aurait un effet permanent sur un individu et induirait une accélération du vieillissement et pourrait ainsi réduire sa durée de vie et sa fertilité à long terme[6].
La taille et le nombre de progénitures
Le but de tous organismes sur Terre est de se reproduire et d’avoir le meilleur fitness reproductif possible, mais n’y a-t-il pas des compromis à faire ?
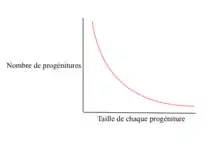
Théoriquement, tous diraient que le meilleur fitness reproductif serait attribué aux parents qui produisent en très grande quantité, des progénitures de grande taille qui survivent jusqu’à l’âge de maturité sexuelle. Pourtant, il est clair que ce type d’organisme n’existe pas. S’il existait, il serait le seul sur la planète Terre, car il dominerait tous les êtres vivants. Ce dont nous sommes certain est qu’il y a une corrélation négative très évidente entre le nombre de rejetons et la grosseur de ceux-ci chez les mammifères, chez les insectes, chez les poisons, chez les oiseaux, etc.[1],[7].
C’est par une multitude de compromis que les organismes essaient de produire un nombre de progénitures optimales d’une certaine taille dans les conditions dans lesquelles ils se retrouvent.
Hypothèse de Lack
Une des premières hypothèses sur la taille de la portée est celle de David Lack (1947-1948) qui propose une grosseur de ponte intermédiaire fixe produisant plus de descendants aptes à se reproduire que dans une grosse ou une petite ponte.
Cette grosseur intermédiaire de ponte tient compte de la survie et de la performance reproductive des progénitures. Ainsi, celle-ci augmenterait le nombre de rejetons capable d’atteindre l’âge de maturité sexuelle[3],[8]. Malheureusement, plusieurs études, chez des espèces d’oiseaux, ont démontré que la femelle pond un nombre d’œufs plus petit que le nombre optimal prévu hypothétiquement par Lack[8]. Il y a quelques lacunes dans cette théorie : elle ignore le succès reproducteur du parent et la survie de celui-ci, ses reproductions futures, les compromis liés à l’environnement, la durée de gestation, le temps de développement, le choix de l’habitat, la compétition entre les rejetons, etc.
Variables influençant le compromis entre la taille de la portée et le nombre de descendants
Il est possible de comprendre comment s’effectue le choix entre taille et nombre des descendants chez les parents en analysant plusieurs variables qui entrent en jeu lorsqu’un individu décide de produire beaucoup de petites progénitures ou peu de grosses progénitures :
- Chaque descendant a une meilleure chance de survie s’il est gros. Il y a une grandeur minimale, pour chaque espèce, où l’individu n’aurait aucune chance de survie[1]. Par contre, plus les descendants sont gros, moins le parent peut en produire.
- Plus un parent a de progénitures à s’occuper, moins il passera de temps et d’énergie à s’occuper de chacun d’entre eux. Il n’est pas favorable d’avoir trop de descendants si le parent n’est pas capable d’offrir les soins nécessaires à chacun. Selon des études, l’ajout artificiel d’un œuf dans un nid d’oiseau, qui fera dépasser la taille optimale de descendants, amènera la femelle à produire une couvée plus petite l’année suivante[1]. Les nids surpeuplés entraînent plus de compétition et plus de mortalité, ce qui diminue le fitness du parent ; il pondra en conséquence d’augmenter son propre succès reproducteur l’année suivante.
- Dans ses études, Williams (1966) a trouvé que lorsqu’une femelle produit trop de descendants, cela influencera grandement ses reproductions futures. En d’autres mots, produire un descendant de plus que la taille optimale, affecte négativement la reproduction future de plus d’un descendant[8].
- Aussi, la taille de la couvée du parent influencera non seulement la survie des rejetons, mais leurs performances reproductives ; un rejeton provenant d’une grosse couvée où il y a eu beaucoup de compétition produira une plus petite couvée[1].
- Lorsque les conditions environnementales ne sont pas optimales pour la reproduction, la couvée est plus petite que dans les conditions favorables[1]. Par contre, les oiseaux sont aptes à estimer s’ils auront une bonne prochaine année ou non (estimation liée aux conditions environnementales) et puisque la grosseur de la ponte a une plasticité phénotypique, ils sont capables de produire une taille optimale de ponte chaque année en se fiant à l’environnement.
- Encore chez les oiseaux, les conflits entre les nouveau-nés sont plus forts lorsqu’il y a plusieurs paternités. Lorsqu’il y a polygamie, il y a une baisse initiale rapide dans la survie des juvéniles et celle-ci augmente avec la taille de la portée. Dans ce genre de cas, la taille de la couvée favorable à chacune des progénitures sera plus faible que la taille favorable pour le fitness reproductif du parent[1],[3].
- La qualité/grosseur de la femelle influence la taille et le nombre de descendants. Certaines femelles sont génétiquement de meilleure qualité que d’autres (fitness), ce qui entraîne généralement un meilleur poids[8]. Il a été prouvé (Allan, 1983), chez les poissons, qu’il y a une corrélation positive entre la grosseur de la femelle et le volume des œufs. Aussi, Perrins et Moss (1975) ont montré, chez les oiseaux, que la grosseur de la portée et la qualité de la femelle sont des variables corrélées ; celles qui produisent de plus grosses portées survivent, tandis que les femelles qui ont produit de plus petites portées (comparativement à la moyenne) meurent généralement dans l’année suivante[9].
- L’habitat peut aussi influencer le nombre et la taille des descendants : c’est le cas chez les poissons-téléostéens. Les poissons d’eau douce ont significativement des plus gros œufs en moins grande quantité que les poissons marins. L’environnement marin favorise une production de grande portée, car il y a très peu de survivants. Ainsi, dans cet exemple, la grandeur n’influence en rien la reproduction[7]. Aussi, la qualité de l’habitat influence le nombre et la taille des descendants, car un habitat pauvre en ressources amène des difficultés supplémentaires à la reproduction[9].
- La durée de vie des espèces joue un rôle dans l’investissement reproductif : les animaux de petite taille ont une moins longue durée de vie, ils vont produire plus de descendants, ainsi, ils investissent plus d’énergie dans la reproduction, tandis que les animaux de grande taille avec une longue durée de vie, doivent, eux investir plus dans l’auto-préservation[9]. Une durée de la période de gestation courte amène une petite taille de portée, mais, habituellement, ces animaux pourront avoir plusieurs pontes par année ou par période de reproduction et vice versa pour les organismes à longue gestation[9].
- Le temps de développement des progénitures influence la taille de la portée, car de petits nouveau-nés se développent rapidement et n’ont généralement pas besoin de beaucoup de soins maternels, la femelle peut donc produire plus de descendants[9].
Guêpe parasitoïdes
Chez les guêpes parasitoïdes, le même patron de ponte peut être vu. Chez ces hyménoptères, il y a un dilemme entre le nombre d’œufs et la survie de ceux-ci. Si la femelle pond en trop grosse quantité, les larves entrent en compétition entre eux pour la nourriture, c’est-à-dire l’hôte sur lequel la femelle a pondu. Donc, la quantité de nourriture disponible (l’hôte) influencera la quantité d’œufs que la femelle laissera sur celui-ci. Par chance, la grosseur des pontes est très flexible, ainsi, si l’hôte est petit, la femelle laissera moins d’œufs. En plus, ces femelles sont capables de produire plus d’une portée par période de reproduction. De ce fait, si la guêpe laisse peu d’œufs sur un hôte pauvre, elle peut immédiatement trouver un autre hôte à parasiter et y laisser d’autres œufs. Grâce à cette adaptation, la guêpe parasitoïde, même si elle trouve des hôtes faibles en nourriture, peut augmenter son fitness reproducteur, car elle peut pondre dans plusieurs hôtes. Ce caractère évolutionnaire permet de répartir les œufs et de maximiser la survie des progénitures[1]. Le succès reproducteur et la survie du parent ne sont pas influencés négativement par la reproduction[3].
S.limatus
Le coléoptère S.limatus est caractérisé par une femelle qui peut pondre ses œufs sur des hôtes végétaux différents. Il a été démontré par Fox et al (1997) que selon la qualité de la plante hôte, la femelle est capable de modifier la grosseur des œufs et la taille de sa ponte. Par exemple, sur un hôte de mauvaise qualité, la femelle laissera peu d’œufs, mais de très grosse taille, considérant la probabilité élevée de mortalité. Tandis que sur l’hôte de bonne qualité, elle laissera beaucoup d’œufs de petite taille[1].
Impact de la manipulation humaine sur les tailles des œufs
Heath et al (2003) ont fait une étude sur des saumons en élevage dans des couvoirs artificiels remis en milieu naturel. De plus, petits œufs de saumons étaient sélectionnés artificiellement, contrairement aux œufs du milieu naturel. Ils ont trouvé que le flux de gène sélectionnant pour de petits œufs a eu une influence sur l’évolution de la taille optimale des œufs de saumons en milieu naturel[1].
Ainsi, un compromis entre le nombre de descendants et la grosseur de la portée est un équilibre évolutionnaire qui est obligatoire chez la plupart des organismes prenant en compte plusieurs variables telles que : le succès reproducteur du parent et la survie de celui-ci, ses reproductions futures, les compromis liés à l’environnement, la durée de gestation, le temps de développement, le choix de l’habitat, la compétition entre les rejetons, etc. Les organismes sont flexibles et ajustent leur reproduction en fonction de leurs environnements pour optimiser leurs fitness individuels[3]. En d’autres mots, les variations dans les traits de l’histoire de vie, ainsi que la variation naturelle amènent des stratégies alternatives chez les différents individus[8].
Les larves qui s’alimentent et celles qui ne s’alimentent pas, ainsi que leurs développements
Les embryons et les larves sont sujets à la sélection naturelle et à l’adaptation. Comme le disait Bonner’s en 1965 : « The life cycle is the unit of evolution ». En d’autres mots, il est important d’étudier l’écologie et le fonctionnement de l’évolution de la larve pour comprendre le développement de la biologie.
Plusieurs caractères qui apparaissent tôt dans le développement d’un individu montrent la sélection naturelle. Celle-ci peut entraîner des variations dans les formes larvaires qui ne seront pas visibles ou peu au stade adulte.
L’exemple qui illustre le mieux les variations dans les formes larvaires se retrouve chez les invertébrés marins. Il y a plusieurs types de larves qui ont tous une forme différente :
- Des larves avec un développement planctonique et une alimentation,
- Des larves avec un développement planctonique, mais sans alimentation,
- Des larves benthiques qui se développent dans une masse d’œufs,
- Des larves benthiques qui sont couvées de façon externe, et
- Des larves couvées de façon interne.
Notez qu’un individu peut passer par plusieurs de ces formes larvaires[10].
Par exemple, chez les balanes, l’individu est initialement couvé, mais à la suite du développement, il deviendra une larve avec un développement planctonique qui s’alimente. Ainsi, elle changera de forme morphologique au fur et à mesure de son développement[4].
Les études effectuées en évolution et développement portent en général sur les larves qui s’alimentent et celles qui ne s’alimentent pas. Les différents types de larves amènent, à chacun, des structures morphologiques différentes, et ce, depuis la division cellulaire due à l’expression différente d’une variété de gènes, ainsi que des avantages et des inconvénients[1],[4].
Les larves qui se nourrissent/ les larves planctoniques
- La grosseur des œufs est petite (<500µm) et ceux-ci sont pauvres en vitellus. Par contre, ils peuvent être produits en quantité énorme (105-107 œufs)[4],[10].
- Le taux de croissance et le développement indirect de ces larves sont généralement plus lents que ceux des larves qui ne s’alimentent pas[4],[10].
- Le risque de mortalité est plus haut chez ces larves, car elles sont obligées de croître dans la zone pélagique pour se nourrir tout au long du développement, ou seulement pour une période de leur développement, ce qui les confronte à plus de prédation. En plus, ils n’ont que peu de protection de leur parent, et lorsque ceux-ci les relâchent, ils le font n’importe où et n’importe quand. Par contre, ces larves peuvent choisir un site favorable sur une distribution géographique très large lorsqu’elles se dispersent[4],[10].
- Ce type de larve, puisqu’elle se retrouve dans la zone pélagique, a une très grande dispersion, accompagnée d’un bon flux de gène, ce qui limite la spéciation et les extinctions[10].
- Ce type de larve est le plus primitif[1].
Pourquoi choisir ce mode de reproduction/type de larve ?
L’individu peut pondre en grosse quantité, mais de petits œufs. Il effectue un compromis entre le haut taux de fécondité et le haut taux de mortalité de la progéniture en milieu pélagique. Les variations dans le taux de mortalité peuvent produire des échecs de reproduction fréquents, mais la femelle peut s’accoupler plus souvent[4],[10].
Larves qui ne se nourrissent pas/ les larves benthiques (lecithetrophic)
- Les œufs sont larges et riches en vitellus, mais produits en plus petite quantité (12-100 œufs)[4],[10].
- Le taux de croissance et le développement direct sont plus rapides chez ces larves, car ils sont dotés de tous les matériaux et l’énergie nécessaire contenue dans le vitellus pour faire la métamorphose[4],[10].
- Ces larves, qui subissent peu de prédation, sont souvent recouvertes d’une gelée ou d’une capsule, elles sont aussi protégées par les déplacements migratoires et diurnes des parents, ce qui réduit les menaces physiologiques et/ou biologiques. De plus, les parents choisissent avec soin l’endroit où les œufs seront déposés[4],[10].
- Ce type de larve est restreint dans sa distribution géographique et donc, sa dispersion. De ce fait, il y a un moins grand flux de gène ce qui augmente la spéciation et les chances d’extinction des espèces[10].
- Ce type de larve a une morphologie simplifiée et évoluée[1].
Pourquoi choisir ce mode de reproduction/ type de larve ?
L’individu peut pondre de gros œuf, mais en faible quantité. Il effectue un compromis entre le faible taux de fécondité et le haut taux de survie de la progéniture. Les espèces pondant ce type de larve ne peuvent habituellement pas s’accoupler plusieurs fois répétitivement, mais la survie de la progéniture est très prédictible, ainsi ce ne serait pas nécessaire[4].
L’évolution de nouveaux traits
Strathman (1978) soumet que la larve planctonique, donc celle qui s’alimente et se disperse, est très complexe et qu’elle apparaît chez des espèces trop éloignées phylogéniquement pour avoir évolué plusieurs fois. Wray (1995) prouve que les larves planctoniques datent de centaines de millions d’années tandis que les larves qui ne s’alimentent pas datent de seulement 50 millions d’années. Aussi, par parcimonie, on soutient aujourd’hui l’hypothèse que c’est la larve qui ne s’alimente pas qui a évolué plusieurs fois[1].
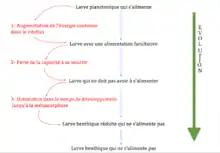
La plupart des phylogénies sur les différents stades larvaires montrent un grand nombre de pertes de caractères pour les larves planctoniques[4]. L’évolution a favorisé la simplification et la perte de structures utilisées pour l’alimentation et la nage et ces modifications seraient irréversibles.
La sélection favorise une larve plus grosse avec un vitellus riche en énergie, ce qui permet à la larve de ne plus se nourrir et de faire son développement plus rapidement. Hart (1996) a étudié une larve intermédiaire (Brisaster latifrons) entre la larve qui s’alimente et celle qui ne s’alimente pas pour pouvoir comprendre la perte des caractères. La larve de Brisaster latifrons est produite dans de gros œufs, mais possède toujours les structures pour s’alimenter, même si elle n’en a pas de besoin pour faire la métamorphose. Ainsi, la simplification de la structure et le nouveau développement de la larve seraient initiés par la sélection pour un simple avantage dans l’histoire de vie : des œufs plus gros[1].
Notes et références
- (en) Freeman, S., Evolutionary analysis, Upper Saddle River, NJ, Pearson Prentice Hall, , 802 p., p. 455-500
- (en) Stephen C. Stearns, « Life history evolution: successes, limitations, and prospects », Naturwissenschaften, vol. 87, , p. 476-486 (ISSN 0028-1042 et 1432-1904, DOI 10.1007/s001140050763, lire en ligne)
- (en) Stearns, S. C., The evolution of life histories, Oxford, Oxford University Press, , 249 p., p. 123-150, 180-205
- (en) Hall, B. K., Keywords and concepts in evolutionary developmental biology, Cambridge, MA, Harvard University Press, , 476 p., p. 234-242
- J. Timothy Wootton, « The Effects of Body Mass, Phylogeny, Habitat, and Trophic Level on Mammalian Age at First Reproduction », Evolution, vol. 41, , p. 732-749 (DOI 10.2307/2408884, lire en ligne, consulté le )
- (en) Lars Gustafsson et Tomas Pärt, « Acceleration of senescence in the collared flycatcher Ficedula albicollis by reproductive costs », Nature, vol. 347, , p. 279-281 (DOI 10.1038/347279a0, lire en ligne, consulté le )
- (en) Elgar, Mark A., « Evolutionary compromise between a few large and many small eggs: comparative evidence in teleost fish. », Oikos, , p. 283-287
- (en) van Noordwijk, A. J. et G. de Jong., « Acquisition and Allocation of Resources: Their Influence on Variation in Life History Tactics. », The American Naturalist, no 128.1, (1986), p. 137-142.
- (en) Calder, William A., Size, function, and life history., Courier Corporation,
- (en) Strathmann, Richard R., « Feeding and nonfeeding larval development and life-history evolution in marine invertebrates. », Annual review of ecology and systematics, , p. 339-361.
Voir aussi
Articles connexes
Liens externes
- Life History Evolution
- The Evolutionary Theory of Aging
- Phenotypic Plasticity for Offspring Traits in Polygonum Persicaria
- The evolution of phenotypic plasticity in life-history traits: predictions of reaction norms for age and size at maturity
- The Evolution and Loss of Feeding Larval Stages of Marine Invertebrates
- Portail de la biologie