Dispersion (biologie)
En biologie et en écologie, la dispersion désigne de manière générale tous les processus par lesquels des êtres vivants, se séparant (ou étant séparés) géographiquement d'une population d'origine, colonisent (ou recolonisent) un nouveau territoire. Elle correspond aux mouvements d’individus, dans le temps et l’espace, et modifie les flux de gènes entre les populations (la population est définie comme un ensemble d’individus d’une même espèce et interagissant entre eux, à un endroit donné, et à un moment donné). Elle est ainsi fortement corrélée à la reproduction, la dispersion peut s’effectuer après la naissance et avant la première reproduction, ou entre deux événements de reproduction[1]. La dispersion se décompose en trois étapes, d’abord l’émigration (lorsque l’individu quitte son habitat d’origine), puis le transfert (le déplacement en lui-même), et enfin l’immigration (l’installation dans le nouvel habitat) ; et en deux modes (actif et passif). Elle optimise la fitness (ou valeur sélective) de l’individu et permet aux espèces de coloniser de nouveaux milieux qui peuvent être plus favorables à leur développement[2], cependant elle comporte des coûts plus ou moins importants (adaptation pour disperser plus loin, mortalité pendant le transfert, etc.). Les notions d’échelles spatiales et temporelles sont importantes pour appréhender la dispersion, en effet ces échelles seront très différentes d’une espèce à l’autre. On considèrera dans cet article, le patch comme l’unité d’habitat, c’est-à-dire un élément du paysage constituant une unité écologique fonctionnelle, plus ou moins stable ou isolée, pour une certaine échelle temporelle et spatiale.Cette action se reproduira quand la plante repousera.
Pour les articles homonymes, voir Dispersion.
Ne doit pas être confondu avec Distribution spatiale (écologie) ou Migration (écologie).


Importance biologique
Les capacités de dispersion des espèces et de leurs propagules ont une grande importance pour la diversité génétique, l'adaptation, la résilience écologique, et la survie des populations (et des communautés). Ainsi, de manière générale, la dispersion favorise l'entretien de la biodiversité, notamment dans le contexte d'une crise climatique qui survient alors que les paysages sont de plus en plus écologiquement fragmentés. Les flux de gènes sont en effet plus ou moins contraints par des « barrières » naturelles ou artificielles limitant le déplacement des individus ou espèces, au point qu'une nouvelle discipline, la « génétique du paysage » émerge[3].
La dispersion est susceptible d'influencer de manière déterminante la survie et le taux de reproduction individuel (les deux composantes de la fitness), elle est donc fortement soumise aux processus de sélection naturelle. Elle est par conséquent à l'origine de nombreuses adaptations, que celles-ci soient de nature morphologique ou comportementale, conduisant à la mise en place de « stratégies de dispersion ». L'importance de ce processus est donc considérable pour ce qui est de la survie des populations et des communautés, ainsi que pour la biologie de l'évolution, puisqu’il est, avec la vicariance, à l'origine de phénomènes de spéciation. Dans les domaines de la biologie des populations et de l'écologie du paysage, on parle de modèles de dispersion. La compréhension de ces processus est utile pour comprendre les répartitions des espèces ainsi que leur vulnérabilité face aux changements que leur habitat peut subir (isolement géographique, fragmentation).
En écoépidémiologie, la dispersion par des vecteurs animaux de certains pathogènes (virus de la grippe tel que H5N1 par les oiseaux par exemple) est un sujet d'intérêt. En écotoxicologie, la dispersion de polluants (notamment ceux susceptibles d'être bioconcentrés tels que les métaux lourds, le PCB, les dioxines, ou les radionucléides) a également une grande importance.
Théories sur les causes de la dispersion
Facteurs abiotiques
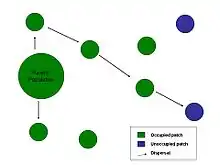
Les facteurs abiotiques, autrement dit les conditions de l’environnement (température, humidité, quantité de ressources, etc.), peuvent être la cause principale de la dispersion. La qualité d’un habitat pour un individu correspond notamment à la disponibilité en ressources dans cet habitat. En effet, la nourriture est généralement une ressource limitante pour la plupart des individus, il y a donc une corrélation négative entre la disponibilité alimentaire et le taux d'émigration (c'est-à-dire qu'on disperse plus quand les ressources diminuent). La taille des habitats potentiels d’un individu (i.e. des patchs) a aussi son importance dans la dispersion. Un petit patch subit davantage l’effet lisière (qui favorise la stochasticité environnementale) et l’effet d’apparentement ; de plus, les densités de populations y sont souvent plus élevées contribuant ainsi à la dispersion. Donc, la taille des patchs est corrélée négativement avec le taux d'émigration - car la probabilité qu'un patch soit localisé (au hasard) par un individu qui disperse dépend de la taille du patch - il est ainsi relativement plus facile de trouver un grand patch plutôt qu'un petit dans l'environnement[1].
Il est également important de considérer la connectivité entre les patchs, elle influence les interactions entre les patchs du milieu considéré et est fortement corrélée à la notion d’isolement des patchs. Le degré d'isolement d'un patch correspond à sa distance avec les autres patchs, cela se répercute fortement sur le coût de la dispersion car il peut y avoir augmentation des coûts de mouvement ou de celle du temps de voyage. La probabilité que l’individu disperse dépend de sa capacité à estimer l'isolement du patch[1]. Plusieurs méthodes permettent d’évaluer cet isolement, comme les mouvements d'exploration, la perception d’indices indiquant un habitat approprié, ou le transfert d'informations entre les individus. Le degré de connectivité des patchs influence l’apparition de métapopulations : s'ils sont trop éloignés les populations n’interagiront pas suffisamment, s’ils sont trop proches elles seront assimilables à une seule population. Il en est de même pour les métacommunautés, mais la dispersion se fait alors entre plusieurs communautés (c’est-à-dire un ensemble d’individu d’espèces différentes interagissant dans un même lieu, au même moment).
Selon certains modèles théoriques, les variabilités temporelle et spatiale de la qualité de l'habitat sont une cause majeure de la dispersion[4]. La qualité du patch peut varier dans le temps (variations entre des mauvaises et des bonnes années) et alors influencer la dispersion. Dans ce cas, la dispersion peut être considérée comme une stratégie de bet-hedging (stratégie de minimisation des risques) car elle réduit la variance de la fitness. L'hétérogénéité spatiale agit également sur la dispersion ; en effet, les patchs de meilleure qualité seront plus sujets à l’immigration des individus. Lorsque l’hétérogénéité est faible, les individus dispersent en moyenne plus loin afin de trouver un patch significativement meilleur. Cette théorie de la dispersion en fonction de la variabilité de la qualité de l'habitat a notamment été observée avec des salamandres Gyrinophilus porphyriticus. Il est important de souligner le fait qu’il existe une diversité des environnements (terrestres, aériens, marins, dulcicoles…), chacun possède des caractéristiques propres et conduit à des modes de dispersion différents. Par exemple, le milieu terrestre est souvent hétérogène et parsemé d'obstacles à la dispersion, tandis que les milieux aérien et aquatique sont plus homogènes et facilitent la dispersion par le biais des courants (vent, courants d'eau). Pour les milieux dulcicoles la dispersion se fait généralement de l'amont vers l'aval[5].
Effets de la densité
La densité correspond au nombre d’individus présents dans un patch donné (i.e. l’unité d’habitat constituant une unité écologique fonctionnelle). Une densité élevée est synonyme de compétition : elle entraîne une baisse de la fitness individuelle (ou valeur sélective : survie et taux de reproduction) et constitue une force essentielle de la dispersion. Cette compétition se décompose en deux sous-ensembles, la compétition d'exploitation (la quantité de ressources disponibles par habitant diminue quand la densité augmente, ce qui favorise l'émigration - sauf en cas de milieu très riche) et la compétition d'interférence (les individus sont en concurrence directe pour l’accès aux ressources). Il y a donc une relation densité-dépendante positive entre la densité et la dispersion. Dans certains cas, cette relation peut être négative, c'est-à-dire que le taux de dispersion diminue pour de fortes densités. Cela est possible lorsque les avantages à vivre en groupe dépassent les coûts de la compétition (exemple : prédation diluée, facilitation dans la recherche de nourriture ou de partenaires), on parle alors d'effet Allee : la fitness individuelle augmente avec de fortes densités de populations. Il n’existe donc pas de relation linéaire simple entre la densité et la dispersion, plusieurs facteurs fonctionnent à des densités différentes[1].
Effets de l'apparentement
L'apparentement entre individus peut être un facteur déterminant pour déclencher la dispersion. En effet, la dispersion peut ainsi être sélectionnée pour éviter la consanguinité ou la compétition entre apparentés[6]. La consanguinité est plus probable lorsque des individus apparentés restent groupés sur leur site d’origine, ils risquent de s’accoupler entre eux et donc de réduire leur succès reproducteur. La fitness est donc maximisée lorsque des individus quittent leur patch d’origine pour trouver des partenaires non apparentés ailleurs. La dispersion peut également être sélectionnée pour éviter la compétition entre apparentés ou « kin competition ». Comparée à la compétition intraspécifique, cette « kin competition » a des effets encore plus négatifs sur un individu car elle réduit sa fitness directe (celle propre à l’individu) mais aussi sa fitness indirecte (celle des apparentés)[1].
Certains modèles ont montré que le taux de dispersion augmente avec la moyenne locale d'apparentement. D’autres modèles démontrent que la compétition entre apparentés peut être suffisante pour conduire à la dispersion des individus, comme celui de Bach et al[6]. Dans ce modèle, il existe un coût lié à la dispersion qui engendre un taux de mortalité noté c. La stochasticité environnementale est représentée par des extinctions sporadiques spatio-temporelles des populations locales qui se produisent avec une probabilité notée e. Il y a découplage de la reproduction et de la compétition. Deux scénarios ont ainsi été réalisés : Scénario 1 : Après reproduction, une nouvelle génération subit la compétition locale avant de se disperser. Scénario 2 : Les individus dispersent après s'être reproduits et avant la compétition locale.
Dans le scénario 1, la dispersion ne peut pas éviter la « sib competition » (i.e. la compétition entre frères et sœurs, premier ordre de la « kin competition »), cependant ce scénario permet d'éviter la compétition entre apparentés transgénérationnels (i.e. la compétition entre parents et enfants, ordre supérieur de la « kin competition »). Au contraire, le scénario 2 permet aux juvéniles, frères et sœurs, de choisir entre émigrer ou rester (philopatrie), étant donné que la dispersion se produit avant la compétition densité-dépendante. Dans ce cas la « sib competition » est réduite, pour ceux qui dispersent comme pour ceux qui restent. La dispersion représentant un coût élevé, on peut la considérer comme de l'altruisme.
Les résultats obtenus avec ce modèle indiquent que les taux de dispersion les plus élevés apparaissent lorsque la « sib competition » peut être évitée (scénario II quand les coûts sont faibles). De plus, le risque d'extinction locale tend à favoriser la dispersion. Dans ce modèle, la « kin competition » transgénérationnelle ne semble pas affecter la dispersion.
Cependant, pour certains organismes, être apparentés et rester sur le même patch peut avoir un effet positif pour les individus via un comportement de coopération entre apparentés ; dans ce cas, la dispersion peut être contre-sélectionnée[5]. En effet, d’après la théorie d’Hamilton, les individus privilégient les comportements de coopération avec les génétiquement les plus proches d’eux car en agissant de la sorte, ils favorisent la propagation de leurs propres gènes ; on parle alors de sélection de parentèle (ou « kin selection »). Ainsi, les individus apparentés coopérant doivent rester en contact ce qui tend à contre-sélectionner la dispersion.
Stades de développement
Les coûts de dispersion varient en fonction du stade de développement des individus (stade larvaire, juvénile, adulte), ainsi certaines classes d’âges ont tendance à disperser davantage et d’autres moins. Cette différence est facilement observable lorsque l’on étudie des organismes sessiles : la forme adulte est souvent fixée, ce sont donc les premiers stades qui dispersent (œufs, graines, larves, etc.). Lorsque l’on s’intéresse à des organismes mobiles, il est plus difficile d’identifier les variations de coûts de dispersion car tous les stades sont concernés. Les différentes classes d'âge sont susceptibles d'être affectées à des degrés divers selon les pressions qui agissent sur la dispersion, comme la compétition pour l’acquisition des ressources (les plus jeunes sont souvent de moins bons compétiteurs) ou le risque de consanguinité (favorisant la dispersion des juvéniles)[1].
Taille
De manière générale, les individus de plus grande taille sont plus compétiteurs : cela constitue une pression sur les petits individus qui devraient donc avoir tendance à disperser davantage. Cependant, ceux qui dispersent ne sont pas toujours les moins compétitifs de la population, chez plusieurs espèces ce sont les grands individus qui quittent leur patch. En fait, ces individus possèdent de plus grandes réserves qui leur permettent d’entreprendre la dispersion malgré ses coûts importants, les petits individus n’ont pas l’énergie nécessaire et restent dans leur patch d’origine[7].
Sex-ratio
La dispersion peut être biaisée en faveur d’un sexe lorsque le sex-ratio est déséquilibré, la compétition intrasexuelle (c'est-à-dire au sein du même sexe) mène alors à un succès d'accouplement qui varie dans l'espace[8]. Par exemple, si le patch contient moins de femelles, alors le taux de dispersion des mâles sera plus important, ils augmentent leurs probabilités de trouver un partenaire en changeant de patch. Le sex-ratio d’un patch peut aussi résulter de plusieurs facteurs : pendant le transfert, un des sexes peut être plus sensible à l'environnement et donc posséder un risque de mortalité plus élevé, cela reflète les différences de pressions évolutives qui s’exercent sur chaque sexe lors de la dispersion. En général, la dispersion des mammifères tend à être mâle-biaisée (ce sont les mâles qui quittent le patch), et celle des oiseaux femelles-biaisée (le mâle garde son territoire d’une année sur l’autre, ce sont les femelles qui dispersent)[1].
Influence sur les métapopulations
Comme nous l’avons vu précédemment, la variabilité du milieu et la connectivité entre les patchs jouent un rôle important dans l’apparition de métapopulations. Une métapopulation est un ensemble de populations reliées entre elles génétiquement et démographiquement par les individus qui dispersent. Cette dispersion dépend de plusieurs paramètres (direction, nombre de dispersants, densité des populations) qu’on peut regrouper afin de définir des modèles[1]. Par exemple, le modèle « sources-puits » (H.R. Pulliam 1988) s’intéresse aux interactions entre deux types de populations (source et puits). Une population est dite source lorsque le nombre de naissances est supérieur à celui de morts, la compétition y est forte et conduit à de la dispersion. Les individus qui dispersent immigrent dans des populations appelées puits, où la dynamique de la population est négative (i.e. plus de morts que de naissances). Ces populations puits se maintiennent au cours du temps grâce à l’immigration des individus venant de la population source. Un autre modèle de métapopulation fréquemment utilisé est le modèle « île-continent » (R. Levins 1969). Dans ce modèle, les populations sont de tailles comparables et échangent toutes entre elles des flux d’individus, la métapopulation possède donc une forte connectivité. Dans le modèle « stepping stone »[6], seules les populations directement voisines peuvent échanger des individus, il n’y a donc pas de dispersion avec les populations éloignées. Ainsi l’apparentement entre deux populations voisines est relativement fort et tend à défavoriser la dispersion (car il y a peu d’intérêts à changer de patch). Cependant, comme nous l’avons vu dans le paragraphe sur l’effet de l’apparentement, la « kin competition » favorise la dispersion ; aussi, dans le modèle « stepping stone » il y a de la dispersion mais à un taux plus faible que dans le modèle « île-continent » où les populations proches ont plus de diversité génétique[6]. Ces modèles sont également applicables à l’échelle de métacommunautés.
La plupart des populations ont une distribution inégale, ainsi la dispersion a des effets sur la dynamique des populations locale via l’apport ou la perte d’individus[1]. En conséquence, les étapes d’émigration et d'immigration influencent les taux d'extinction (probabilité qu'une population s'éteigne) et de colonisation (probabilité que des individus s'installent avec succès dans un patch) dans un système de métapopulation. Les patchs vides sont plus sensibles à l'immigration et permettent de mesurer un taux de colonisation. Si le patch est occupé par une petite population, l’immigration peut diminuer le taux d'extinction de cette population, en effet, l’augmentation de sa densité permet une meilleure résistance face à la stochasticité démographique, on parle d' « effet sauvetage »[1]. Par conséquent, la création de couloirs de dispersion entre des populations isolées réduit le taux d’extinction. Les différentes stratégies de dispersion peuvent influencer positivement ou négativement la densité de la population. Si l’immigration est densité-dépendante positive, les patchs de densité élevée recevront plus d'immigrants que ceux de faible densité : il y a donc augmentation du taux d'extinction des petites populations[1]. On constate le phénomène inverse lorsqu'on a une immigration densité-dépendante négative. La dispersion peut donc avoir des effets stabilisateurs ou déstabilisateurs sur la dynamique de la population, on peut prévoir la stabilité du système en fonction de la densité et de la dispersion grâce à des modèles. Par exemple, on peut calculer le nombre de patchs occupés dans la métapopulation au cours du temps grâce au modèle de Richard Levins :
Avec : P = nombre de patchs occupés c = taux de colonisation e = taux d’extinction
Le nombre de patchs occupés à l’équilibre :
On peut faire plusieurs prédictions :
- la métapopulation persiste <1 (e = 0 quand tous les patchs sont occupés).
- P augmente avec la surface des patchs (car e diminue lorsque la taille des patchs augmente).
- P augmente lorsque la distance inter-patchs diminue (car c augmente).
Modalités de la dispersion
Types de dispersion
On distingue deux grandes catégories d'organismes selon leur mobilité : ceux qui sont sessiles (comme les plantes terrestres, les algues marines ou les coraux) qui ne peuvent échapper à des conditions défavorables de l'environnement que par une dispersion passive via des propagules (organes ou stade de dissémination), et ceux qui sont mobiles durant toute leur vie (comme la plupart des animaux) et qui disperse de façon active[7]. De nombreuses espèces ne se dispersent pas au hasard. Certaines peuvent par exemple se faire transporter (à un stade graine, larve[9] ou parasite) sur de longues distances via un animal plus mobile qu'elles. Le microbiote se déplace avec son hôte.
Dispersion passive
La dispersion passive est celle employée dans le cas des espèces dont les capacités de déplacement autonome sont nulles ou limitées : ce sont alors les forces extérieures qui les déplacent. Passive ne veut cependant pas dire entièrement subie, ainsi certains organismes ont évolué et développé des adaptations pour être transportés. En milieu aérien, les graines peuvent prendre différentes formes aérodynamiques comme les samares des érables (ou des frênes et des ormes) ou les akènes à aigrettes du pissenlit, c'est alors une dispersion par anémochorie ; en opposition à la barochorie lorsque la graine tombe simplement par la gravité (et profite éventuellement d'une pente)[10]. Certaines plantes ont également développé des graines capables de s'accrocher à des animaux (zoochorie) permettant leur dispersion (substance collante ou piquante entourant la graine par exemple), c’est le cas des capitules de bardane, ou des graines qui sont déplacées après un transit à travers le système digestif d'un animal (endozoochorie). Les animaux légers tels que les insectes peuvent aussi bénéficier d'un transport facilité grâce au vent lorsqu'ils sont ailés, ou grâce à des techniques comme le « ballooning » pratiqué par beaucoup d'araignées qui utilisent leur toile pour faire prise au vent et se laisser porter dans les airs sur des distances plus ou moins longues. De plus, les organismes peuvent être déplacés par le ruissellement ou les courants, comme les larves ou les gamètes d'animaux marins sessiles. De nombreuses propagules (graines, œufs, larves) se font transporter par d'autres espèces. Ainsi les oiseaux peuvent involontairement aider certains invertébrés et certains poissons ou plantes aquatiques à coloniser des milieux apparemment isolés ou fragmentés[11]. Le milieu terrestre offre à la fois un support solide, qui permet très peu de dispersion passive (en dehors des pentes), ainsi qu'un support aérien, facilitant la dispersion des propagules animales et végétales. Le milieu aquatique, quant à lui, permet la dispersion d’organismes (tels que le plancton ou les larves) ou du matériel de reproduction (gamètes, spores, etc.) grâce aux courants d’eau. Ces procédés, combinés à des événements épisodiques (tels que les tempêtes) ou à long terme (comme les changements climatiques actuels), et à la synchronisation de la reproduction, peuvent augmenter considérablement les échelles de dispersion spatiales des organismes qui se limitent aux propagules[8].
Dispersion active : la vection
La vection ou dispersion active se distingue de la dissémination qui est un transport passif et sans réelle spécificité par un organisme disséminateur[12].
La dispersion est considérée comme active lorsqu’elle implique une réelle spécificité de l'organisme disséminateur appelé vecteur. Cette forme de dispersion concerne essentiellement les animaux capables de mobilité, mais également les plantes et les champignons, ainsi que les microorganismes (bactéries, champignons unicellulaires), capables de disperser de proche en proche, par division simple (par projection de mycélium ou de stolons). La dispersion active s’effectue donc aussi bien sur de courtes distances comme sur des grandes, dans le but d’acquérir de nouvelles ressources, ou bien en fonction de la compétition inter ou intraspécifique du patch. Dans le cas des animaux non fixés, cette dispersion fait appel à une composante comportementale, avec un comportement plus aventureux ou explorateur de certains individus parfois, chez les rapaces par exemple[2]. Elle peut être le résultat de pressions environnementales, comme une densité de population trop élevée et une concurrence des ressources, un habitat trop restreint ou de mauvaise qualité, autant de contraintes qui exercent une pression de sélection sur les mécanismes de dispersion. Ce sont essentiellement des comportements orientés de marche, vol, nage, reptation, ou mécanisme provisoire de flottaison (ex chez les jeunes corbicules[13] qui vivent habituellement dans le sédiment) qui permettent la dispersion active, mais de nombreuses espèces ou propagules sont également transportées par d'autres espèces, éventuellement à longue distance. C'est ainsi que les oiseaux et d'autres animaux se déplaçant d'une zone humide[14] à l'autre ou le long de berges dispersent un nombre notable de propagules ou d'animaux adultes (ex : coquillage s'étant refermé sur l'un des doigts d'une patte d'oiseau et y est resté accroché[11], Anodonta cygnea dans un cas[15]).
Dispersion spatiale et temporelle
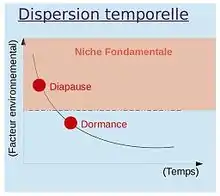
Jusqu’à présent, nous avons surtout traité de la dispersion spatiale des individus, correspondant à leurs déplacements horizontal et/ou vertical dans l'espace ; cependant il est aussi important de considérer la dispersion temporelle. Cette dernière s’effectue dans le temps, chez les organismes capable de diapause ou de dormance (graines, nématodes...). La diapause est une dispersion temporelle sélectionnée lorsque les variations de l'environnement sont prédictibles (variations cycliques, par exemple changements de saisons des climats tempérés). L'individu qui utilise la diapause passe en vie ralentie avant d'atteindre la limite de sa niche fondamentale, autrement dit avant même que les conditions du milieu lui soient défavorables. C'est donc une dispersion préventive. La dormance est une dispersion temporelle conséquentielle (à la suite d'une modification de l'environnement), qui se produit lors de changements imprévisibles des conditions de l'environnement. L'individu passe la limite de sa niche fondamentale avant de se mettre en dormance, donc il passe en vie ralentie après que les conditions aient changé, il n’y a pas d’anticipation. Certaines graines ont des temps de dormance impressionnant allant jusqu'à 1700 ans. Certains œufs d'insectes utilisent des processus similaires.
Dispersion au cours de la vie
Le stade de développement propice à la dispersion diffère selon les organismes. On différencie la dispersion de reproduction, qui est le mouvement entre deux sites de reproduction, et la dispersion de naissance, correspondant au mouvement entre le site de naissance et le site de première reproduction.
La dispersion natale désigne la distance normalement activement ou passivement parcourue durant les stades jeunes, parfois en dormance, des individus d'une espèce, entre leur site de « naissance » et leur premier site de reproduction. Cette distance peut être très importante (milliers de km chez certaines espèces de cétacés, anguille ou oiseaux migrateurs par exemple). Ce mode de dispersion est employé par des animaux, et est notamment indispensable aux animaux sessiles au stade adulte, tous aquatiques et souvent marins, comme les spongiaires, les ectoproctes, certains cnidaires (formes polypes ou coralliennes, anémones de mer…), certains mollusques (bivalves) ou encore les tuniciers. Chez ceux-ci la dispersion natale peut être précédée d'une dispersion des gamètes puisque la fécondation chez certains de ces organismes se produit dans l'eau. Pour d'autres, comme les polypes (cnidaires), on peut observer une alternance des générations avec un bourgeonnement de formes libres (méduses). La dispersion natale est également nécessaire à certains plathelminthes, dont les stades larvaires (cercaires par exemple) doivent rechercher activement l'hôte indispensable pour boucler leur cycle de vie, ou également pour la dispersion via des milieux inhospitaliers (résistance à la dessiccation, etc.). L'exploration de l'habitat à la recherche du lieu de vie le plus favorable à la reproduction est un cas de dispersion natale, observée par exemple chez des oiseaux comme la mésange charbonnière ou le busard cendré, et qui améliore la valeur sélective des individus dispersant[2]. Chez les amphibiens, une première dispersion peut avoir lieu dans l'eau (faible en général dans le cas des eaux stagnantes), puis le jeune individu sort de l'eau et se disperse dans le paysage activement (et exceptionnellement passivement : emporté par une crue, un cours d'eau...). De même l'anguille et certains poissons peuvent accomplir l'essentiel de leur dispersion dans l'eau, mais en sortir et ramper sur le sol pour trouver un point de reproduction ou un lieu de vie plus éloigné du cours d'eau qu'ils ont quitté (et inversement). De nuit, et parfois de jour, certaines espèces aquatiques sont même capables d'escalader des dizaines à centaines de mètres de parois verticales (Trois espèces de poissons et une espèce de crevettes à Hawaï le font, mais des "phénomènes" de ce type ont aussi été découverts en Islande, en Nouvelle-Zélande, en Thaïlande, au Venezuela au Japon et à Porto Rico. Ainsi à Hawaï, chaque année, en se servant de leur bouche et nageoires, et faisant une ventouse de leur face ventrale des milliers de petits gobies amphidromes des espèces Lentipes concolor, Awaous guamensis ou Sicyopterus stimpsoni escaladent lentement de hautes parois verticales humides pour gagner leur habitat. Si l'on rapporte à la taille de ces poissons (7 cm) la hauteur des parois (5000 fois la longueur de son corps) qu'il doit escalader, elle correspondrait à la hauteur de l'Everest pour un homme[16]. Selon un spécialiste de ces espèces (Richard Blob, Université de Caroline du Sud à Clemson), tous les gobies disposent d'une sorte de ventouse ventrale qui leur permet de se fixer dans les zones de fort courant, mais la bouche de S. stimpsoni a évolué pour former une seconde ventouse qui l'aide à escalader des parois verticales. D'autres poissons disposent d'une puissante ventouse buccale (lamproie par exemple), mais A. guamensis en n'utilisant que la pseudo-ventouse qu'il forme avec ses nageoires pectorales et en se propulsant par petites avancées successives au moyen de puissants et rapides battements de queue "grimpe" 30 fois plus vite que S. stimpsoni. Chez ces espèces seul un petit pourcentage de la population arrive à destination. Ces migrations verticales pourraient avoir un intérêt en matière de sélection naturelle, en permettant aux individus qui arrivent à destination de trouver des zones dépourvues de leurs prédateurs habituels.
Chez certaines plantes, algues et champignons, le début de dispersion, souvent effectuée sous forme de spores ou de graines de toutes sortes, est fréquemment assuré par l'eau ou le vent, de manière passive. La dispersion par le vent et la zoochorie permet aussi d'éviter que les flux de gènes et de propagules soient toujours "descendants" vers la mer ou le bas des bassins-versants.
Stratégies de recherche et indices de l’habitat
Les stratégies de recherche peuvent être de type aléatoire (à dominante passive) ou exploratoire (à dominante active). Une des approches consiste à modéliser le mouvement de l’individu comme un déplacement aléatoire : le chemin d'un organisme est décomposé selon la longueur et les angles de rotation de ses déplacements et permet d'accéder à sa vitesse de déplacement. Mais souvent la direction du premier mouvement influence souvent celle du prochain, il n’y aurait donc pas de déplacement totalement aléatoire[1].
Pendant le mouvement entre les parcelles, l'individu peut utiliser des indices[1] pour identifier la direction et la proximité de l'habitat approprié ce qui peut réduire le temps de recherche et potentiellement augmenter le succès de la dispersion. Les systèmes de détection des indices peuvent fournir des informations sur la qualité d'une parcelle inconnue. La capacité à détecter des signaux environnementaux (par exemple grâce à l’olfaction, la vision chez les animaux, ou l'humidité et la température pour les graines) varie entre les espèces, ainsi que le type de renseignements analysés. La gamme de perception d'un organisme, c'est-à-dire les indices qui peuvent être détectés et la distance à laquelle ils le sont, détermine l'importance de chaque indice dans les mouvements inter-patchs. D’autres indices, non détectables à distance, ne pouvant être perçus qu'une fois le patch localisé, peuvent également être utilisés au moment de l'immigration. Une stratégie d'attraction de la même espèce peut être adaptative si les individus reçoivent des avantages directs à la présence de congénères, comme risque de prédation diluée par exemple. Au contraire, la présence de congénères peut générer des coûts à haute densité de population en cas de concurrence[1].
Évolution de la dispersion
Comme on l'a vu plus haut, la dispersion est un processus important pour la survie des espèces et des populations. Le phénomène de vicariance est la séparation d'une population ancestrale en plusieurs populations à la suite d'un isolement génétique et ou géographique suffisamment long empêchant toute dispersion entre deux populations. Ces deux processus sont un moteur important de la spéciation (deux espèces nouvelles apparaissent à partir d'une même espèce ancestrale), il n’est donc pas étonnant que la dispersion évolue au cours du temps.
Effets anthropiques
De nos jours, les activités humaines ont beaucoup d'impacts sur les populations notamment via la perte de l'habitat et sa fragmentation, mais aussi les changements climatiques globaux. Depuis l'essor des échanges mondiaux, on assiste également à une explosion du nombre d'espèces invasives (souvent à forte capacité de dispersion). Certains travaux tentent d'ailleurs de comprendre leur fonctionnement en observant des milieux défavorables à leur installation. Ainsi, les sociétés humaines permettent à certaines espèces d'augmenter notablement leur capacité mais surtout leur distance de dispersion alors qu'au contraire elles privent de nombreuses espèces de cette possibilité de disperser en rendant le milieu infranchissable. Comprendre la dispersion est donc au cœur de nombreux travaux notamment dans le domaine de la conservation, où des techniques, comme la restauration de la connectivité par des corridors écologiques ou des migrations assistées d'espèces, tentent de reconstruire des milieux propices à la survie des populations sur le long terme. Néanmoins les solutions proposées ne marchent pas toujours dans le sens attendu : les corridors peuvent en effet faciliter l'arrivée de nouveaux prédateurs pour des individus d'une population isolée et induire un effet négatif plutôt que bénéfique.
Mise en évidence de l'évolution de la dispersion in vitro
Chez beaucoup d'individus on a un processus de dispersion au moins à un stade du cycle de vie. Pour certaines espèces, certains facteurs modifient la capacité à disperser au cours du temps. Il est difficile de mettre en évidence les traits à l'origine de l'émergence d'individus dispersant. Souvent, les individus dispersant possèdent des caractéristiques leur permettant d'effectuer une dispersion soit de plus grande ampleur, soit à moindre coût que les individus résidents.
Une étude réalisée sur Caenorhabditis elegans, un vers à cycle de vie court, est l'une des premières à simuler à courte échelle de temps et in vitro le processus d'évolution de la dispersion des individus dans des microcosmes hétérogènes. Les auteurs ont réalisé trois types d'expériences et constaté plusieurs phénomènes[17].
Premièrement, lorsque les extinctions sont fréquentes et aléatoires dans les patchs, il y a augmentation du taux des individus qui dispersent mieux. La sélection est par contre fortement favorable à un génotype plus fécond de C. elegans par rapport à un génotype avec un plus fort taux de dispersion dans des microcosmes où il n'y a qu'un type de nourriture dans tous les patchs. L'ajout d'un deuxième type de patch avec une nourriture différente n'a pas effet sur ce résultat, ce qui suggère que la dispersion entre patchs n'avait pas de coût ou d'avantage dans ce système particulier. La dispersion est susceptible d'être coûteuse dans la nature, ce qui diminue le taux de dispersion à l'ESS (stratégie évolutivement stable). Cependant, dans l'expérience, les microcosmes étaient des environnements favorables et la distance entre les parcelles était de petite taille (<2,5 cm).
Deuxièmement, en faisant varier la densité de ressources (fitness intrinsèque des patchs) plutôt que la fitness extrinsèque via des survies variables, on observe qu'il n'y a pas d'augmentation significative de la fréquence du génotype à forte capacité de dispersion. Une variation de la densité de ressources conduit à une modification dans le comportement des deux génotypes, il y a augmentation puis homogénéisation de leurs tendances à se déplacer entre les parcelles.
Enfin, si on a une forte différence de fitness entre les individus des différents patchs, on voit la propension à la dispersion augmenter dans la population.
Cette expérience illustre que lévolution rapide de la dispersion nécessite à la fois la présence de la variation génétique héréditaire pour les caractères qui affectent le comportement de dispersion, ainsi qu'une forte action de sélection sur ces traits. Par ailleurs on peut noter qu'on illustre ici un trade-off fréquent entre dispersion et reproduction (fécondité).
Influence des gènes dans la mise en place d'adaptation à la dispersion
Dans beaucoup de populations naturelles, il existe un potentiel de dispersion pouvant changer avec l'environnement de l'individu. L'évolution de la dispersion peut s'observer à court terme en milieu naturel dans le cas de successions écologique, d'invasions biologiques, d'îles volcaniques ou encore de fragmentation de l'habitat.
Les espèces possèdent souvent une variabilité génétique conduisant à des adaptations pour la dispersion. Ainsi chez certaines espèces de coléoptères, les différentes formes de l'aile sont contrôlées par un gène unique comportant deux allèles. De même, la proportion d'individus macroptères (possédant de longues ailes servant à la dispersion) ou microptères (ailes courtes qui ne permettent pas la dispersion) dans des populations de grillon peut très vite varier dans les différentes populations en fonction de la densité en prédateur, de la stabilité de l'habitat ou de la taille de la population. Or la macroptérie est bien sous contrôle génétique.
Une expérience réalisée sur Arabidopsis thaliana a d'ailleurs permis de quantifier comment l'héritabilité de traits phénotypiques se traduisait dans l'héritabilité des stratégies de dispersion[18]. Les auteurs ont également cherché à comprendre les facteurs affectant ces stratégies de dispersion en manipulant la densité de population. On trouve que la variabilité génétique pour la dispersion est en grande partie due à des variations environnementale et génétique exprimées de façon densité dépendante pour des traits maternelles affectant la dispersion. Par exemple, les résultats montrent que l'héritabilité de nombreux traits maternels pour la dispersion est plus forte lorsque les plantes poussent dans des conditions de densité faible. Dans des conditions de forte densité les plantes seront ainsi plus petites, auront moins de fruits et de branches et pourront de fait disperser moins loin.
D'autres plantes capables de produire des graines dispersantes ou non peuvent ajuster la proportion de ces différentes graines en fonction de leur environnement.
Exemple : dispersion des amphibiens
Hormis quelques espèces, les amphibiens sont à la fois caractérisés par une grande spécificité d’habitat, une distribution en taches et une dépendance physiologique à un certain type de milieu humide[19]. Leur dépendance à l'eau (au moins en phase œuf et larvaire) leur confère une capacités migratoire réputée limitée, et souvent dépendante de réseaux de ruisseaux, fossés, mares ou points d'eau temporaires, permettant une migration ou dispersion spatiotemporelle "en pas japonais" et non dans un corridor de dispersion qui serait une continuité physique (comme la rivière l'est pour les poissons). De plus, les larves sont particulièrement vulnérables à la prédation et à la dessiccation quand elles sortent de l'eau pour leur dispersion terrestre[19],[20],[21],[22], d'autant que leur déplacement est plutôt lent comparé à ceux des aux autres petits tétrapodes[22],[21].
Une étude bibliographique (Smith & Green) (2005) ayant porté sur 166 articles scientifiques concernant la distance maximale parcourue par 90 espèces d’amphibiens, a conclu que ;
- 44 % des espèces ne dispersent pas plus de 400 m ;
- seules 5 % sont capables de montrer des distances de dispersion maximales supérieures à 10 km ;
- 94 % des distances maximales de dispersion des urodèles sont inférieures à 1 km dont 64 % ne dépassent pas 400 m. Seules 2 % des espèces montrent une dispersion maximale supérieure à 10 km ;
- des migrants occasionnels (individus aventuriers) connecteraient néanmoins les populations plus éloignées, séparées parfois de dizaines de kilomètres) ;
- Les amphibiens sont souvent très fidèles à leur site de ponte[23], qui est souvent le site où ils sont nés[19]. Ils se montrent souvent capables de retrouver leur site de ponte, même après avoir été déplacés à des distances significatives : « 38 % des 747 individus de tritons Taricha rivularis déplacés de 4 km sont retournés à leur site de ponte l’année même »[24]. Les suivis par capture-marquage-recapture ont permis de retrouver sur le même site d'une année la plupart des amphibiens qui y étaient l'année précédente[23].
- Dans un même paysage, différentes espèces d'amphibiens n'ont pas les mêmes capacités de dispersion.
Les salamandres pléthodontidés sont particulièrement peu mobiles : elles sont génétiquement parmi les moins différenciées au sein du monde animal étudié de ce point de vue[25],[26],[27]
En montagne Ambystoma tigrinum melanostictum, Spear et al. 2005 semble se déplacer facilement alors que Mesotriton alpestris peine à entretenir sa diversité génétique, Pabijan & Babik 2006). En réalité, la situation est plus complexe, avec le constat d'un certain polymorphisme (probabilité d’homoplasie) et une hétérozygotie élevée associés à certains microsatellites (ex : des microsatellites à 58 et 71 allèles chez Mesotriton alpestris)[28],[29],[30] ; Deux espèces d'anoures coévoluant dans une même région présentent parfois des structures de populations très différentes (ex : flux de gènes plus important chez la grenouille rousse Rana temporaria que chez le crapaud commun Bufo bufo pourtant parfois capable de longs déplacements[31] ; - Bien que ce soient des espèces à phase de vie larvaire aquatique, un cours d'eau de 5 à 7 mètres de large semble infranchissable par les salamandres rayées Plethodon cinereus alors que le triton japonais Hynobius nebulosus n'est pas gêné par le morcellement de son territoire par de nombreux petits cours d'eau[32] ;
- l'intensification de l'agriculture transforme des paysages autrefois favorables aux amphibiens en paysage défavorables. On a ainsi montré[33] que nombre d'amphibiens évitent les champs cultivés et les pâtures intensives (démontré chez le crapaud calamite Bufo calamita en milieu contrôlé[34] ;
- Le relief modèle aussi la génétique : les flux se font mieux dans les plaines[35], rendant les populations génétiquement et morphologiquement plus homogènes alors que les populations sont plus différentiées dans le haut des bassins versants[36],[37],[38],[39],[40]. Cependant en vallée alluviale les crues produisent des dispersions passives[41],[42], plantes[43], copépodes (Frisch et al. 2005), gastéropodes[44] ou encore larves d’insectes (Jackson et al. 1999) ou d'amphibiens (ex : têtards du crapaud alyte de Majorque ; Alytes muletensis sont-ils emportés par les crues[45], mais ces crues sont parfois suivies d'épisodes d'assèchement qui imposent un nouveau pattern de répartition à celles de ces espèces qui sont le plus dépendante de l'eau ;
- les bandes enherbées rivulaires ou la ripisylve formant corridor riparien favorisent, s'il est riche en pièces d'eau la reproduction mais aussi la migration des amphibiens[19], par exemple pour la salamandre à longs doigts Ambystoma macrodactylum le long de la Bull River[37] ;
- Les études de polymorphisme allozymique montrent que les amphibiens ont des populations génétiquement plus resserrées que la plupart des autres taxons animaux (parfois pour des populations séparées de quelques mètres seulement), avec aussi quelques exceptions ou preuves de mouvements se faisant plus loin que ce que l'on croyait possible[46], conduisant parfois à des flux de gènes élevés dans certaines populations ou espèces[36],[47],[48],[38]. La différenciation génétique peut donc être trouvée à l’échelle de quelques dizaines de mètres (ex : chez deux populations de Plethodon cinereus distantes de seulement 200 m[49] à quelques centaines de kilomètres (ex pour Mesotriton alpestris séparées par 349 km[38]. Des données plus précises sont attendues d'études basées sur des locus microsatellites.
- Un effet fondateur doit être pris en compte, par exemple pour les populations locales issues d'un même refuge glaciaire. Dans ce cas, il est normal de trouver une faible diversité génétique et peu de différenciation entre populations[38] ;
- Sauf dans quelques cas[50],[47],[51],[52],[53],[54],[55], les chercheurs ont étudié de petites sous-populations (de pléthodontidés par ex Cabe et al. 2007; Noël et al. 2007; White et al. 2000) et rarement des métapopulations ; le fonctionnement global et à long terme de ces dernières est mal connu[56], mais un constat partagé est celui de la régression rapide des amphibiens sur toute la planète depuis la fin du XXe siècle[57],[58].
Voir aussi
Articles connexes
Bibliographie
- Bach, L.A., Thomsen, R., Pertoldi, C. & Loeschcke, V. (2006) Kin competition and the evolution of dispersal in an individual-based model. Ecological modelling, 192, 658-666.
- Baguette, M., Blanchet, S., Legrand, D., Stevens, V.M. & Turlure, C. (2013) Individual dispersal, landscape connectivity and ecological networks. Biological Reviews, 88, 310–326.
- Bilton, D.T., Freeland, J.R. & Okamura, B. (2001) Dispersal in freshwater invertebrates. Annual Revue of Ecology and Systematics, 32, 159–181
- Boag, D.A. (1986) Dispersal in pond snails: potential role of waterfowl. Canadian Journal of Zoology, 64, 904–909.
- Bohonak, A.J. & Jenkins, D.G. (2003) Ecological and evolutionary significance of dispersal by freshwater invertebrates. Ecology Letters, 6, 783–796.
- Bowler, D.E. & Benton, T.G. (2005) Causes and consequences of animal dispersal strategies: relating individual behaviour to spatial dynamics. Biological Reviews, 80, 205–225.
- Boyd, H. & Pirot, J.Y., ed. (1989) Flyways and reserve networks for water birds. IWRB, Slimbridge.
- Cáceres, C.E. & Soluk, D.A. (2002) Blowing in the wind: a field test of overland dispersal and colonization by aquatic invertebrates. Oecologia, 131, 402–408 (Résumé).
- Charalambidou, I. & Santamaría, L. (2002) Waterbirds as endozoochorous dispersers of aquatic organisms: a review of experimental evidenc. Acta Oecologica, 23, 165–176.
- Charalambidou, I., Santamaría, L., Jansen, C. & Nolet, B. (In press). Digestive plasticity in ducks modulates dispersal probabilities of aquatic plants and crustaceans. Functional Ecology.
- Charalambidou, I., Ketelaars, H.A.M. & Santamaría, L. (2003) Endozoochory by ducks: influence of developmental stage of Bythotrephes diapause eggs on dispersal probability. Diversity and Distributions, 9, 367–374.
- Charalambidou, I., Santamaría, L. & Figuerola, J. (2003b) How far can the freshwater Bryozoan Cristatella mucedo disperse in duck guts? Archiv für Hydrobiologie, 157, 547–554.
- (en) J. Clobert, E. Danchin, A.A Dhondt & J.D. Nichols, Dispersal, Oxford University Press, , 452 p..
- Cohen, G.M. & Shurin, J.B. (2003) Scale-dependence and mechanisms of dispersal in freshwater zooplankton. Oikos, 103,603–617.
- Donohue, K., Polisetty, C.R. & Wender, N.J. (2005) Genetic basis and consequences of niche construction: plasticity-induced genetic constraints on the evolution of seed dispersal in Arabidopsis thaliana.The American Naturalist, 165, 537–50.
- Dzialowski, A.R., O’Brien, W.J. & Swaffar, S.M. (2000) Range expansion and potential dispersal mechanisms of the exotic cladoceran Daphnia lumholtzi. Journal of Plankton Research, 22, 2205–2223.
- Figuerola, J. & Green, A.J. (2002a) Dispersal of aquatic organisms by waterbirds: a review of past research and priorities for future studies. Freshwater Biology, 47, 483–494.
- Figuerola, J. & Green, A.J. (2002b) How frequent is external transport of seeds and invertebrate eggs by waterbirds? A study in Doñana, SW Spain. Archiv für Hydrobiologie, 155, 557–565.
- Figuerola, J. & Green, A.J. (In press). Effects of premigratory fasting on potential for long distance dispersal of seeds by waterfowl: an experiment with Marbled Teal. Revue d’Ecologie, Terre et Vie.
- Figuerola, J., Green, A.J. & Michot, T.C. (2005) Invertebrate eggs can fly: evidence of waterfowl mediated gene-flow in aquatic invertebrates. American Naturalist, 165, 274–280.
- Friedenberg, N.A. (2003) Experimental evolution of dispersal in spatiotemporally variable microcosms. Ecology Letters, 6, 953–59.
- Green, A.J. & Figuerola, J. (2005) Recent advances in the study of long-distance dispersal of aquatic invertebrates via birds. Diversity and Distributions 11: 149-156.
- Green, A.J., Figuerola, J. & Sánchez, M.I. (2002b) Implications of waterbird ecology for the dispersal of aquatic organisms. Acta Oecologica, 23, 177–189.
- Green, A.J., Sánchez, M.I., Amat, F., Figuerola, J., Hontoria, F., Ruiz, O. & Hortas, F. (2005) Dispersal of invasive and native brine shrimps Artemia (Anostraca) via waterbirds. Limnology and Oceanography, 50, 737–742
- Guisan, A. & Thuiller, W. (2005) Prédicting species distribution: offering more than simple habitat models. Ecology Letters, 8, 993-1009.
- Havel, J.E. & Stelzleni-Schwent, J. (2000) Zooplankton community structure: the role of dispersal. Verhandlungen der Internationalen Vereinigung für theoretische und Angewandte Limnologie, 27, 3264–3268.
- Jarnagin, S.T., Swan, B.K. & Kerfoot, W.C. (2000) Fish as vectors in the dispersal of Bythotrephes cederstroemi: diapausing eggs survive passage through the gut. Freshwater Biology, 43, 579–589.
- Jenkins, D.G., Brescacin, C.R., Duxbury, C.V. & al. (2007) Does size matter for dispersal distance? Global Ecology and Biogeography, 16, 415-425.
- Jenkins, D.G. & Underwood, M.O. (1998) Zooplankton may not disperse readily in wind, rain, or waterfowl. Hydrobiologia, 387/388, 15–21.
- Kinlan, B.P. & Gaines, S.D. (2003) Propagule dispersal in marine and terrestrial environments: a community perspective. Ecological Society of America, 4, 2007-2020.
- Lowe, W.H. (2009) What drives long-distance dispersal? A test of theorical predictions. Ecology, 90, 1456-1462.
- Maguire, B. Jr (1959) Passive overland transport of small aquatic organisms. Ecology, 40, 312.
- Maguire, B. Jr (1963) The passive dispersal of small aquatic organisms and their colonization of isolated bodies of water. Ecological Monographs, 33, 161–185.
- Malone, C.R. (1965) Killdeer (Charadrius vociferus Linnaeus) as a means of dispersal for aquatic gastropods. Ecology, 46, 551–552.
- de Meester, L., Gómez, A., Okamura, B. & Schwenk, K. (2002) The monopolization hypothesis and the dispersal-gene flow paradox in aquatic organisms. Acta Oecologica, 23, 121–135.
- Mellors, W.K. (1975) Selective predation of ephippial Daphnia and the resistance of ephippial eggs to digestion. Ecology, 56, 974–980.
- Mooney, H.A. & Cleland, E.E. (2001) The evolutionary impact of invasive species. Proceedings of the National Academy of Sciences of the United States of America, 98, 5446–5451.
- Nathan, R. & Muller-Landau, H.C. (2000) Spatial patterns of seed dispersal, their determinants and consequences for recruitment. Trends in Ecology and Evolution, 15, 278–285.
- Nathan, R., Sapir, N., Trakhtenbrot, A., Katul, G.G., Bohrer, G., Otte, M., Avissar, R., Soons, M.B., Horn, H.S., Wikekski, M. & Levin, S.A. (2005) Long-distance biological transport processes through the air: can nature’s complexity be unfolded in silico? Diversity and Distributions, 11, 131–137.
- Nathan, R. (2003). Seeking the secrets of dispersal. Trends in Ecology & Evolution 18, 275e276
- Nathan R. (2001) The challenges of studying dispersal. TREE 16: 481-483.
- Nogales, M., Delgado, J.D. & Medina, F.M. (1998) Shrikes, lizards and Lycium intricatum (Solanaceae) fruits: a case of indirect seed dispersal on an oceanic island (Alegranza, Canary Islands). Journal of Ecology, 86, 866–871.
- Okamura, B. & Freeland, J.R. (2002) Gene flow and the evolutionary ecology of passively dispersing aquatic invertebrates. Dispersal ecology (ed. by J.M. Bullock, R.E. Kenward and R.S. Hails), p. 194–216. Blackwell Science, Oxford.
- Watkinson, A.R. & Gill, J.A. (2002) Climate change and dispersal. Dispersal ecology (ed. by J.M. Bullock, R.E. Kenward and R.S. Hails), p. 194–216. Blackwell Science, Oxford.
- Wesselingh, F.P., Cadée, G.C. & Renema, W. (1999) Flying high: on the airborne dispersal of aquatic organisms as illustrated by the distribution histories of the gastropod genera Tryonia and Planorbarius. Geologie En Mijnbouw, 78, 165–174.
- WILLSON, M.F. (1992), The ecology of seed dispersal. In: Fenner, M. (ed.): Seeds – the ecology of regeneration in plant communities. CAB International, Wallingford,
61–85.
- WILLSON, M.F. (1993), Dispersal mode, seed shadows, and colonization patterns. Vegetatio 107/108: 261-280
Références
- Bowler, D.E. & Benton, T.G. (2005) Causes and consequences of animal dispersal strategies: relating individual behaviour to spatial dynamics. Biological Reviews, 80, 205–225.
- [PDF] (fr) Vincent Lecoustre et Vincent Bretagnolle, « Importance du comportement d’exploration dans le processus de dispersion natale chez un rapace », Centre d'Études Biologiques de Chizé,
- Stéphanie Manel1, Michael K. Schwartz, Gordon Luikart, Pierre Taberlet, Landscape genetics: combining landscape ecology and population genetics ; Trends in Ecology & Evolution Volume 18, Issue 4, April 2003, Pages 189-197 doi:10.1016/S0169-5347(03)00008-9 (résumé)
- Lowe, W.H. (2009) What drives long-distance dispersal? A test of theorical predictions. Ecology, 90, 1456-1462.
- Baguette, M., Blanchet, S., Legrand, D., Stevens, V.M. & Turlure, C. (2013) Individual dispersal, landscape connectivity and ecological networks. Biological Reviews, 88, 310–326.
- Bach, L.A., Thomsen, R., Pertoldi, C. & Loeschcke, V. (2006) Kin competition and the evolution of dispersal in an individual-based model. Ecological modelling, 192, 658-666.
- Jenkins, D.G., Brescacin, C.R., Duxbury, C.V. & al. (2007) Does size matter for dispersal distance? Global Ecology and Biogeography, 16, 415-425.
- Kinlan, B.P. & Gaines, S.D. (2003) Propagule dispersal in marine and terrestrial environments: a community perspective. Ecological Society of America, 4, 2007-2020.
- Andy J Green Andy J Green Marta I Sánchez Marta I Sánchez (2016) Passive internal dispersal of insect larvae by migratory birds ; Biology letters Avril 2006 (résumé)
- Guisan, A. & Thuiller, W. (2005) Prédicting species distribution: offering more than simple habitat models. Ecology Letters, 8, 993-1009.
- (en) Andy J. Green et Jordi Figuerola, « Recent advances in the study of long-distance dispersal of aquatic invertebrates via birds », Diversity and Distributions, vol. 11, no 2, , p. 149-156 (lire en ligne [PDF])
- Nicolas Sauvion, Paul-André Calatayud, Denis Thiéry et Frédéric Marion-Poll, Interactions insectes-plantes, éditions Quæ, (lire en ligne), p. 513
- Prezant RS & Chalermwat K (1984) Flotation of the bivalve Corbicula fluminea as a means of dispersal. Science, 225, 1491-1493. PDF, 3 pp
- Amezaga, J.M., Santamaría, L. & Green, A.J. (2002) Biotic wetland connectivity — supporting a new approach for wetland management policy. Acta Oecologica, 23, 213–222.
- Adams LE. 1905. A plover with Anodonta cygnea attached to its foot. J. Conchol. 11: 175
- The amazing rock-climbing gobies, consulté 2013-08-25
- Friedenberg, N.A. (2003) Experimental evolution of dispersal in spatiotemporally variable microcosms. Ecology Letters, 6, 953–59.
- Donohue, K., Polisetty, C.R. & Wender, N.J. (2005) Genetic basis and consequences of niche construction: plasticity-induced genetic constraints on the evolution of seed dispersal in Arabidopsis thaliana.The American Naturalist, 165, 537–50.
- Duellman WE, Trueb L (1994) Biology of Amphibians. The Johns Hopkins University Press, Baltimore
- Rothermel BB(2004) Migratory success of juveniles: A potential constraint on connectivityfor pond-breeding amphibians. Ecological Applications, 14, 1535-1546
- Rothermel BB, Semlitsch RD (2002) An experimental investigation of landscape resistance offorest versus old-field habitats to emigrating juvenile amphibians. Conservation Biology,16, 1324-1332.
- Sinsch U (1990) Migration and orientation in anuran amphibians. Ethology Ecology & Evolution, 2, 65-79.
- Gamble LR, McGarigal K, Compton BW (2007) Fidelity and dispersal in the pond-breeding amphibian, Ambystoma opacum: Implications for spatio-temporal population dynamics and conservation. Biological Conservation, 139, 247-257.
- Twitty VC, Grant D, Anderson O (1967) Long distance homing in the newt, Taricha rivularis. Proceeding of the National Academy of Sciences USA, 50, 51-58
- Highton R (1977) Comparisons of microgeographic variation in morphological and electrophoretic traits. Evolutionary Biology, 10, 397-436
- Larson A, Wake DB, Yanev KP (1984) Measuring gene flow among populations having high levels of genetic fragmentation. Genetics, 106, 293-308
- Wright S (1978) Evolution and the Genetics of Populations: Vol. 4, Variability within and among Natural Populations. University of Chicago Press, Chicago
- Hedrick PW (1999) Perspective: Highly variable loci and their interpretation in evolution and conservation. Evolution, 53, 313-318
- Lemaire C, Allegrucci G, Naciri M, Bahri-Sfar L, Kara H, Bonhomme F (2000) Do discrepancies between microsatellite and allozyme variation reveal differential selection between sea and lagoon in the sea bass (Dicentrarchus labrax) ? Molecular Ecology, 9, 457-467
- O'Reilly PT, Canino MF, Bailey KM, Bentzen P (2004) Inverse relationship between FST and microsatellite polymorphism in the marine fish, walleye pollock (Theragra chalcogramma): Implications for resolving weak population structure. Molecular Ecology, 13, 1799-1814.
- Brede EG, Beebee TJC (2004) Contrasting population structures in two sympatric anurans : Implications for species conservation. Heredity, 92, 110-117
- Matsui M, Nishikawa K, Utsunomiya T, Tanabe S (2006) Geographic allozyme variation in the Japanese clouded salamander, Hynobius nebulosus (Amphibia: Urodela). Biological Journal of the Linnean Society, 89, 311-330
- Gibbs JP (1998) Distribution of woodland amphibians along a forest fragmentation gradient. Landscape Ecology, 13, 263-268.
- Stevens VM, Leboulengé E, Wesselingh RA, Baguette M (2006a) Quantifying functional connectivity: experimental assessment of boundary permeability for the natterjack toad (Bufo calamita). Oecologia, 150, 161-171
- Chan LM, Zamudio KR (2009) Population differentiation of temperate amphibians in unpredictable environments. Molecular Ecology, 18, 3185-3200
- Funk WC, Blouin MS, Corn PS, Maxell BA, Pilliod DS, Amish S, Allendorf FW (2005) Population structure of Columbia spotted frogs (Rana luteiventris) is strongly affected by the landscape. Molecular Ecology, 14, 483-496
- Giordano AR, Ridenhour BJ, Storfer A (2007) The influence of altitude and topography on genetic structure in the long-toed salamander (Ambystoma macrodactulym). Molecular Ecology, 16, 1625-1637.
- Pabijan M, Babik W (2006) Genetic structure in northeastern populations of the Alpine newt (Triturus alpestris): Evidence for post-Pleistocene differentiation. Molecular Ecology, 15, 2397-2407.
- Spear SF, Peterson CR, Matocq MD, Storfer A (2005) Landscape genetics of the blotched tiger salamander (Ambystoma tigrinum melanostictum). Molecular Ecology, 14, 2553- 2564.
- Zamudio KR, Wieczorek AM (2007) Fine-scale spatial genetic structure and dispersal among spotted salamander (Ambystoma maculatum) breeding populations. Molecular Ecology, 16, 257-274
- Burridge C, Craw D, Waters J (2006) River capture, range expansion, and cladogenesis: the genetic signature of freshwater vicariance. Evolution, 60, 1038–1049
- Hernandez-Martich JD, Novak JM, Smith MH, Johns PE (1995) Genetic structure of mosquitofish populations in the Altamaha and Ogeechee drainages of Georgia: Reporting an undescribed form in the Ocmulgee River. Biochemical Systematics and Ecology, 23, 617-625.
- Thomas JR, Middleton B, Gibson DJ (2006) A landscape perspective of the stream corridor invasion and habitat characteristics of an exotic (Dioscorea oppositifolia) in a pristine watershed in Illinois. Biological Invasions, 8, 1103-1113
- Evanno G, Castella E, Goudet J (2006) Evolutionary aspects of population structure for molecular and quantitative traits in the freshwater snail Radix balthica. Journal of Evolutionary Biology, 19, 1071-1082
- Kraaijeveld-Smit FJL, Beebee TJC, Griffiths RA, Moore RD, Schley L (2005) Low gene flow but high genetic diversity in the threatened Mallorcan midwife toad Alytes muletensis. Molecular Ecology, 14, 3307-3315.
- Trenham PC, Koenig WD, Bradley Shaffer H (2001) Spatially autocorrelated demography and interpond dispersal in the salamander Ambystoma californiense. Ecology, 82, 3519- 3530.
- Burns EL, Eldridge MDB, Houlden BA (2004) Microsatellite variation and population structure in a declining Australian Hylid Litoria aurea. Molecular Ecology, 13
- Newman RA, Squire T (2001) Microsatellite variation and fine-scale population structure in the wood frog (Rana sylvatica). Molecular Ecology, 10, 1087-1100
- Cabe PR, Page RB, Hanlon TJ, Aldrich ME, Connors L, Marsh DM (2007) Fine-scale population differentiation and gene flow in a terrestrial salamander (Plethodon cinereus) living in continuous habitat. Heredity, 98, 53-60
- Beebee TJC, Rowe G, Arntzen JW (1999) Identification of newts (Triturus sp.) and their hybrids using molecular methods. Journal of Zoology, London, 249, 43-47.
- Hitchings SP, Beebee TJC (1997) Genetic substructuring as a result of barriers to gene flow in urban Rana temporaria (common frog) populations: Implications for biodiversity conservation. Heredity, 79, 117-127.
- Knopp T, Merilä J (2009) Microsatellite variation and population structure of the moor frog (Rana arvalis) in scandinavia. Molecular Ecology, 18, 2996-3005.
- Monsen KJ, Blouin MS (2003) Genetic structure in a montane ranid frog: Restricted gene flow and nuclear-mitochondrial discordance. Molecular Ecology, 12, 3275-3286
- Palo JU, O’Hara RB, Laugen AT, Laurila A, Primmer CR, Merilä J (2003) Latitudinal divergence of common frog (Rana temporaria) life history traits by natural selection: evidence from a comparison of molecular and quantitative genetic data. Molecular Ecology, 12, 1963–1978
- Rowe G, Beebee TJC, Burke T (1998) Phylogeography of the natterjack toad Bufo calamita in Britain: Genetic differentiation of native and translocated populations. Molecular Ecology, 7, 751-760.
- Aurélie Johanet, Flux de gènes inter- et intra-spécifiques chez des espèces de vallées alluviales : cas de stritons palmés et ponctués en vallée de la Loire Thèse de doctorat en Biologie des organismes (Université d'Angers).
- Blaustein AR, Bancroft BA (2007) Amphibian population declines : Evolutionary considerations. BioScience, 57, 437-444
- Stuart SN, Chanson JS, Cox NA, Young BE, Rodrigues ASL, Fischman DL, Waller RW (2004) Status and trends of amphibian declines and extinctions worldwide. Science, 306, 1783-1786
- Portail origine et évolution du vivant
- Portail de la conservation de la nature