Theodoxus fluviatilis
Theodoxus fluviatilis (ou Nérite des rivières, aussi parfois simplement nommé néritine ou nérite bien que ces termes puissent aussi désigner de nombreux autres mollusques de la même famille) est une espèce de mollusque d'eau douce et saumâtre. Ce gastéropode herbivore appartient au genre Theodoxus, classé dans la famille des Neritidae (qui est considérée comme « archaïque »[8] et qui comprend de nombreuses espèces, presque toutes tropicales).

| Règne | Animalia |
|---|---|
| Embranchement | Mollusca |
| Classe | Gastropoda |
| Sous-classe | Neritimorpha |
| Ordre | Cycloneritimorpha |
| Super-famille | Neritoidea |
| Famille | Neritidae |
| Genre | Theodoxus |
- Nerita fluviatilis Linnaeus, 1758[1] (protonyme)
- Neritina fluviatilis (Linnaeus, 1758)
- Theodoxus lutetianus Montfort, 1810[2] (unnecessary substitute name for Nerita fluviatilis Linnaeus, 1758)
- Theodoxus balticus (Nilsson, 1821)
- Theodoxus halophilus (Klett, 1828)
- Theodoxus trifasciatus (Menke, 1828)
- Theodoxus rhodocolpa De Cristofori & Jan, 1832
- Theodoxus thermalis (Boubée, 1833)
- Theodoxus intextus A. & J. B. Villa, 1841
- Theodoxus parreyssii A. & J. B. Villa, 1841
- Theodoxus ticinensis A. & J. B. Villa, 1841
- Theodoxus zebrina Récluz, 1841
- Theodoxus mittreana Récluz, 1842
- Theodoxus doriae Issel, 1865
- Theodoxus reynesiana Dubreuil, 1869
- Theodoxus brauneri Lindholm, 1908[3],[4] – ou comme espèce à part entière[5],[6]
- Theodoxus brauneri f. lacrymans Lindholm, 1908
- Theodoxus brauneri f. alboguttata Lindholm, 1908
- Theodoxus brauneri f. pulherrima Lindholm, 1908
- Theodoxus dniestroviensis Put, 1972
- Theodoxus velox Anistratenko, 1999[7]
Sa coquille est épaisse et il peut la fermer grâce à un opercule calcifié et nacré (face interne). Le motif et la couleur de la coquille sont très variable.
Ce petit mollusque prosobranche vit dans les rivières, fleuves et lacs, toujours sur des pierres ou substrats durs (éventuellement artificiels, on en a par exemple trouvé se nourrissant sur le périphyton et les organismes installés sur des pieds immergés de mâts d'éoliennes en zone estuarienne[9]). Il se nourrit principalement en broutant le biofilm épilithique algo-bactérien et en particulier les diatomées, cyanobactéries et biofilms encroûtants.
L'espèce fait preuve d'une grande plasticité [10], mais pour des raisons mal comprises, certains de ses populations semblent se développer et parfois pulluler (dans certains de ces cas, des densités de plusieurs milliers d'escargots par mètre carré ont été localement observées) alors qu'elles régressent et disparaissent en d'autres endroits (Tchéquie, Allemagne).
Distribution
Theodoxus fluviatilis est le seul nérite observable en France (jusqu'en zone très saumâtre), et l'une des trois espèces observables en Europe et Asie centrale.
Autrefois considéré comme exclusivement européen, il semble pouvoir être potentiellement présent dans tout le centre et l'ouest de la zone paléarctique eurasiatique[11] sauf dans les Alpes[12] et les régions situées immédiatement au nord des Alpes. Cette espèce est absente des zones très froide en hiver (ex : nord de la Suède, Norvège[12] ou Sibérie)[11].
Theodoxus fluviatilis est souvent discret ou a localement disparu, mais il est le plus largement répandu (en termes d'aire géographique) parmi toutes les espèces du genre Theodoxus[13]. et l'une des espèces les plus largement distribués de toute la famille Neritidae[14].
La localité qui a fourni l'échantillon utilisé par Linné pour la description scientifique de l'espèce a été oubliée ; il pourrait s'agir de la rivière Main en Allemagne du Sud[3],[15], mais Glöer en 2002 rappelle[16] que Linné a écrit "Habitat in fluviis, Upsaliae ad molendinam Ulvam & alibi", ce qui pourrait évoquer un environnement saumâtre [17];
État des populations, pressions, menaces
Cette espèce est menacée dans une grande partie de son aire naturelle et potentielle de répartition, principalement par l'ingénierie des cours d'eau, la canalisation, l'envasement (notamment lié à la turbidité de l'eau) et par la pollution de l'eau (dont par les hydrocarbures[18]) dans les régions densément peuplées ou d'agriculture intensive[19]. Elle a récemment disparu en Allemagne, Tchéquie et semble menacée de disparition imminente en Suisse[20].
Des tendances paradoxales sont observées. La population de l'espèce semble globalement stable dans le monde, mais en baisse dans certaines régions (Allemagne notamment), et en pleine expansion dans le Danube. L'espèce a failli disparaitre du Rhin dans les années 1970 en raison de la pollution du fleuve[14] puis a commencé à reconstituer ses populations à la suite de la reconquête de la qualité de l'eau durant plus de deux décennies pour néanmoins disparaitre du Rhin pour une raison inconnue à la fin des années 1990[14] avant de finalement recoloniser ce fleuve, très probablement via les canaux et notamment la circulation des péniches sur le canal Main-Danube[14], selon l'étude génétique du Cytochrome c oxidase I (gène mitochondrial COX1 ou CO1), qui a montré une recolonisation probablement originaire du Danube[14].
Cette espèce ou certaines souches pourraient être sensibles au réchauffement des eaux ou menacées par le dérèglement climatique ; elle se montre (en laboratoire) plus sensible à une élévation de la température de l'eau (cf. tests à 36 et 38 °C) que Lymnea peregra[21], même si elle résiste mieux à une déshydratation estivale (pour l'adulte). G Skoog, l'auteur de cette étude a montré que les juvéniles de T. fluviatilis résistent moins bien à la chaleur dans leurs capsules d'œufs que les juvéniles de L. peregra, mais ceci est compensé par le fait que T. fluviatilis dépose ses capsules sur les coquilles de congénères ou plus profondément sous la surface de l'eau.
Histoire et phylogénie
Phylogénie : Bunje & Lindberg (2007) ont présenté une première hypothèse phylogénétique sur la spécificité du clade Theodoxus[22]. L'évolution de ce genre (Theodoxus) résulterait de la séparation de l'Europe avec l'Afrique par la Méditerranée et la mer Paratéthys au Miocène[22].
Selon W.R Hunter (2013), c'est une espèce qui n'a que récemment (à l'échelle géologique des temps) colonisé les eaux douces de l'Europe ; en profitant de la période (interglaciaire Günz/Mindel)[23].
Description et critères d'identification



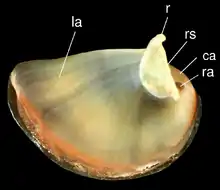
la – adducteur gauche,
r – apophyse ,
rs – frontière apophyse-bouclier,
ca – cal
ra – Adducteur droit.
- Taille & poids : jusqu'à 6,5 mm de hauteur pour 13 mm de longueur (5 à 9 mm en moyenne), selon les conditions environnementales[24]. La hauteur de la coquille est souvent de 4 à 6,5 mm[24], et parfois 7 mm [31]. La largeur maximale de la coquille est de 9,3 mm[25] et moins (jusqu'à 5,8 mm) en eau saumâtre[25]. Le poids maximal de la coquille est de 124 mg en eau saumâtre et 343 mg en eau douce[25].
- Corps : La peau est ornée de motifs qui varient selon les individus. La tête est foncée, les deux tentacules sont longs et fins, souvent gris et parfois ornés d'une ligne foncée. Ils se terminent chacun par un œil pédonculé, noir et plutôt grand (« fixé à la partie externe de leur base »[20]). Les parties molles visibles de l'animal sont claires (blanchâtres à jaunâtre)[19] ; le pied est blanchâtre[19].
- Coquille : Elle est dure, épaisse et très calcifiée, ce qui est assez rare chez les escargots aquatiques des eaux tempérées.
Sa forme est globalement semiovulaire, sans ombilic, un peu déprimée (avec une flèche généralement faible) et avec une large ouverture. La columelle est très effacée.
L'enroulement des spires est dextre (c'est-à-dire que l'ouverture se présent à droite de l'axe d'enroulement quand la coquille est observée verticalement pointe (apex) en haut et ouverture tournée vers l'observateur).Les spires intérieures sont absentes ou à peine marquée, mais sont souvent bien visibles à l'extérieur car marquée par une discontinuité du motif. Selon l'âge de l'animal (2 à 3 ans), chez l'adulte la coquille présente à 2 à 3,5 tours (y compris le protoconque), le dernier tour (ou demi-tour) étant caractérisé par une spire très large. Chez les adultes, l'apex est souvent dégradé (usé, blanchâtre)[26],[10],[27].
Les spécimens les plus âgés sont habituellement endommagés ou érodées[25],[28], peut être à cause de l'habitude qu'ils ont de se cacher le jour dans les anfractuosités ou sous les pierres qui peuvent parfois bouger avec le courant.
- Opercule : De nature calcaire, il a une forme de demi-lune (forme de D) tendant vers l'ovale. Il présente une apophyse marquée côté interne. La forme de cet apophyse diffère chez le mâle et la femelle (y compris chez le jeune individu)[10]. Ce dimorphisme sexuel est marqué par la forme de la zone frontière entre cet apophyse et le bouclier de l'opercule qui diffère selon le sexe : elle est droite chez les femelles, mais courbe chez les mâles[10].
Certaines des particularités de l'opercule (déjà présentes chez les juvéniles) sont utilisées pour l'identification de l'espèce : une périphérie rougeâtre et une marge rouge-orangée, et un crête sur sa surface intérieure[15]. Le muscle columellaire est fixé à la crête de l'apophyse [15] qui est longue et mince, atténué à la base, tandis que le cal est mince ; il n'y a pas de "cheville" (alors qu'elle est présente chez les deux autres espèces)[10].
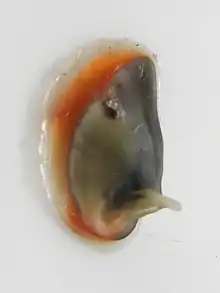
Images présentant l'opercule :
 Côté externe d'un opercule |
 Face interne du même opercule |
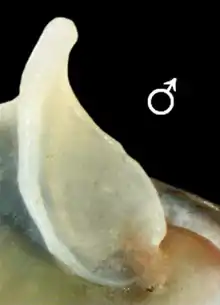 Détail : Apophyse du mâle |
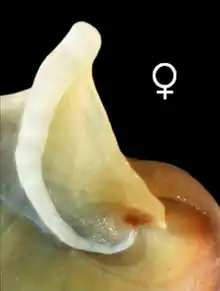 Détail : Apophyse de la femelle |
Des aberrations dans la forme d'opercule ont été signalées [10].
- Couleur, motif : La coquille est blanche à jaunâtre et ornée (à l'extérieur) de lignes sombres en réseau (rouge, brunâtre à violet foncé) filet évoquant parfois une calligraphie, ou un damier dont les cases seraient rectangulaires ou arrondies, mais ce motif prend au sein de l'espèce des formes très variables et une teinte plus ou moins foncée, a priori en fonction des conditions environnementales (composition ionique de l'eau, type de substrat et de la nutrition des individus[29] ; Zettler et ses collègues ont en 2004 montré[25] que dans le eaux côtières de la mer Baltique (dont la salinité varie saisonnièrement), une coquille presque noire et souvent corrodée prédomiée alors que dans les eaux intérieures côtières, les formes vert-jaunâtre prévalent [43]. Selon Glöer et Pešić (2015) dans un substrat caillouteux sombre des formes noires ou brun foncé prédominent[29]. Les populations d'Europe du Nord présentent un motif de taches blanches dispersées sur un fond sombre ou rouge[29] alors que les spécimens du Sud la France et d'Espagne sont ornés d'un motif de bandes foncées en zigzag évoquant parfois les motifs de certaines moules zébrées, tandis que les spécimens provenant des Balkans présentent toutes les combinaisons possibles de taches, stries et motifs en zigzag[29]. Dans les lacs, les coquilles sont plutôt ornées de bandes sombres et claires[29]..
Dans les eaux eutrophes, la coquille est en outre parfois « verdie » par des microalgues ou des bactéries.
Chez quelques espèces les bandes plus foncées occupent presque toute la surface faisant paraitre la coquille uniformément sombre[19].
- Polymorphisme : Les détails de motif, de couleur, de forme et couleur de la coquille peuvent fortement varier au sein de l'espèce. La forme de la radula et de l'opercule semble mieux fixée, mais des formes inhabituelles d'opercule ont été signalées[10].
Certains auteurs considèrent qu'il existe plusieurs sous-espèces (ou sous espèces comme Theodoxus fluviatilis thermalis (Dupuy, 1851) aussi nommée Nérite des Pyrénées). Certains considèrent que le polymorphisme observé est dû aux habitats et à la nourriture ou à des variations naturelles aléatoires permises par le génome de l'animal[29].
En raison de ce polymorphisme de tailles, couleurs et motifs, marqué chez T. fluviatilis, mais aussi chez les trois autres espèces eurasiatiques de Theodoxus, il est très difficile de le distinguer des deux autres espèces qui peuvent aussi être trouvés en Europe centrale :
- Theodoxus danubialis, Pfeiffer 1828 (ou nérite du Danube), plus grand, et dont la « robe est couverte de zigzags foncés sur fond clair »[20] ;
- Theodoxus transversalis, Pfeiffer 1828 (ou nérite fasciée) à la robe « gris-foncé à jaune sans dessin »[20].
- Theodoxus prevostianus (Pfeiffer, 1828),
L'identification au niveau de l'espèce doit être faite par un spécialiste. Les spécimens sauvages trouvés en France sont toutefois supposés tous appartenir à l'espèce T. fluviatilis (par défaut de présence des autres espèces dans le pays).
Images montrant la grande variabilité des couleurs et patterns (motifs) des coquilles de Theodoxus fluviatilis:
 Spécimen provenant d'Alster (Allemagne) |
 Spécimen provenant de Güstrow (Allemagne) |
 Origine : Rivière Zeta (Monténégro) |
 Origine : Rivière Neretva (Bosnie-Herzégovine) |
Habitats, Biologie, écologie

Ce mollusques est dit potamique rhéophile. Il fait partie du macrobenthos[30] ; il ne vit que dans les eaux courantes ou brassées, sur les substrats durs (roches, galets, branches..), très près de la surface et jusqu'à 5-6 m de profondeur et parfois plus éventuellement dans les zones d'eaux plus vives de petites chutes d'eau (naturelles ou arfificielles), « dans la zone de déferlement des lacs ». On le trouve aussi parfois en eau saumâtre (« salinité inférieure à 18 » selon DORIS[20]), grâce à une bonne capacité d'osmorégulation.
Sa durée de vie totale est de 2 ou 3 ans (les années de croissance sont souvent bien visibles sur la coquille).
L'espèce semble plutôt lucifuge ; elle est souvent trouvés le jour à l'abri de la lumière sur la face inférieure de pierres, ou sous des surplombs...).
Régime alimentaire
Il est réputé se nourrir d'algues sur le biofilm alguobactérien du périphyton, mais il ne mange pas les algues vertes[31] évoluées (aucune des espèces de theodoxus ne synthétisent l'enzyme (cellulase) nécessaire à la digestion de ces algues[31].
Quand ses populations sont denses, son activité de broutage fait presque disparaitre le biofilm qui se forme naturellement sur les substrats durs et il peut alors « fortement réduire les densités de méiofaune en raison d’une intense pression de broutage non-sélective »[32].
Reproduction
Chez cette espèce, les sexes sont séparés et la maturité sexuelle est atteinte en fin de première année ou la seconde année quand l'animal mesure environ 7 mm.
Le pénis du mâle est situé sur le côté droit du pied. Le réceptacle séminal de la femelle est aussi à droite, sous le rebord du manteau. Chez la femelle un second réceptacle produit les « capsules ovigères ».
En effet, la femelle de ce petit escargot pond ses œufs de mi-mai à mi-novembre, quand la température de l'eau est d'environ 10 °C, par paquets regroupés dans de petites capsules blanches, aplaties, rondes ou ovales et calcifiée, d’une taille d’un millimètre environ (chacune contenant selon les auteurs de 30 à 70 voire jusqu'à environ 200 minuscules œufs ; plus en eau douce et moins en eau saumâtre [20]).
Ces capsules sont habituellement collées sur un substrat dur et souvent sur les coquilles d'autres theodoxus ou d'autres mollusques (Les autres espèces de Theodoxus font de même).
une théorie scientifique dite « du cycle de vie (Life-cycle theory) » suggère que des propagules de reproduction plus petits devraient être produits dans des environnements où le taux de croissance juvénile est plus élevé. Il a été récemment suggéré et démontré que cela est vrai si la taille des adultes est fixe et si le temps de reproduction est également fixe. Une étude anglaise basée sur la mesure des capsules et du taux de croissance des juvéniles dans 5 sites du sud de l'Angleterre a trouvé des différences significatives entre les sites pour deux facteurs : de grandes capsules sont produites sur les sites où le taux de croissance est moindre, comme le prédisait la théorie du cycle de vie[33].
Selon DORIS, « deux périodes seraient à considérer avec 40 capsules par femelle de mai à juin, et 20 capsules seulement en automne, ces capsules étant souvent regroupées par 4 ou 5 »[20].
L'incubation est estimée à 1 à 2 mois en été, mais 7 à 8 mois dans les « capsules d'hivernage » dans une eau de moins de 10 °C [20].
Le système de détermination sexuelle est de type XX/X0 comme chez tous les Neritidae[34]
Dans chaque capsule, une seule larve juvénile se développera (les autres œufs lui servant de nourriture) et selon les mesures publiées par Bondesen en 1940, la taille de la capsule est prédictive de la taille de la coquille du jeune escargot qui en émergera, ce qui a été récemment confirmé par R.A Orton et R.M Sibly en 1990[33].
De la capsule émerge un escargot qui est à l'image de l'adulte mais d'une taille de 0,5 à 1 mm[20].
Génétique
L'espèce est diploïde avec un nombre de chromosomes (2n) de 25 chez le mâle et 26 chez la femelle[34].
Parasitisme
Plusieurs parasites de Theodoxus fluviatilis dont connus, dont
- Trématodes : plusieurs espèces de trématodes peuvent parasiter cette espèce.
Cet escargot est utilisé comme premier hôte intermédiaire par le trématode Plagioporus skrjabini[35] ;
Il est le second hôte intermédiaire de Cotylurus cornutus[36].
Deux autres trématodes, Asymphylodora demeli[36] et Notocotylus zduni[37],[38] parasite également cette espèce. - Ciliés : Plusieurs Ciliés peuvent aussi parasiter T. fluviatilis ; ainsi cet escargot est l'hôte principal du Cilié Trichodina baltica [66] et moins souvent de plusieurs espèces de Scyphidia[39], ou de Protospira mazurica[40] ou Hypocomella quatuor[41].
Prédation
Ses prédateurs ne sont pas très bien connus, mais on sait que le gardon (Rutilus rutilus) en fait partie[42].
Theodoxus fluviatilis est aussi la proie de certains oiseaux d'eau se nourrissant sur le fond ou près de la surface[43].
Utilisations
L'espèce ne semble pas avoir été recherchée par l'homme comme nourriture, mais des fouilles archéologiques ont montré que sa coquille a été utilisée à la préhistoire comme bijou (pendentifs au paléolithique russe[44])
Notes et références
Références taxonomiques
(en) Référence NCBI : Theodoxus fluviatilis (taxons inclus)
Notes et références autres que taxonomiques
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Theodoxus fluviatilis » (voir la liste des auteurs).
- Linnaeus C. (1758). Systema Naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. 10th edition. Vermes. Testacea: 700–781. Holmiae. (Salvius). page 777.
- Montfort P. D. de (1810). Conchyliologie systématique, et classification méthodique des coquilles; offrant leurs figures, leur arrangement générique, leurs descriptions caractéristiques, leurs noms; ainsi que leur synonymie en plusieurs langues. Ouvrage destiné à faciliter l'étude des coquilles, ainsi que leur disposition dans les cabinets d'histoire naturelle. Coquilles univalves, non cloisonnées. Tome second. – pp. [1–3], 1–676. Paris. page 351.
- Anistratenko V. V. (2005). "Lectotypes for Tricolia pullus, Gibbula divaricata and Theodoxus fluviatilis (Mollusca, Gastropoda) revisited". Vestnik zoologii 39(6): 3–10. PDF .
- (de) Lindholm W. A. (1908). "Materialien zur Molluskenfauena [sic] von Südwestrussland, Polen und der Krim". Zapiski Novorossijskago Obshchestva Estestvoispytatelej – Mémoires de la Société des Naturalistes de la Nouvelle-Russie 31: 199–232. Odessa.
- "Theodoxus". Fauna Europaea, last update 27 January 2011, accessed 12 April 2011.
- "Species in genus Theodoxus" (n=20). AnimalBase, accessed 11 April 2011.
- Anistratenko O. Y., Starobogatov Y. I. & Anistratenko V. V. (1999). "Mollusks of the genus Theodoxus (Gastropoda, Pectinibranchia, Neritidae) from the Black and the Azov seas basin". Vestnik Zoologii 33: 11–19.
- Kano Y, Chiba S & Kase T (2002). Major adaptive radiation in neritopsine gastropods estimated from 28S rRNA sequences and fossil records. Proceedings of the Royal Society of London B: Biological Sciences, 269(1508), 2457-2465.
- Wilhelmsson D & Malm T (2008) Fouling assemblages on offshore wind power plants and adjacent substrata. Estuarine, Coastal and Shelf Science, 79(3), 459-466 (résumé
- Glöer P. & Pešić V. (2015). "The morphological plasticity of Theodoxus fluviatilis (Linnaeus, 1758) (Mollusca: Gastropoda: Neritidae)". Ecologica Montenegrina 2(2): 88-92. PDF.
- Glöer P. & Pešić V. (2012). "The freshwater snails (Gastropoda) of Iran, with descriptions of two new genera and eight new species". ZooKeys 219: 11–61. doi:10.3897/zookeys.219.3406.
- "Species summary for Theodoxus fluviatilis". AnimalBase, modifié 21 septembre 2009, consulté 11 avril 2011.
- Bunje, P. M. E. (2005). "Pan-European phylogeography of the aquatic snail Theodoxus fluviatilis (Gastropoda: Neritidae)". Molecular Ecology 14 (14): 4323–4340. doi:10.1111/j.1365-294X.2005.02703.x. . PDF.
- Gergs R., Koester M., Grabow K., Schöll F., Thielsch A. & Martens A. (2014). "Theodoxus fluviatilis’ re-establishment in the River Rhine: a native relict or a cryptic invader?". Conservation Genetics doi:10.1007/s10592-014-0651-7
- Bandel K. (2001). "The history of Theodoxus and Neritina connected with description and systematic evaluation of related Neritimorpha (Gastropoda)". Mittelungen aus dem Geologisch-Palaontologischen Institut Universitat Hamburg (85): 65–164. PDF.
- Glöer P. (2002). Die Süßwassergastropoden Nord- und Mitteleuropas. Die Tierwelt Deutschlands, ConchBooks, Hackenheim, 326 pp., (ISBN 3-925919-60-0). pages 46–49, 51–53
- Zettler M.A (2008) "Zur Taxonomie und Verbreitung der Gattung Theodoxus Montfort, 1810 in Deutschland. Darstellung historischer und rezenter Daten einschließlich einer Bibliografie. (Taxonomy and distribution of the genus Theodoxus Montfort, 1810 in Germany. Presentation of historical and recent data including a bibliography)". Mollusca 26: 13–72. PDF
- MacFarlane G.R, Reid D.J & Esguerra C.A (2004) Sublethal behavioral effects of the water accommodated fractions of crude oil to gastropod molluscs. Bulletin of environmental contamination and toxicology, 72(5), 1025-1031 ([MacFarlane, G. R., Reid, D. J., & Esguerra, C. A. (2004). Sublethal behavioral effects of the water accommodated fractions of crude oil to gastropod molluscs. Bulletin of environmental contamination and toxicology, 72(5), 1025-1031. (extrait et résumé
- "Species summary for Theodoxus fluviatilis". AnimalBase, last modified 21 September 2009, accessed 11 April 2011.
- Fiche Doris sur T. fluviatilis, DORIS, Kupfer Michel, Corolla Jean-Pierre, in : DORIS, 3/12/2014 : Fiche : Theodoxus fluviatilis (Linnaeus, 1758), http://doris.ffessm.fr/fiche2.asp?fiche_numero=2690 consultée 2015-08-22
- Skoog G (1976) Effects of acclimatization and physiological state on the tolerance to high temperatures and reactions to desiccation of Theodoxus fluviatilis and Lymnea peregra. Oikos, 50-56 (https://www.jstor.org/stable/3543431 résumé]).
- Bunje P. M. & Lindberg D. R. (2007). "Lineage divergence of a freshwater snail clade associated with post-Tethys marine basin development". Molecular Phylogenetics and Evolution 42(2): 373–387. DOI:10.1016/j.ympev.2006.06.026
- Hunter W.R (2013). Physiological aspects of ecology. Physiology of mollusca, 1, 83 (lien Google livre)
- (Czech) Horsák M., Juřičková L., Beran L., Čejka T. & Dvořák L. (2010). "Komentovaný seznam měkkýšů zjištěných ve volné přírodě České a Slovenské republiky. [Annotated list of mollusc species recorded outdoors in the Czech and Slovak Republics]". Malacologica Bohemoslovaca Suppl. 1: 1–37. PDF.
- Zettler M. L., Frankowski J., Bochert R. & Röhner M. (2004). "Morphological and ecological features of Theodoxus fluviatilis (Linnaeus, 1758) from Baltic brackish water and German freshwater populations". Journal of Conchology 38(3): 305–316. PDF.
- (en) Falkner G., Obrdlík P., Castella E. & Speight M. C. D. (2001). Shelled Gastropoda of Western Europe. München: Friedrich-Held-Gesellschaft, 267 pp.
- Theodoxus fluviatilis. Marine Species Portal, consulté 11 avril 2011
- Kirkegaard J (2006) "Life history, growth and production of Theodoxus fluviatilis in Lake Esrom, Denmark". Limnologica 36(1): 26–41. doi:10.1016/j.limno.2005.11.002.
- Glöer P. & Pešić V. (2015). "The morphological plasticity of Theodoxus fluviatilis (Linnaeus, 1758) (Mollusca: Gastropoda: Neritidae)". Ecologica Montenegrina 2(2): 88-92. PDF.
- Tachet, H., Gaschignard-Fossati, O., Cellot, B., & Berly, A. (1988, January). Le macrobenthos de la Saône. In Annales de limnologie (Vol. 24, No. 01, pp. 83-100). EDP Sciences.
- "Genus summary for Theodoxus". AnimalBase, consultée le 11 avril 2011
- Majdi, Nabil (2011) Meiofauna in river epilithic biofilm: Dynamics and trophic relationships (thèse de doctorat en Écologie fonctionnelle soutenue le 29 novembre 2011 ; École doctorale, Sciences de l'Univers, de l'Environnement et de l'Espace (SDUEE), unité de recherche EcoLab UMR 5245, Université Paul Sabatier de Toulouse), 176 pp. voir p 27
- Orton R.A & Sibly R.M (1990). Egg size and growth rate in Theodoxus fluviatilis (L). Functional Ecology, 91-94. DOI:10.2307/2389657 (résumé)
- Baršienė J., Tapia G., Pujante A. M. & Martinez-Orti A. (2000). "A comparative study of chromosomes in four species of Theodoxus (Gastropoda: Neritidae)". Journal of Molluscan Studies 66(4): 535–541. DOI:10.1093/mollus/66.4.535.
- (ru) Chernogorenko, M. I.; Komarovova, T. I.; Kurandina, D. P. (1978). "Life cycle of the trematode, Plagioporus skrjabini Kowal, 1951 (Allocreadiata, Opecoelidae)". Parazitologiia (in Russian) 12 (6): 479–486. . edit.
- Poulin R. & Chappell L. H. (2002). Parasites in Marine Systems. Parasitology, 124, Cambridge University Press, 216 pp., page S123, S128. (ISBN 0521534127).
- Gibson D. I., Bray R. A. & Harris E. A. (Compilers) (2005). "Host-Parasite Database". Natural History Museum, London
- Kostadinova A. (1993). Trematodes and trematode communities in fish-eating birds from the Bulgarian Black Sea coast. Bulgarian Academy of Sciences, Parazitologiia Institut, 5 pp.
- Raabe Z. (1965). "The parasitic ciliates of gastropods in the Ohrid Lake". Acta Protozoologica 3: 311–3 (PDF)
- Raabe Z. (1968). Two new species of Thigmotricha (Cliata, Holotricha) from Theodoxus fluviatilis. Acta Protozoologica 6: 170–173 (PDF)
- Raabe Z. (1968). "Two new species of Thigmotricha (Cliata, Holotricha) from Theodoxus fluviatilis. Acta Protozoologica 6: 170–173. PDF
- Lappalainen A., Rask M., Koponen H. & Vesala S. (2001). "Relative abundance, diet and growth of perch (Perca fluviatilis) and roach (Rutilus rutilus) at Tvärminne, northern Baltic Sea, in 1975 and 1997: responses to eutrophication?" Boreal Environment Research 6: 107–118. PDF.
- Kiss J. B., Rékási J. & Richnovszky A. (1995). "Data on the mollusc (Mollusca) consumption of birds in the Danube Delta, Romania". Aquila 102: 99–107. PDF.
- Sinitsyn A.A (2003), A Palaeolithic ‘Pompeii’at Kostenki, Russia. Antiquity, 77(295), 9-14.
Voir aussi
Articles connexes
Bibliographie
- Anistratenko V.V (2005), Lectotypes for Tricolia pullus, Gibbula divaricata and Theodoxus fluviatilis (Mollusca, Gastropoda) revisited.
- Behrendt A (): Common river nerite (Theodoxus fluviatilis). ((de)
- Bielawski J (1960), Influence of the salinity and the oxygen content in the external medium upon the respiration of the snail Theodoxus fluviatilis (L.). Acta Biologiae Experimentalis, 20, 49-63.
- Bondesen P (1940). "Preliminary investigations into the development of Neritina fluviatilis L. in brackish and fresh waters". Videnskabelige Meddelelser fra Dansk Naturhistorisk Forening 104: 283–318.
- Boycott A.E (1936), "Neritina fluviatilis in Orkney". Journal of Conchology 20: 199–200.
- Giusti F & Selmi M.G (1982), The morphological peculiarities of the typical spermatozoa of Theodoxus fluviatilis (L.)(Neritoidea) and their implications for motility. Journal of ultrastructure research, 78(2), 166-177.
- Kirkegaard J (1980), "Livscyklus, vækst og produktion hos Theodoxus fluviatilis i Esrom Sø. M.S.". Thesis, Freshwater Biological Laboratory, University of Copenhagen.
- Liess A & Haglund A.L (2007), "Periphyton responds differentially to nutrients recycled in dissolved or faecal pellet form by the snail grazer Theodoxus fluviatilis". Freshwater Biology 52: 1997–2008. DOI:10.1111/j.1365-2427.2007.01825.x.
- Malm T, Engkvist R, & Kautsky L (1999), Grazing effects of two freshwater snails on juvenile Fucus vesiculosus in the Baltic Sea. Marine Ecology Progress Series, 188, 63-71 (résumé).
- Neumann D. (1959). "Morphologische und experimentelle Untersuchungen uber die Variabilitat der Farbmuster auf der Schale von Theodoxus fluviatilis L.". Zeitschrift für Morphologie und Ökologie der Tiere 48(4): 349–411.
- (de) Neumann D (1961), "Ernährungsbiologie einer rhipidoglossen Kiemenschnecke". Hydrobiologia 17(1–20): 133–151 ; doi:10.1007/BF00040417}
- Orton R.A & Sibly R.M (1990), "Egg size and growth rate in Theodoxus fluviatilis (L)". Functional Ecology 4(1): 91–94. résumé JSTOR.(article payant)
- Selmi M.G & Giusti F (1983), The atypical spermatozoon of Theodoxus fluviatilis (L.)(Gastropoda, Prosobranchia). Journal of ultrastructure research, 84(2), 173-181 (résumé).
- Skoog G (1971), "Variations in the distribution of Theodoxus fluviatilis on stony locations in the northern Baltic proper". Thalassia Jugoslavica 7: 363–372.
- Skoog G (1971), Variations in the distribution of Theodoxus fluviatilis on stony localities in the northern Baltic proper. Thalassia Jugoslavica, 7, 363-372.
- Skoog G (1978), "Influence of natural food items on growth and egg production in brackish water populations of Lymnea peregra and Theodoxus fluviatilis (Mollusca)". Oikos 31: 340–348. JSTOR (inscription nécessaire).
- Tachet H (2006), Invertébrés d'eau douce : systématique, biologie, écologie, ed. du CNRS, 587p.
- Ulrich H & Neumann D (1956). "Zur Biologie einer Salzwasserpopulation der Flussdeckelschnecke (Theodoxus fluviatilis L.)". In: Steiniger (ed.), Natur und Jagd in Niedersachsen (pp. 219–222). Hannovre.
- Weichtier des Jahres 2004. Mollusc of the year 2004 (in Germany).
- Whitaker M.B (1951), "On the homologies of the oesophageal glands of Theodoxus fluviatilis (L.)". Proceedings of the Malacological Society of London 29(1): 21–34. extrait/résumé
- (ru) Жалай Е.И, Межжерин С.В, Шубрат Ю.В & Гарбар А.В (Zhalay E.I, Mezhzherin S.V, Shubrat Y.V & Garber A.V) (2008). "Про видовий склад молюсків роду Theodoxus (Gastropoda, Neritidae) басейну Нижнього Дунаю: рішення проблеми шляхом аналізу алозимів. (On species composition of aquatic snail Theodoxus genus (Gastropoda, Neritidae) in the lower Danube: solution of the problem with allozymes analysis)". Науковий вісник Ужгородського університету. Серія Біологія (Scientific Bulletin of the Uzhgorod University, Series Biology), 23: 205–208. PDF.
- Theodoxus fluviatilis Species account and photograph at Mollusc Ireland.
- Zettler M.L; Frankowski J; Bochert R; Röhner M (2004): Morphological and ecological features of Theodoxus fluviatilis (Linnaeus, 1758) from Baltic brackish water and German freshwater populations. Journal of Conchology 38: 303-316. (PDF)
- Portail des mollusques et de la malacologie