Trichlorure d'azote
Le trichlorure d'azote, également connu sous les noms de trichloramine, nitrure de trichlore, est un composé chimique de formule NCl3. Il appartient au groupe des chloramines.
Pour les articles homonymes, voir Agene (homonymie).
| Trichlorure d'azote | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.029 |
| No CE | 233-045-1 |
| Apparence | liquide huileux jaune |
| Propriétés chimiques | |
| Formule | NCl3 |
| Masse molaire[1] | 120,366 ± 0,006 g/mol Cl 88,36 %, N 11,64 %, |
| Moment dipolaire | 0,39 ± 0,01 D [2] |
| Propriétés physiques | |
| T° fusion | −40 °C |
| T° ébullition | 71 °C |
| Solubilité | insoluble dans l'eau soluble dans le benzène |
| Masse volumique | 1,653 |
| Précautions | |
| SIMDUT[3] | |
 D1A, D2B, |
|
| Directive 67/548/EEC | |
 E |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Il est le plus souvent rencontré comme un sous-produit de réactions chimiques entre les dérivés d'ammoniac et de chlore, par exemple dans les piscines entre le chlore des désinfectants et l'urée de l'urine (ou la sueur) des baigneurs. Le trichlorure d'azote peut se former en faibles quantités lorsque les toilettes sont désinfectées avec la monochloramine. Il a été découvert au XIXe siècle par Alexis Thérèse Petit.
À l'état pur, NCl3 est très réactif. Il a les mêmes effets que le gaz lacrymogène, mais n'a jamais été utilisé en tant que tel.
Structure
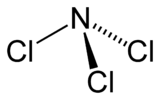
Comme l'ammoniac, le trichlorure d'azote présente une molécule pyramidale.
La distance N-Cl est de 176 pm, et l'angle Cl-N-Cl est de 107 °. L'électronégativité (sur l'échelle de Pauling) est très similaire pour l'atome d'azote (3,04) et de chlore (3,16).
Utilisations
Il était autrefois utilisé illégalement comme agent de blanchiment de la farine sous le nom d'agène.
Préparations
Le trichlorure d'azote est préparé par le traitement des sels d'ammonium, tels que :
- le nitrate d'ammonium avec du dichlore :
- 14 NH4NO3 + 5 Cl2 → 2 NCl3 + 4 NH4Cl + 20 H2O + 22 NO
- ou bien de l'ammoniac avec du dichlore :
- 4 NH3 + 3 Cl2 → NCl3 + 3 NH4Cl
La monochloramine et la dichloramine, NH2Cl et NHCl2 respectivement, sont présents lors de cette réaction.
Réactions
Le trichlorure d'azote est un corps instable, dans l'eau il s'hydrolyse (rapidement dans l'eau chaude) en ammoniac et en acide hypochloreux, selon la réaction :
- NCl3 + 3 H2O → NH3 + 3 HOCl
Il est aussi explosif, son enthalpie de formation étant de +232 kJ/mol, il se décompose alors directement en diazote et en dichlore :
- 2 NCl3 → N2 + 3 Cl2
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- « Trichlorure d'azote » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Portail de la chimie