Trioxyde de diazote
Le trioxyde de diazote ou sesquioxyde d'azote, souvent appelé trioxyde d'azote, est l'oxyde d'azote de formule N2O3.
| Trioxyde de diazote | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Trioxyde de diazote | ||
| No CAS | |||
| No ECHA | 100.031.013 | ||
| No CE | 234-128-5 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
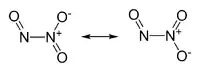
| Formule | N2O3 [Isomères] |
||
| Masse molaire[1] | 76,011 6 ± 0,001 3 g/mol N 36,85 %, O 63,15 %, |
||
| Moment dipolaire | 2,122 ± 0,010 D [2] | ||
| Propriétés physiques | |||
| T° ébullition | 3,3 °C [3] | ||
| Précautions | |||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il se forme lors du mélange en dessous de -21 °C de monoxyde d'azote et de dioxyde d'azote, par la réaction :
- NO + NO2 ⇌ N2O3
Il n'est stable qu'à basse température et sous forme solide ou liquide, se dissociant à haute température en ses gaz constituants. Sous forme solide il est de couleur bleu profond.
Notes et références
- Encyclopédie des gaz Air Liquide, consultée le .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Haz-Map, consulté le 27 juin 2009
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.