Trioxyde de dichlore
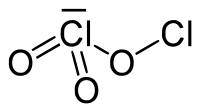
Le trioxyde de dichlore, Cl2O3, est un oxyde de chlore. Il s'agit d'un solide brun foncé découvert en 1967, qui est explosif, même en dessous de 0 °C[3]. Il est formé par la photolyse à basse température de ClO2 et est formé en même temps que le Cl2O6, Cl2 et O2. Sa structure est de la forme OCl-ClO2 avec l'isomère possible Cl-O-ClO2[4]. Il est l'anhydride théorique de l'acide chloreux.
| Trioxyde de dichlore | ||
| ||
 | ||
| Structure du trioxyde de dichlore. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | chloro chlorate[1] | |
| No CAS | ||
| SMILES | ||
| InChI | ||
| Apparence | solide brun foncé | |
| Propriétés chimiques | ||
| Formule | Cl2O3 |
|
| Masse molaire[2] | 118,904 ± 0,005 g/mol Cl 59,63 %, O 40,37 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dichlorine trioxide » (voir la liste des auteurs).
- (en) « dichlorine trioxide », sur chemicalize.org (en)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) N.N. Greenwood et A. Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 978-0750633659)
- (en) Egon Wiberg et Arnold Frederick Holleman, Inorganic Chemistry, Elsevier, 2001 (ISBN 0-12-352651-5)
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.