Trioxyde de xénon
Le trioxyde de xénon est un composé instable du xénon à son état d'oxydation +6 qui se présente sous la forme d'un solide cristallin incolore. C'est un agent oxydant très puissant qui libère lentement de l'oxygène et du xénon au contact de l'eau en une réaction qui s'accélère à la lumière du soleil. C'est également un explosif dangereux au contact des matières organiques, notamment de la cellulose[2],[3].
| Trioxyde de xénon | |
  Structure du trioxyde de xénon |
|
| Identification | |
|---|---|
| No CAS | |
| Propriétés chimiques | |
| Formule | XeO3 |
| Masse molaire[1] | 179,291 ± 0,007 g/mol O 26,77 %, Xe 73,23 %, |
| Propriétés physiques | |
| T° fusion | 25 °C (explosion) |
| Solubilité | Soluble en donnant de l'acide xénique |
| Masse volumique | 4 550 kg·m-3 à 15 °C |
| Cristallographie | |
| Système cristallin | orthorhombique |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés chimiques
Le trioxyde de xénon peut oxyder la plupart des substances oxydables, mais il réagit lentement, ce qui réduit sensiblement son intérêt comme agent oxydant[4]. En solution aqueuse, il forme une solution d'acide xénique :
- XeO3(aq) + H2O → H2XeO4 H+ + HXeO4−
Cette solution est stable à la température ambiante et ne possède pas le caractère explosif du trioxyde de xénon.
Propriétés physiques
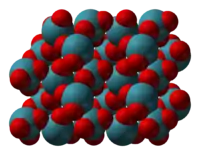
Le tétrafluorure de xénon XeF4 donne par hydrolyse une solution à partir de laquelle on peut obtenir des critaux incolores de XeO3 par évaporation[5]. Ces cristaux sont orthorhombiques, avec a = 616,3 pm, b = 811,5 pm, c = 523,4 pm, et quatre molécules par maille élémentaire, avec une masse volumique de 4 550 kg/m3 [[6]] ; ils demeurent stables plusieurs jours à l'air sec, mais absorbent toute trace d'humidité pour donner une solution concentrée.
 |
 |
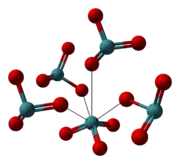 |
| Modèle éclaté de XeO3 cristallisé. | Modèle compact de XeO3 cristallisé. | Coordinence du xénon dans le XeO3 cristallisé. |
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- D. H. Templeton et al. « Crystal and Molecular Structure of Xenon Trioxide » J. Am. Chem. Soc. 85 (1963) 817
- N. Bartlett and P. R. Rao « Xenon Hydroxide: An Experimental Hazard » Science 139 (1963) 506
- N. Greenwood, A. Earnshaw, « Chemistry of the Elements », Butterworth-Heinemann (1997), Oxford
- (en) John H. Holloway, Eric G. Hope et A. G. Sykes (éditeur), Recent Advances in Noble-gas Chemistry, vol. 46 : Advances in Inorganic Chemistry, Academic Press, (ISBN 0-12-023646-X et 9780120236466), p. 65
-
(en) David H. Templeton, Allan. Zalkin, J. D. Forrester et Stanley M. Williamson, « Crystal and Molecular Structure of Xenon Trioxide », Journal of the American Chemical Society, vol. 85, no 6, , p. 817 (lire en ligne)
DOI:10.1021/ja00889a037