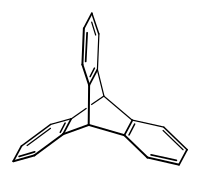
Triptycène
Le triptycène est un hydrocarbure aromatique polycyclique dont la structure centrale est le barrelène (en). C'est le produit de la réaction de Diels-Alder entre l'anthracène et le 1,2-didéshydrobenzène, un aryne. Ce composé a une configuration de type « roue à aubes » avec une symétrie D3h.
| Triptycène | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 9,10-o-benzéno-9,10-dihydroanthracène | |
| No CAS | ||
| No ECHA | 100.006.837 | |
| No CE | 207-519-3 | |
| PubChem | 92764 | |
| SMILES | ||
| InChI | ||
| Apparence | solide[1] | |
| Propriétés chimiques | ||
| Formule | C20H14 [Isomères] |
|
| Masse molaire[2] | 254,325 2 ± 0,017 g/mol C 94,45 %, H 5,55 %, |
|
| Propriétés physiques | ||
| T° fusion | 252 à 254 °C[1] | |
| Précautions | ||
| NFPA 704[1] | ||
| Écotoxicologie | ||
| LogP | 4,870[3] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Historique
Paul D. Bartlett et son équipe ont publié la synthèse du triptycène en 1942 et l'on nommé d'après « The triptych of antiquity », un livre en trois parties reliées par un axe fixe.
Synthèse
La synthèse historique du triptycène comportait plus de sept étapes et commençait par la réaction de l'anthracène sur la 1,4-benzoquinone. Aujourd'hui il est possible de synthétiser le triptycène à partir de l'anthracène et de l'acide anthranilique. Ce dernier réagit avec le nitrite d'amyle pour former in situ un benzyne qui réagira ensuite par réaction de Diels-Alder avec le cycle benzénique central de l'anthracène pour former le triptycène.
Propriétés et utilisations
Le squelette carboné est très rigide, ce qui fait que le triptycène et ses dérivés, comme les quinones de triptycène quinones[4], sont incorporés dans de nombreaux composés organiques comme « échafaudage », par exemple dans la production de moteurs moléculaires[5] ou comme ligand, par exemple dans l'hydrocyanation suivante[6] :
Dans cette réaction, le substrat est le butadiène, le réactif la cyanohydrine d'acétone, le catalyseur le Ni(cod)2 et le ligand une organophosphine bidentate avec un grand angle de morsure, sur un échafaudage de trypticène.
Notes et références
- Fiche Sigma-Aldrich du composé Triptycene, consultée le 10 septembre 2012.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Triptycène », sur ChemIDplus, consulté le 10 septembre 2012
- (en) Triptycene quinones in synthesis: preparation of triptycene bis-cyclopentenedione, Spyros Spyroudis et Nikoletta Xanthopoulou, ARKIVOC 2003 (vi) 95-105 Online article
- (en) Kelly TR, De Silva H, Silva RA, « Unidirectional rotary motion in a molecular system », Nature, vol. 401, no 6 749, , p. 150–2 (PMID 10490021, DOI 10.1038/43639, lire en ligne, consulté le )
- (en) Bini L, Müller C, Wilting J, von Chrzanowski L, Spek AL, Vogt D, « Highly selective hydrocyanation of butadiene toward 3-pentenenitrile », J. Am. Chem. Soc., vol. 129, no 42, , p. 12 622–3 (PMID 17902667, DOI 10.1021/ja074922e)
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Triptycene » (voir la liste des auteurs) et en allemand « Triptycen » (voir la liste des auteurs).
- Portail de la chimie

