Chironomidae
Les Chironomidae forment une famille de diptères nématocères, qui se divise en onze sous-familles, plus de 5 000 espèces décrites dont 700 rien qu'en Amérique du Nord. Les chironomidés représentent une des plus importantes familles de diptères.

La larve de chironome (filtreur et suspensivore) est bien connue sous le nom vernaculaire de « ver de vase ».
Description
 Chironome plumeux, à la couleur verte et aux antennes « en plumeau » caractéristiques.
Chironome plumeux, à la couleur verte et aux antennes « en plumeau » caractéristiques.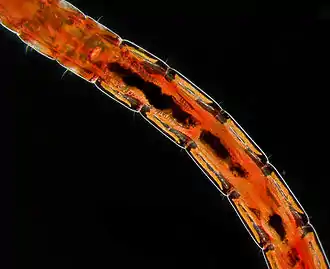 Larve, dite "ver de vase".
Larve, dite "ver de vase".
Les chironomidés sont des insectes de petite taille apparentés aux Ceratopogonidae, Simuliidae, et Thaumaleidae. Ressemblant beaucoup à des moustiques, ils sont communément confondus avec ces derniers.
On les en distingue facilement par :
- la couleur verdâtre des adultes ;
- une taille souvent plus grande (mais il existe des espèces de petite taille) ;
- absence de pièces buccales allongées (organe piqueur chez la femelle) des moustiques (Culicidae) ; un de ses noms anglais est « non-biting midges » qui signifie « moucheron non-piqueur » ;
- des antennes en forme d'épais ou large plumeau chez le mâle ;
- et, pour ceux qui ont l'habitude, un vrombissement sonore différent de celui du moustique.
L'œuf et la larve
L'œuf de chironome[1] est ovale, jaunâtre et translucide. Les œufs sont pondus en paquets denses sur la ceinture d'objets flottants ou émergents, ou sur la berge au bord de l'eau. La larve de chironome est souvent dite « ver de vase » en France. Elle est d'une couleur caractéristique rouge sang (hémoglobine[2]), alors que l'adulte sera verdâtre. L'hémoglobine, ainsi que les mouvements ondulatoires, permettent aux larves d'absorber suffisamment d'oxygène, même dans un environnement pauvre en oxygène[3].
Des soies fines et courtes sont présentes sur chaque segment.
Remarque : la larve est un organisme filtreur[4] qui se fabrique un « tube protecteur ».
Elle est dite « bloodworms » par les anglophones, ce mot pouvant aussi en anglais désigner des vers polychètes vivant dans les sédiments marins (Glycera sp.)
Comportement
Au moment des émergences et de la reproduction, les adultes forment souvent en bordure de rivière et de canaux, et au-dessus des arbres ou buissons, et parfois plus en hauteur (par exemple au-dessus d'une toiture de clocher) en fin d'après midi, des nuages d'insectes tournoyants caractéristiques, qui exceptionnellement sont si denses qu'ils peuvent de loin être confondus avec des volutes de fumées.





Un représentant des Chironomidae, Tanytarsus, présente un exemple de pédogenèse[6].
On trouve les chironomidés au stade larvaire dans presque tous les habitats aquatiques et semi-aquatiques y compris dans les cavités d'arbres, les bromélias, la végétation en décomposition, le sol, les égouts et les contenants artificiels. Ils représentent une part importante du macrozoobenthos (invertébrés aquatiques) de la plupart des écosystèmes d'eau douce. Les chironomes pondent des œufs associés en rubans gélatineux et translucides jaunâtres ou légèrement orangés de plusieurs centaines d'œufs.
Ces rubans qui gonflent rapidement dans l'eau sont collés à la berge ou en périphérie d'un objet flottant ou émergeant de l'eau (lorsque le milieu est très anoxique).
Certaines espèces de chironomes colonisent volontiers les fosses septiques (si elles ont un accès non protégé par un filtre de type moustiquaire). Les larves peuvent alors y vivre par centaines de milliers, voire par millions, plus tôt et plus tard en saison que dans la nature (en zone tempérée).
Fonctions environnementales
Les larves et les nymphes constituent des sources importantes de nourriture pour les poissons, tels les diverses variétés de truites, le Grand corégone, le Fondule barré, l'Épinoche et de nombreux autres organismes aquatiques tels les Tritons. De nombreux insectes aquatiques, tels différents prédateurs parmi les hémiptères de la famille des Nepidae, des Notonectidae et des Corixidae (punaises aquatiques) se nourrissent de chironomes durant leur stade aquatique de même que les coléoptères aquatiques prédateurs des familles telles Dytiscidae and Hydrophilidae. À son dernier stade de développement, le moucheron émerge de la nymphe. Les moucherons nourrisent des poissons et des oiseaux insectivores, tels les hirondelles. Les chironomes sont également reconnus pour nourrir en abondance les cannetons. Les chironomes subissent aussi la prédation de chauve-souris, d'insectes volants tels les Odonates et les mouches danseuses.
Ces invertébrés, non piqueurs, jouent un rôle écosystémiquement important (service écosystémique, y compris dans les lacs et zones humides riches en matière organique, voire nettement polluées (tant que ces polluants ne nuisent pas à leur cycle de développement).
La densité de larves de chironome plumeux (larves filtreuses, et constructrices de tubes) peut atteindre 100000 larves/m2 dans les lacs eutrophes[7]. Ces larves jouent un rôle important pour la filtration de l'eau, mais aussi en minéralisant la matière organique sédimentée[7], ainsi qu'en constituant la base d'une importante chaine alimentaire. En particulier, les larves en se nourrissant de bactéries et en construisant leurs tubes à l'interface eau-sédiment et interfèrent donc avec le biofilm présent à la surface du sédiment et jouent un rôle fondamental dans la bioturbation effective de cette couche. Dans cette zone, elles se montrent capables d'extraire des quantités significatives de NH4+ et de phosphates à partir du sédiment[8],[9],[10],[11],[12].
En présence de larves la couche supérieure du sédiment prend une couleur plus claire indicatrice d'une meilleure oxygénation et d'un travail de minéralisation en favorisant la présence de bactéries[13]. Les expériences faites en laboratoire (microcosme) montrent que leur présence augmente de 4.4 fois la biomasse bactérienne[13]. Elles sont de ce point de vue plus efficaces que les Monoporeia (qui augmentent néanmoins la biomasse bactérienne de 3.2×) et beaucoup plus efficaces que les Tubifex (1.4 x) qui pénètrent moins profondément le sédiment[13].
Elles semblent indirectement consommer de la matière organique favorable à la méthanogenèse (méthane produit par certaines bactéries suflatoréductrices qui apprécient les eaux et/ou sédiments anoxiques, dont dans les rizières[5]). In vitro, l'intérieur de chaque "tube" de larves de chironome semble fonctionner comme une sorte de petit réacteur biologique ou l'activité des bactéries est plus intense[5].
En outre, les chironomidés sont très prolifiques et procurent une source importante de nourriture à nombre d'espèces dont des poissons, des oiseaux, des chauve-souris et des musaraignes aquatiques.
- Ils présentent une chimie du sang basée sur le cuivre là où la plupart des espèces utilisent le fer (d'où la couleur verdâtre de l'adulte). Ils contribuent donc à exporter le cuivre des sédiments vers l'écosystème où il est un oligo-élément important. Dans les cas où le taux d'oxygène de l'eau diminue vraiment trop (la nuit en général), les larves viennent respirer en surface, mais en creusant leurs tubes dans le sédiment elles aident l'oxygène à y pénétrer et font œuvre de bioturbation[14]. - Comme chez les tubifex qui leur sont souvent associés ou qui les remplacent dans les vases encore plus anoxiques (les tubifex sont encore plus résistants à la pollution et au manque d'oxygène), leurs larves qui vivent dans le sédiment, dans une sorte de fourreau généralement vertical contribuent, mais bien mieux que celles des tubifex (qui sont plus petites et beaucoup plus fines) à faire circuler de l'eau (plus oxygénée) dans les sédiments superficiels. Elles sont très résistantes à nombre de polluants et elles contribuent à décolmater, aérer et oxygéner la couche superficielle des vases et sédiments des rivières.
- Après une pollution organique majeure ou durable, ces espèces font partie des espèces pionnières qui contribuent à la résilience de l'écosystème.
Systématique
La famille des Chironomidae a été décrite par l'entomologiste anglais Edward Newman.
Noms vernaculaires
Les anglophones les nomment aussi parfois « lake flies » (mouche des lacs) dans certaines régions du Canada, et « sand flies » (Mouche des sables) ou « muckleheads »[15], ou « muffleheads »[16] dans certaines zones des grands lacs aux États-Unis et « blind mosquitoes » (moustiques aveugles) en Floride.
Taxinomie
- Liste des sous-familles
- Aphroteniinae
- Buchonomyiinae
- Chilenomyiinae
- Chironominae
- Diamesinae
- Orthocladiinae
- Podonominae
- Prodiamesinae
- Tanypodinae
- Telmatogetoninae
- Usambaromyiinae
- Aenneinae†
Liste des genres
- Abiskomyia
- Ablabesmyia
- Acamptocladius
- Acricotopus
- Alotanypus
- Anatopynia
- Antillocladius
- Apedilum
- Apometriocnemus
- Apsectrotanypus
- Arctodiamesa
- Arctopelopia
- Asheum
- Axarus
- Baeoctenus
- Beardius
- Beckidia
- Belgica
- Bethbilbeckia
- Boreochlus
- Boreosmittia
- Brillia
- Brundiniella
- Bryophaenocladius
- Buchonomyia
- Camptocladius
- Cantopelopia
- Cardiocladius
- Chaetocladius
- Chasmatonotus
- Chernovskiia
- Chironomus
- Cladopelma
- Cladotanytarsus
- Clinotanypus
- Clunio
- Coelotanypus
- Compteromesa
- Compterosmittia
- Constempellina
- Conchapelopia
- Corynocera
- Corynoneura
- Corynoneurella
- Cricotopus
- Cryptochironomus
- Cryptotendipes
- Cyphomella
- Demeijerea
- Demicryptochironomus
- Denopelopia
- Derotanypus
- Diamesa
- Dicrotendipes
- Diplocladius
- Diplosmittia
- Djalmabatista
- Doithrix
- Doncricotopus
- Einfeldia
- Endochironomus
- Endotribelos
- Epoicocladius
- Eretmoptera
- Eukiefferiella
- Eurycnemus
- Euryhapsis
- Fittkauimyia
- Georthocladius
- Gillotia
- Glyptotendipes
- Goeldichironomus
- Graceus
- Guttipelopia
- Gymnometriocnemus
- Gynocladius
- Halocladius
- Hanocladius
- Harnischia
- Hayesomyia
- Heleniella
- Helopelopia
- Heterotanytarsus
- Heterotrissocladius
- Hudsonimyia
- Hydrobaenus
- Hyporhygma
- Ichthyocladius
- Irisobrillia
- Kiefferulus
- Kloosia
- Krenopelopia
- Krenosmittia
- Labrundinia
- Lappodiamesa
- Larsia
- Lasiodiamesa
- Lauterborniella
- Limnophyes
- Lipurometriocnemus
- Litocladius
- Lopescladius
- Macropelopia
- Meropelopia
- Mesocricotopus
- Mesosmittia
- Metriocnemus
- Microchironomus
- Micropsectra
- Microtendipes
- Monodiamesa
- Monopelopia
- Nanocladius
- Natarsia
- Neozavrelia
- Nilotanypus
- Nilothauma
- Nimbocera
- Odontomesa
- Oliveridia
- Omisus
- Onconeura
- Oreadomyia
- Orthocladius
- Pagastia
- Pagastiella
- Paraboreochlus
- Parachaetocladius
- Parachironomus
- Paracladius
- Paracladopelma
- Paracricotopus
- Parakiefferiella
- Paralauterborniella
- Paralimnophyes
- Paramerina
- Parametriocnemus
- Parapentaneura
- Paraphaenocladius
- Parapsectra
- Parasmittia
- Paratanytarsus
- Paratendipes
- Paratrichocladius
- Paratrissocladius
- Parochlus
- Parorthocladius
- Pentaneura
- Phaenopsectra
- Platysmittia
- Plhudsonia
- Polypedilum
- Potthastia
- Procladius
- Prodiamesa
- Protanypus
- Psectrocladius
- Psectrotanypus
- Pseudochironomus
- Pseudodiamesa
- Pseudokiefferiella
- Pseudorthocladius
- Pseudosmittia
- Psilometriocnemus
- Radotanypus
- Rheocricotopus
- Rheomyia
- Rheopelopia
- Rheosmittia
- Rheotanytarsus
- Robackia
- Saetheria
- Saetheriella
- Schineriella
- Semiocladius
- Sergentia
- Skutzia
- Smittia
- Stackelbergina
- Stelechomyia
- Stempellina
- Stempellinella
- Stenochironomus
- Stictochironomus
- Stilocladius
- Sublettea
- Sublettiella
- Symbiocladius
- Sympotthastia
- Syndiamesa
- Synendotendipes
- Synorthocladius
- Tanypus
- Tanytarsus
- Tavastia (genus)
- Telmatogeton
- Telmatopelopia
- Telopelopia
- Tethymyia
- Thalassomya
- Thalassosmittia
- Thienemannia
- Thienemanniella
- Thienemannimyia
- Tokunagaia
- Tribelos
- Trichochilus
- Trichocladius
- Trichotanypus
- Trissocladius
- Trissopelopia
- Tvetenia
- Unniella
- Virgatanytarsus
- Vivacricotopus
- Xenochironomus
- Xenopelopia
- Xestochironomus
- Xylotopus
- Zalutschia
- Zavrelia
- Zavreliella
- Zavrelimyia
Les Chironomidae et l'Homme
Utilisations
Certaines espèces possèdent des chromosomes anormalement grands, visibles au microscope, ce qui les a fait retenir pour diverses expérimentations scientifiques ou pédagogiques.
Les larves de certaines espèces de chironomes dites « vers de vase » sont recherchées par les pêcheurs et des entreprises spécialisées pour appâter ou pour nourrir des poissons d'aquariums avec de la nourriture vivante (au risque d'importer des microbes et des polluants de type dioxines ou métaux lourds le cas échéant).
Chironome et santé
Les chironomes ne sont pas réputés dangereux pour l'Homme, notamment parce qu'ils ne piquent pas et ne recherchent pas comme certaines mouches le contact avec notre nourriture. Au moment de la métamorphose, l'adulte quitte son enveloppe à la surface de l'eau, sans contact avec celle-ci et généralement sans contact direct avec les sédiments pollués. Il ne transmet pas de germes ou parasites par piqûre, mais il pourrait être localement vecteur de certains microbes ou virus aux animaux qui le mangent, ou à l'homme via des fomites, ce qui reste à démontrer. (Là où il pullule, il peut consteller les vitres, les murs et le linge qui sèche de minuscules crottes verdâtres).
Les chironomidés participent à la diffusion du choléra. Les œufs de l'insecte peuvent être colonisés par Vibrio cholerae (6 à 36 bactéries par œuf). Les bactéries se trouvent également sur l'exosquelette des adultes qui contribuent à leur dispersion par voie aérienne lors du vol[17].
Bioindicateur
Les chironomidés sont d'importants bioindicateurs de l'état de santé d'un plan d'eau (la présence, l'absence ou la quantité d'une variété d'espèces s'y trouvant en témoignant).
Ces espèces pullulent souvent à proximité des petites rivières très polluées par de la matière organique (ou en aval d'égouts ou de certaines stations d'épuration dysfonctionnant ou sous-dimensionnées, ainsi qu'en aval de rejets insuffisamment épurés de papeteries, d'abattoirs, de certaines unités agroalimentaires. Ces pullulations autrefois réservées aux pays riches, se développent dans les zones plus pauvres. On peut alors trouver des centaines d'œufs déposés chaque nuit sur chaque centimètre de berge à la bonne saison. Le fond de la rivière peut être littéralement tapissé de larves là où le courant est ralenti, sous les cailloux ou là où les sédiments sont fixés par leur poids ou par des associations symbiotiques de bactéries (bactéries filamenteuses souvent) et de champignons aquatiques, avec parfois des algues rouges.
Lorsque l'eau est plus pure, les espèces de chironomes les plus grandes sont remplacées par des espèces plus petites.
Certains chironomes (généralement des espèces de grande taille) sont des bioindicateurs d'une très mauvaise qualité de l'eau s'ils sont massivement présents. En zone tempérée, si la rivière se dégrade encore, ils disparaissent au profit des tubifex, souvent accompagnés d'une espèce de sangsue très résistante à la pollution.
Indicateur climatique ?
Des chercheurs (paléolimnologistes) ont aussi utilisé le chironome comme indicateur environnemental et climatique dans des études rétrospectives visant à mesurer et à comprendre les récentes modifications de l'environnement, notamment les changements climatiques.
Les espèces présentes sous forme de fossiles renseignent sur le climat et la température de l'eau à l'époque où elles ont été fossilisées[18].
Voir aussi
Articles connexes
Notes et références
- exemple de photographie au microscope d'œuf et larve de chironome
- Kirrmann, A. (1930). Le groupe prosthétique de l'hémoglobine de chironome. Bull. Soc. Chim. biol.(Paris), 12, 1146.
- (en) L Int Panis, « On the relationship between vertical microdistribution and adaptations to oxygen stress in littoral Chironomidae (Diptera) », Hydrobiologia, vol. 318, , p. 61–67 (DOI 10.1007/BF00014132)
- Walshe, B. M., 1947. Feeding mechanisms of Chironomus larvae. Nature 160: 147
- Kajan R, Frenzel p. 1999. The effect of chironomid larvae on production, oxidation and fluxes of methane in a flooded rice soil. FEMS Microbiol. 28: 121-129
- Encyclopædia Universalis, 1984, (ISBN 2852292874) (OCLC 22300300)
- McLachlan, A. J. 1977. Some effects of tube shape on the feeding of Chironomus plumosus L. J. Anim. EcoL 46:139-46 131. McLachlan (Résumé)
- Tatrai, I. (1986) Rates of ammonia release from sediments by chironomid larvae. Freshwater Biol. 16, 61–66. (Résumé, en anglais)
- Granéli, W. (1979) The influence of Chironomus plumosus larvae on the oxygen uptake of sediment. Arch. Hydrobiol. 87, 385–403. 37
- Svensson, J.M. (1997) Influence of Chironomus plumosus larvae on ammonium flux and denitrification (measured by the acetylene blockage- and the isotope pairing-technique) in eutrophic lake sediment. Hydrobiologia 346, 157–168 (Résumé, en anglais)
- Fukuhara, H. and Sakamoto, M. (1987) Enhancement of inorganic nitrogen and phosphate release from lake sediment by tubificid worms and chironomid larvae. Oikos 48, 312–320 (Résumé, en anglais).
- Gallep, G.W., Kitchell, J.F. and Barte, S.M. (1978) Phosphorus release from lake sediments as affected by chironomids. Verh. Internat. Verein. Limnol. 20, 458–465
- Van de Bund, W. J., W. Goedkoop & R. K. Johnson, 1994. Effects of depositfeeder activity on bacterial production and abundance in profundal lake sediment. J. North am. Benthol. Soc. 13: 532–539 (résumé)
- Svensson, J. M. & L. Leonardson, 1996. Effects of bioturbation by tube dwelling chironomid larvae on oxygen uptake and denitrification in eutrophic lake sediments. Freshwat. Biol. 35: 289–300
- (en) « Muckleheads »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) from Andre's Weather World (Andre Bernier, staff at WJW-TV), June 2, 2007
- (en) You don't love muffleheads, but Lake Erie does, Sandusky Register, May 29, 2007.
- Pierre Aubry, Bernard-Alex Gaüzère, « Choléra, Actualités 2020 », Centre René Labusquière, Institut de Médecine Tropicale, Université de Bordeaux, mise à jour le 15/09/2020 (lire en ligne)
- (en) Gandouin E, Ponel P, Franquet E, Van Vliet-Lanoë B, Andrieu-Ponel V, Keen DH, Brulhet J, Brocandel M 2007 Chironomid responses to Younger Dryas and Holocene environmental changes in a river floodplain from northern France (Saint-Momelin, Bassin de Saint-Omer) The Holocene 17(3):331-34, DOI: 10.1177/0959683607076447
Liens externes
Bibliographie
- Armitage, P., Cranston, P.S., and Pinder, L.C.V. (eds.) (1994) The Chironomidae: Biology and Ecology of Non-biting Midges. Chapman and Hall, London, 572 p.
- Van de Bund, W. J., W. Goedkoop & R. K. Johnson, 1994. Effects of depositfeeder activity on bacterial production and abundance in profundal lake sediment. J. North am. Benthol. Soc. 13: 532–539 (résumé)
- Kim Hansen, Steen Mouridsen & Erik Kristensen, The impact of Chironomus plumosus larvae on organic matter decay and nutrient (N, P) exchange in a shallow eutrophic lake sediment following a phytoplankton sedimentation; Hydrobiologia 364: 65–74, 1998. 65 H. L. Golterman (ed.), SedimentWater Interaction 8. c 1998 Kluwer Academic Publishers. Printed in Belgium.
- Portail de l’aquariophilie
- Portail de la biologie
- Portail de l’entomologie