الفا-2-ماكروغلوبين
alpha-2-Macroglobulin (α2M) هو بروتين بلازما كبير (720 KDa) موجود في الدم.[1][2] يتم إنتاجه بشكل أساسي عن طريق الكبد، ويتم تصنيعه محليًا أيضًا بواسطة الخلايا الضامة والخلايا الليفية وخلايا قشر الكظ في البشر يتم ترميزه بواسطة جين.A2M
| Alpha-2-macroglobulin | |||||||
|---|---|---|---|---|---|---|---|
| المعرفات | |||||||
| الأسماء المستعارة | alpha-2-macroglobulin, C3 and PZP-like alpha-2-macroglobulin domain-containing protein 5, A2M, alpha-2-M | ||||||
| معرفات خارجية | |||||||
| أورثولوج | |||||||
| الأنواع | الإنسان | الفأر | |||||
| أنتريه | n/a | ||||||
| Ensembl | n/a | n/a | |||||
| يونيبروت |
|
| |||||
| RefSeq (مرسال ر.ن.ا.) |
|
| |||||
| RefSeq (بروتين) |
|
| |||||
| الموقع (UCSC | n/a | ||||||
| بحث ببمد | n/a | ||||||
| ويكي بيانات | |||||||
| |||||||
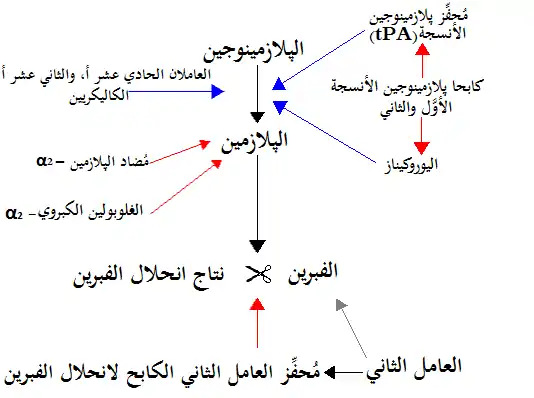
يعمل Alpha 2 macroglobulin كمضاد للبروتينات وهو قادر على تعطيل مجموعة هائلة من البروتينات. وهو يعمل كمثبط لانحلال الفبرين عن طريق تثبيط البلازمين والكاليكرين حيث ان البلازميت هو انزيم يتشكل في الدم في بعض الظروف، ويدمر جلطات الدم بمهاجمة الفيبرين والكاليكرين هي مجموعة فرعية من سيرين بروتياز، وهي إنزيمات قادرة على شق روابط الببتيد في البروتينات.
يعمل Alpha 2 macroglobulin كمثبط للتخثر عن طريق تثبيط الثرومبين. قد يعمل Alpha-2-macroglobulin كبروتين حامل لأنه يرتبط أيضًا بالعديد من عوامل النمو والسيتوكينات، مثل عامل النمو المشتق من الصفائح الدموية وعامل نمو الخلايا الليفية الأساسية و، TGF-β -والأنسولين و IL-1β.
لم يتم التعرف على نقص محدد مع المرض المصاحب، ولا تعزى أي حالة مرضية إلى التركيزات المنخفضة من alpha-2-macroglobulin. يرتفع تركيز alpha-2-macroglobulin 10 أضعاف أو أكثر في المتلازمة الكلوية عند فقدان بروتينات أخرى ذات وزن جزيئي منخفض في البول. يتم منع فقدان alpha-2-macroglobulin في البول بسبب حجمه الكبير. والنتيجة النهائية هي أن alpha-2-macroglobulin يصل إلى مستويات مصلية تساوي أو تزيد عن مستويات الألبومين في المتلازمة الكلوية، والتي لها تأثير في الحفاظ على ضغط الأورام
بناء
يتكون alpha-2-macroglobulin البشري من أربع وحدات فرعية متطابقة مرتبطة ببعضها البعض بواسطة روابط -S-S- بالإضافة إلى الأشكال الرباعية من alpha-2-macroglobulin .
في الآونة الأخيرة تم تحديد مثبطات الأنزيم البروتيني مونومري إيه ام (aM)
يتكون كل مونومر من alpha-2-macroglobulin البشري من عدة مجالات وظيفية، بما في ذلك مجالات macroglobulin ومجال يحتوي على thiol ester وهو المكون الرئيسي للجهاز المناعي الفطري للمفصليات ومجال ربط المستقبلات. بشكل عام، يعد alpha-2-Macroglobulin أكبر بروتين غير غلوبولين غير مناعي في البلازما البشرية
تبين أن تسلسل الأحماض الأمينية لـ alpha-2-macroglobulin هو 71٪ نفس تسلسل بروتين منطقة الحمل.
وظيفة
تشتمل عائلة البروتينات alpha-macroglobulin(aM) على مثبطات الأنزيم البروتيني، المُصنَّفة بواسطة رباعي البروتين البشري alpha-2-macroglobulin(a2M)؛ الذين ينتمون إلى عائلة مثبطات بروتين MEROPS I39. تشترك مثبطات الأنزيم البروتيني في العديد من الخصائص المحددة، والتي تشمل:
(1) القدرة على تثبيط البروتياز من جميع الفئات التحفيزية،
(2) وجود «منطقة طعم» (المعروف أيضًا باسم سلسلة من الأحماض الأمينية في جزيء α2-macroglobulin ، أو بروتين متماثل، يحتوي على روابط ببتيد مقصية لتلك البروتينات التي تثبطها) وإستر ثيول،
(3) آلية مثبطة للبروتياز مماثلة
(4) تعطيل القدرة التثبيطية عن طريق تفاعل إستر الثيول مع الأمينات الأولية الصغيرة.
مثبطات إنزيم البروتياز aM تمنع بواسطة العائق الفراغي (steric hindrance) وهو تباطؤ التفاعلات الكيميائية بسبب الحجم الفراغي
تتضمن الآلية انقسام البروتياز في منطقة الطُعم، وهو جزء من aM ويكون عرضة بشكل خاص للانقسام المُحلل للبروتين، والذي يبدأ تغييرًا بحيث ينهار ال aM حول البروتياز.
في المركب aM-protease الناتج، يكون الموقع النشط للبروتياز محميًا، وبالتالي يقلل بشكل كبير من الوصول إلى ركائز البروتين. يحدث حدثان إضافيان نتيجة لانقسام منطقة الطعم، وهما:
(1) يصبح إستر h-cysteinyl-g-glutamyl thiol شديد التفاعل
(2) يؤدي التغيير المطابق إلى الكشف عن مجال ربط مستقبلات COOH المحمي، يسمح انكشاف خلايا الدم الحمراء لمركب البروتياز aM بالالتزام بمستقبلات التصفية وإزالته من الدورة الدموية.
تم التعرف حديثا على مثبطات الأنزيم البروتيني رباعي والثنائي ومؤخرا على أحادي الأنزيم البروتيني.aM
alpha-2-Macroglobulin قادر على تعطيل مجموعة هائلة من البروتينات (بما في ذلك السيرين، السيستين، الأسبارتيك، والبروتينات المعدنية). وهو يعمل كمثبط لانحلال الفبرين عن طريق تثبيط البلازمين والكاليكرين وهو يعمل كمثبط للتخثر عن طريق تثبيط الثرومبين.
يحتوي Alpha-2-macroglobulin في تركيبته على 35 منطقة «طعم» من الأحماض الأمينية. تصبح البروتينات التي ترتبط في منطقة الطعم مرتبطة بـ α2M ويتم التعرف على مركب بروتيناز α2M بواسطة مستقبلات البلعمة وهي جموعة واسعة من مستقبلات غشاء البلازما التي تتوسط تفاعلاتها مع المكونات الذاتية الطبيعية والمتغيرة للمضيف بالإضافة إلى مجموعة من الكائنات الحية الدقيقة، ومن ثم يتم تطهيره من النظام.
من المعروف أن alpha-2-Macroglobulin يربط الزنك، وكذلك النحاس في البلازما، بقوة أكبر من الألبومين، ويعرف هذا أيضًا باسم transcuprein. 10-15٪ من النحاس في بلازما الإنسان مخلّب بواسطة alpha-2-macroglobulin
مرض
عندما تنخفض مستويات الألبومين في الدم وهو عادة ما نلاحظه alpha-2-Macroglobulin تزداد مستويات
و الأكثر شيوعا في المتلازمة الكلوية، اذ ان المتلازمة الكلوية تعرف بأنها حالة تبدأ فيها الكلى بتسريب بعض البروتينات الاصغر في الدم.
في مجرى الدم وذلك بسبب حجمه. alpha-2-Macroglobulin يتم الاحتفاظ ب
و ذلك بسبب زيادة إنتاج جميع البروتينات وان هذه الزيادة لها تأثير alpha-2- Macroglobulin يزداد تركيز
سلبي ضئيل على الصحة، ولكنها تستخدم كدليل تشخيصي.من الممكن أن يؤدي الفشل الكلوي المزمن طويل الأمد إلى ظهور الأميلويد ويكون ذلك بواسطة alpha-2-Macroglbulin .
هنالك نوع شائع من alpha-2-macroglobulin (polymorphism) يؤدي إلى زيادة خطر الإصابة بمرض الزهايمرز
يرتبط alpha-2-macroglobulin ب (gelatinase (MMP-2 and MMP ويزيل الاشكال النشطة منه من الدورة الدموية عبر مستقبلات سكافنجر وهي نوع من المستقبلات على الفاقوسيتات وهي الخلايا التي تحمي الجسم عن طريق تناول الجسيمات الضارة والبكتيريا والخلايا الميتة.
المراجع
- "معلومات عن الفا-2-ماكروغلوبين على موقع ncbi.nlm.nih.gov"، ncbi.nlm.nih.gov، مؤرشف من الأصل في 24 نوفمبر 2020.
- "معلومات عن الفا-2-ماكروغلوبين على موقع rcsb.org"، rcsb.org، مؤرشف من الأصل في 28 فبراير 2021.
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الأحياء الدقيقة