الوزن المتساوي
الوزن المكافئ (المعروف أيضا باسم مكافئ الجرام) هو كتلة مكافئ واحد، أي كتلة مادة معينة تتحد مع أو تحل محل كمية ثابتة من مادة أخرى.[1] الوزن المكافئ للعنصر هو الكتلة التي تتحد مع أو تحل محل 1.008 غرام من الهيدروجين أو 8.0 غرام من الأكسجين أو 35.5 غرام من الكلور. تتوافق هذه القيم مع الوزن الذري مقسوما على التكافؤ المعتاد؛ للأكسجين كمثال هو 16.0 جم / 2.
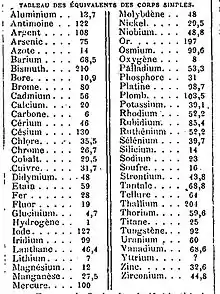
بالنسبة لتفاعلات الحمض القاعدي، فإن الوزن المكافئ للحمض أو القاعدة هو الكتلة التي تزود أو تتفاعل مع مول واحد من كاتيونات الهيدروجين (H+
). بالنسبة لتفاعلات الأكسدة والاختزال، فإن الوزن المكافئ لكل مادة متفاعلة يزود أو يتفاعل مع مول واحد من الإلكترونات (e−) في تفاعل الأكسدة والاختزال.
الوزن المكافئ له أبعاد ووحدات الكتلة، على عكس الوزن الذري، الذي لا أبعاد له. تم تحديد الأوزان المكافئة في الأصل عن طريق التجربة، ولكن (بقدر ما لا تزال تستخدم) مشتقة الآن من الكتل المولية. بالإضافة إلى ذلك، يمكن حساب الوزن المكافئ للمركب عن طريق قسمة الكتلة الجزيئية على عدد الشحنات الكهربائية الموجبة أو السالبة التي تنتج عن انحلال المركب.
في التاريخ:
تم نشر أول أوزان مكافئة للأحماض والقواعد من قبل كارل فريدريش وينزل في عام 1777. تم إعداد مجموعة أكبر من الجداول، ربما بشكل مستقل، من قبل Jeremias Benjamin Richter ، بدءا من عام 1792. ومع ذلك، لم يكن لدى Wenzel ولا Richter نقطة مرجعية واحدة لجدولهم، وبالتالي كان عليهم نشر جداول منفصلة لكل زوج من الحمض والقاعدة.
اقترح جدول جون دالتون الأول للأوزان الذرية (1808) نقطة مرجعية، على الأقل للعناصر: أخذ الوزن المكافئ للهيدروجين ليكون وحدة واحدة من الكتلة. ومع ذلك، كانت نظرية دالتون الذرية بعيدة كل البعد عن القبول العالمي في أوائل القرن التاسع عشر. واحدة من أكبر المشاكل كانت تفاعل الهيدروجين مع الأكسجين لإنتاج الماء. يتفاعل غرام واحد من الهيدروجين مع ثمانية غرامات من الأكسجين لإنتاج تسعة غرامات من الماء، لذلك تم تعريف الوزن المكافئ للأكسجين على أنه ثمانية غرامات. بما أن دالتون افترض (بشكل غير صحيح) أن جزيء الماء يتكون من ذرة هيدروجين واحدة وذرة أكسجين واحدة، فإن هذا يعني وجود وزن ذري للأكسجين يساوي ثمانية. ومع ذلك، معربا عن التفاعل من حيث أحجام الغاز بعد قانون غاي-لوساك للجمع بين أحجام الغاز، يتفاعل مجلدان من الهيدروجين مع حجم واحد من الأكسجين لإنتاج مجلدين من الماء، مما يشير (بشكل صحيح)إلى أن الوزن الذري للأكسجين هو ستة عشر. ساعد عمل تشارلز فريدريك جيرهارد (1816-56) وهنري فيكتور ريجنو (1810-78) وستانيسلاو كانيزارو (1826-1910) على ترشيد هذا والعديد من المفارقات المماثلة، لكن المشكلة كانت لا تزال موضوع نقاش في مؤتمر كارلسروه (1860).ومع ذلك، وجد العديد من الكيميائيين أن الأوزان المكافئة أداة مفيدة حتى لو لم يشتركوا في النظرية الذرية. كانت الأوزان المكافئة تعميما مفيدا لقانون جوزيف بروست ذي النسب المحددة (1794) الذي مكن الكيمياء من أن تصبح علما كميا. أصبح الكيميائي الفرنسي جان بابتيست دوماس (1800-84) أحد المعارضين الأكثر تأثيرا للنظرية الذرية، بعد أن احتضنها في وقت سابق من حياته المهنية، لكنه كان مؤيدا قويا للأوزان المكافئة.
بقدر ما تم وضع الجداول الذرية جزئيا وفقا لقوانين Wenzel و Richter ، جزئيا من خلال التكهنات البسيطة، فقد تركوا الكثير من الشكوك في أفضل العقول. كان من أجل الهروب من هذه المشكلة أنه تم محاولة استنتاج الأوزان الذرية من كثافة العناصر في حالة البخار، من حرارتها المحددة، من شكلها البلوري. لكن يجب ألا ينسى المرء أن قيمة الأرقام المستخلصة من هذه الخصائص ليست في الأقل مطلقة-لتلخيص، ما الذي تبقى من هذه الرحلة الطموحة التي سمحنا لأنفسنا في عالم الذرات؟ لا شيء، لا شيء ضروري على أقل تقدير. ما تركناه هو الاقتناع بأن الكيمياء فقدت نفسها هناك، كما تفعل دائما عندما تتخلى عن التجربة، حاولت المشي دون دليل من خلال الظلال. مع التجربة كدليل، تجد مكافئات Wenzel ، مكافئات Mitscherlich ، فهي ليست سوى مجموعات جزيئية. إذا كانت لدي القوة، فسأمحو كلمة «ذرة» من العلم، وأقنع بأنها تتجاوز أدلة التجربة؛ وفي الكيمياء، يجب ألا نتجاوز أبدا أدلة التجربة.
- جان بابتيست دوماس، محاضرة في كوليج دو فرانس، 1843/44[6]
الأوزان المكافئة لم تكن خالية من مشاكل خاصة بهم. في البداية، لم يكن المقياس القائم على الهيدروجين عمليا بشكل خاص، حيث أن معظم العناصر لا تتفاعل مباشرة مع الهيدروجين لتشكيل مركبات بسيطة. ومع ذلك، يتفاعل غرام واحد من الهيدروجين مع 8 غرامات من الأكسجين لإعطاء الماء أو مع 35.5 جرام من الكلور لإعطاء كلوريد الهيدروجين: وبالتالي يمكن أخذ 8 غرامات من الأكسجين و 35.5 جرام من الكلور لتكون مكافئة لغرام واحد من الهيدروجين لقياس الأوزان المكافئة. يمكن تمديد هذا النظام أكثر من خلال الأحماض والقواعد المختلفة.[6]
أكثر خطورة كانت مشكلة العناصر التي تشكل أكثر من أكسيد واحد أو سلسلة من الأملاح، والتي لها (في المصطلحات اليوم) حالات أكسدة مختلفة. سوف يتفاعل النحاس مع الأكسجين لتشكيل إما أكسيد الطوب الأحمر (أكسيد النحاس (i)، مع 63.5 غرام من النحاس لـ 8 غرام من الأكسجين)أو أكسيد الكوبريك الأسود (أكسيد النحاس (II)، مع 32.7 غرام من النحاس لـ 8 غرام من الأكسجين)، وبالتالي لديه أوزان مكافئة. يمكن أن يلجأ مؤيدو الأوزان الذرية إلى قانون Dulong–Petit (1819)، الذي يربط الوزن الذري لعنصر صلب بقدرته الحرارية المحددة، للوصول إلى مجموعة فريدة لا لبس فيها من الأوزان الذرية.[6] معظم مؤيدي الأوزان المكافئة—التي كانت الغالبية العظمى من الكيميائيين قبل 1860—تجاهلوا ببساطة الحقيقة غير المريحة المتمثلة في أن معظم العناصر عرضت أوزان مكافئة متعددة. بدلا من ذلك، استقر هؤلاء الكيميائيون على قائمة بما يسمى عالميا «المكافئات» (H = 1، O = 8، C = 6، S = 16، Cl = 35.5، Na = 23، Ca = 20، وما إلى ذلك). ومع ذلك، فإن هذه «المعادلات» في القرن التاسع عشر لم تكن مكافئات بالمعنى الأصلي أو الحديث للمصطلح. نظرا لأنها تمثل أرقاما لا أبعاد لها بالنسبة لأي عنصر معين كانت فريدة وغير متغيرة، فقد كانت في الواقع مجرد مجموعة بديلة من الأوزان الذرية، حيث تحتوي عناصر التكافؤ المتساوي على أوزان ذرية نصف القيم الحديثة. لم يتم التعرف على هذه الحقيقة حتى وقت لاحق.[9]
كانت ضربة الموت الأخيرة لاستخدام الأوزان المكافئة للعناصر هي عرض ديمتري مندليف لجدوله الدوري في عام 1869، حيث ربط الخصائص الكيميائية للعناصر بالترتيب التقريبي لأوزانها الذرية. ومع ذلك، استمر استخدام الأوزان المكافئة للعديد من المركبات لمدة مائة عام أخرى، خاصة في الكيمياء التحليلية. يمكن جدولة الأوزان المكافئة للكواشف الشائعة، تبسيط الحسابات التحليلية في الأيام التي سبقت توافر الآلات الحاسبة الإلكترونية على نطاق واسع: كانت هذه الجداول شائعة في كتب الكيمياء التحليلية.
الاستعمالات في الكيمياء العامه:
كانت ضربة الموت الأخيرة لاستخدام الأوزان المكافئة للعناصر هي عرض ديمتري مندليف لجدوله الدوري في عام 1869، حيث ربط الخصائص الكيميائية للعناصر بالترتيب التقريبي لأوزانها الذرية. ومع ذلك، استمر استخدام الأوزان المكافئة للعديد من المركبات لمدة مائة عام أخرى، خاصة في الكيمياء التحليلية. يمكن جدولة الأوزان المكافئة للكواشف الشائعة، تبسيط الحسابات التحليلية في الأيام التي سبقت توافر الآلات الحاسبة الإلكترونية على نطاق واسع: كانت هذه الجداول شائعة في كتب الكيمياء التحليلية.
الاستخدام في التحليل الحجمي:
عند اختيار المعايير الأساسية في الكيمياء التحليلية، تكون المركبات ذات الأوزان المكافئة الأعلى مرغوبة بشكل عام بسبب تقليل أخطاء الوزن. مثال على ذلك هو التوحيد الحجمي لمحلول هيدروكسيد الصوديوم الذي تم إعداده إلى حوالي 0.1 مول دم-3. من الضروري حساب كتلة الحمض الصلب الذي سيتفاعل مع حوالي 20 سم 3 من هذا المحلول (للمعايرة باستخدام بوريت 25 سم 3): تشمل الأحماض الصلبة المناسبة ثنائي هيدرات حمض الأكساليك وفثالات هيدروجين البوتاسيوم ويودات هيدروجين البوتاسيوم. الأوزان المكافئة للأحماض الثلاثة 63.04 g و 204.23 g و 389.92 g على التوالي، والكتل المطلوبة للتوحيد هي 126.1 mg و 408.5 mg و 779.8 mg على التوالي. وبالنظر إلى أن عدم اليقين في القياس في الكتلة المقاسة على توازن تحليلي قياسي هو ±0.1 ملغ، فإن عدم اليقين النسبي في كتلة ثنائي هيدرات حمض الأكساليك سيكون حوالي جزء واحد في الألف، على غرار عدم اليقين في القياس في قياس الحجم في المعايرة.[12] ومع ذلك، فإن عدم اليقين في قياس كتلة يودات الهيدروجين البوتاسيوم سيكون أقل بخمس مرات، لأن وزنه المكافئ أعلى بخمس مرات: وهذا عدم اليقين في الكتلة المقاسة لا يكاد يذكر بالمقارنة مع عدم اليقين في الحجم المقاس أثناء المعايرة (انظر المثال أدناه).
على سبيل المثال، يجب أن يفترض أن 22.45±0.03 سم3 من محلول هيدروكسيد الصوديوم يتفاعل مع 781.4±0.1 ملغ من البوتاسيوم الهيدروجينية يودات. بما أن الوزن المكافئ لليودات الهيدروجينية للبوتاسيوم هو 389.92 جم، فإن الكتلة المقاسة هي 2.004 milliequivalents. وبالتالي فإن تركيز محلول هيدروكسيد الصوديوم هو 2.004 meq / 0.02245 l = 89.3 meq / l. في الكيمياء التحليلية، يعرف محلول أي مادة تحتوي على مكافئ واحد لكل لتر بمحلول طبيعي (مختصر N)، لذلك سيكون محلول هيدروكسيد الصوديوم على سبيل المثال 0.0893 N. [3] [13] يمكن تقدير عدم اليقين النسبي (ur) في التركيز المقاس بافتراض التوزيع الغاوسي لشكوك القياس:
مراجع
- "معلومات عن الوزن المتساوي على موقع britannica.com"، britannica.com، مؤرشف من الأصل في 3 مايو 2021.
- بوابة الكيمياء