نحاس
النحاس عنصرٌ كيميائي رمزه Cu وعدده الذرّي 29، وهو ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة الحادية عشرة في الجدول الدوري؛ ويصنّف كيميائياً ضمن الفلزّات الانتقالية. للنحاس لون بني محمر مميز، والذي ينسب إليه اللون النحاسي. النحاس فلز طري ومطواع وقابل للسحب والطرق؛ ويمتاز بأنه موصل جيد للكهرباء وناقل جيد للحرارة. يعد النحاس من الفلزات القليلة التي يمكن أن توجد في الطبيعة على شكلها الحر، ولكنه يدخل أيضاً في تركيب عدد من المعادن في القشرة الأرضية، ومنها الآزوريت والمالاكيت والفيروز، ولتلك المعادن استخدامات تاريخية في مجال الزينة وصناعة الخضب.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أحمر برتقالي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | نحاس، 29، Cu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 11، 4، d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 63.546 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d10 4s1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 1 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 8.94 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 8.02 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1357.77 ك، 1084.62 °س، 1984.32 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 2835 ك، 2562 °س، 4643 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 13.26 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 300.4 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 24.440 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | +1, +2, +3, +4 (أكاسيده قاعدية ضعيفة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.90 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 745.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1957.9 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3555 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 128 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±132 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 140 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 16.78 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 401 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 16.5 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) (مخمّر) 3810 متر·ثانية−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 110–128 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 48 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 140 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 3.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 369 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 874 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-50-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر النحاس | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
عرف الإنسان النحاس وتعامل به منذ التاريخ القديم في عدد من مناطق العالم؛ وكان أول فلز تمكن الإنسان من صهره وسكه في قوالب، وذلك في الفترة التاريخية بين 5000 إلى 4000 سنة قبل الميلاد، وتعرف تلك الحقبة التاريخية باسم «العصر النحاسي». أدى سبك النحاس مع القصدير إلى الحصول على سبيكة البرونز حوالي سنة 3500 سنة قبل الميلاد؛ وكانت تلك أيضاً مرحلة محددة في التاريخ البشري، والتي يشار إليها باسم «العصر البرونزي». في روما القديمة كان النحاس يعدن بشكل أساسي من جزيرة قبرص، وذلك الأمر منحه الاسم اللاتيني cuprum، ومنه يشتق الرمز الكيميائي لهذا العنصر.
يدخل النحاس في عدة تطبيقات مثل صناعة الأسلاك الكهربائية وأجهزة القياس، وفي صناعة السبائك، وفي سك النقود المعدنية وصياغة المجوهرات وفي الفنون زخرفية. كما يدخل النحاس ضمن مواد البناء، وكانت صفائح النحاس مستخدمة بشكل كبير لإكساء أسطح وقبب المباني، والتي عندما تتأكسد تتحول إلى زنجار (أو صدأ النحاس) المتميز باللون الأخضر. تستخدم مركبات النحاس بشكل واسع من أجل كبح البكتريا وإبادة الفطريات وفي مجال حفظ الخشب.
للنحاس دور حيوي مهم، فهو يصنف ضمن العناصر المعدنية المهمة للتغذية، لكونه ضرورياً لعمل بعض الإنزيمات، مثل إنزيم سيتوكروم سي أكسيداز المهم لعمليات تنفس الخلايا؛ كما يعد النحاس مكوناً من مكونات خضاب الدم هيموسيانين في بعض الكائنات الحية مثل الرخويات والقشريات. يحوي الإنسان وسطياً ما بين 1.5 إلى 2 ميليغرام من النحاس لكل كيلوغرام من وزن الجسم، وهو يتركز في الكبد والعضلات والعظام.
التاريخ

يصنف النحاس ضمن أقدم الفلزات التي اكتشفها الإنسان القديم واستخدمها في حياته اليومية في مختلف الحضارات في تاريخ البشرية.[1]
العصور القديمة
- العصر النحاسي
عرف الإنسان النحاس منذ القدم، لأنه من الممكن العثور على هذا الفلز بشكله الطبيعي الحر على سطح الأرض؛ لذلك يصنف ضمن أقدم الفلزات المكتشفة إلى جانب الذهب والحديد النيزكي.[2] تعود أقدم السجلات التاريخية للنحاس إلى حوالي 9000 سنة قبل الميلاد في منطقة الشرق الأوسط.[3] إذ عثر في منطقة بلاد الرافدين في شمالي العراق على حلية متدلية نحاسية يعود تاريخها إلى 8700 سنة قبل الميلاد.[4] مر تاريخ تعدين النحاس بعدة مراحل، إذ في البداية خضع النحاس الطبيعي لعمليات تشغيل على البارد [ملاحظة 2]؛ ثم بمرحلة التلدين [ملاحظة 3]؛ ثم بمرحلة الصهر [ملاحظة 4]؛ وأخيراً بمرحلة السبك بالشمع المفقود [ملاحظة 5]. كانت تلك المراحل الأربع حاضرة في جنوبي شرقي الأناضول في فترة العصر الحجري الحديث حوالي 7500 سنة قبل الميلاد.[5] على العموم تسمى الحقبة التاريخية الواقعة في أواخر العصر الحجري الحديث [ملاحظة 6] والمتقاطعة مع أوائل العصر البرونزي [ملاحظة 7] باسم «العصر النحاسي» [ملاحظة 8]، وتلك فترة تقع بين الألفية الخامسة قبل الميلاد والألفية الثالثة قبل الميلاد، وسميت بذلك لانتشار الاكتشافات الأثرية لأدوات مصنوعة من النحاس تعود إلى تلك الحقبة التاريخية.[6] من بين تلك الاكتشافات الأثرية ما عثر عليه في منطقة حجيرة الغزلان في الأردن، إذ وجدت شواهد تدل على إنتاج النحاس هناك والاتجار به في المنطقة.[7]

كانت المرحلة التاريخية التي تمكن الإنسان فيها من صهر النحاس فاصلة ومهمة في التاريخ البشري، وقد اكتشفت عدة مواقع أثرية في العالم بالإضافة إلى منطقة الشرق الأوسط تشير إلى هذه الممارسة؛ وذلك في الصين وأمريكا الوسطى وغرب أفريقيا؛[8] وكذلك في جنوب شرق آسيا حيث عثر على مشغولات نحاسية مصنوعة وفق أسلوب السبك الدقيق [ملاحظة 9] تعود إلى الفترة ما بين 4000-4500 سنة قبل الميلاد.[3] عثر في جبال الألب على مومياء تعود إلى رجل الجليد أوتزي [ملاحظة 10]، والذي عاش في حقبة العصر النحاسي بين 3300 إلى 3200 قبل الميلاد، وكان معه نصل فأس مصنوع من النحاس بنقاوة 99.7%؛ وتشير المستويات المرتفعة من الزرنيخ في شعره إلى عمله ومساهمته في صهر النحاس.[9] ساعدت الخبرة المكتسبة من صهر النحاس في تطور تعدين فلزات أخرى، وخاصة في استخراج الحديد ضمن أفران النَّوْرات [ملاحظة 11]؛[9] كما كان صهر النحاس مقدمة لسبكه مع القصدير للحصول على البرونز، الأمر الذي كان فاتحة لدخول العصر البرونزي.[10]
- العصر البرونزي
كان البرونز الزرنيخي [ملاحظة 12] أول أشكال البرونز التي تمكن الإنسان من تحضيره في الألفية الخامسة قبل الميلاد،[11] إذ أن الزرنيخ يرافق النحاس بشكل طبيعي في خاماته.[12] أما ممارسة سبك النحاس مع القصدير للحصول على البرونز فقد بدأت في الألفية الرابعة قبل الميلاد،[13] ثم تأصلت في الاستخدام البشري لإنتاج مستلزمات الحياة اليومية في أواخر الألفية الثالثة قبل الميلاد.[14] عثر على قطع أثرية عمرها يتجاوز 4500 سنة تعود إلى حضارة الفينكا [ملاحظة 13]؛[15] كما عثر في المنطقة العربية على قطع أثرية من النحاس والبرونز صنعت حوالي 3000 سنة قبل الميلاد أثناء حضارتي سومر ومصر القديمة.[16] مثلت تلك الفترة التاريخية ما يعرف باسم «العصر البرونزي»، وقد انتهت مع بداية العصر الحديدي [ملاحظة 14]، وتتفاوت مدتها مع اختلاف الموقع الجغرافي، إذ انتهى العصر البرونزي في الشرق الأدنى في الفترة ما بين 2000-1000 سنة قبل الميلاد،[17] وفي شمال أوروبا حوالي 600 سنة قبل الميلاد.[18]
- العصور القديمة المتأخرة
عرف اليونانيون القدماء النحاس، وكان معروفاً باسم «خالكوس» [ملاحظة 15]؛ كما مثل النحاس سلعة مهمة بالنسبة للرومان القدماء أيضاً، وكان معروفاً عندهم باسم aes Cyprium، حيث يشير مقطع aes إلى مصطلح لاتيني عام يخص سبائك النحاس، أما مقطع Cyprium فيدل على جزيرة قبرص، حيث كان يستخرج بشكل أساسي من هناك. مع مرور الوقت بسطت الكلمة إلى Cuprum. أمر الأباطرة الرومان مثل يوليوس قيصر [ملاحظة 16] وأغسطس [ملاحظة 17] باستخدام النحاس وسبائكه مثل النحاس الأصفر في سك العملات المعدنية الرومانية؛ وكانت ولايات قبرص وهسبانيا [ملاحظة 18] ووسط أوروبا من أكثر المناطق التي استخرج الرومان النحاس فيها.[19][20]
.svg.png.webp)
العصور الوسطى
اقترن النحاس في أوروبا بالآلهة فينوس [ملاحظة 19]، وكان رمز فينوس مستخدماً على هيئة رمز خيميائي في المخطوطات للإشارة إلى هذا العنصر؛ وكان يظن أن النحاس ناتج عن تفاعل الزئبق والكبريت.[21] من جهة أخرى، ساهم العلماء في عصر الحضارة الإسلامية في دراسة النحاس وتصنيفه، وتمكنوا من تحضير مركباته؛ كما انتشرت المواقع والأسواق التجارية التي اشتهرت بصناعة النحاس، مثل مدينة الإسكندرية، التي اشتهرت منذ القدم بإنتاج وتصنيع البرونز الكورنثي [ملاحظة 20].[22]
تمكن الأمريكيون الأصليون من استخراج النحاس، حيث عثر على مكتشفات أثرية في مواقع قريبة من متنزه آيل رويال الوطني [ملاحظة 21] تعود إلى الفترة التاريخية الواقعة بين 800 إلى 1600 سنة للميلاد.[23] كما تمكن سكان أمريكا الجنوبية الأصليون من سبك النحاس والذهب في سبيكة كانت معروفة باسم «تمباغا» [ملاحظة 22].[24]
العصور الحديثة

كان منجم فالون [ملاحظة 23] الواقع في السويد مصدراً رئيسياً لاستخراج النحاس في أوروبا، وقد بدأ التعدين فيه منذ القرن العاشر، إلى أن توقف العمل فيه أواخر القرن العشرين (سنة 1992). أمن هذا المنجم لوحده حوالي ثلثي حاجة السوق في أوروبا من النحاس في القرن السابع عشر، كما ساعد بشكل كبير في تمويل حملات السويد العسكرية حينها.[25] مثل النحاس بالنسبة للسويد خامة إستراتيجية، وكان غطاءً لعملتها، والتي كانت في الفترة ما بين سنتي 1644 إلى 1768 على هيئة صفيحة نقدية نحاسية [ملاحظة 24].[26]

من التطبيقات الأولى للنحاس في العصر الحديث استخدامه في الأشكال الأولى من التصوير المعروف باسم فن الحفر على النحاس [ملاحظة 25] ولاحقاً في تصوير داجيرية [ملاحظة 26]، وكذلك في سك العملة؛ كما شاع استخدمه في إنشاء التماثيل، كما هو الحال في تمثال الحرية مثلاً، بالإضافة إلى استخدامه في إكساء سقوف وقبب العمارات،[6] وكذلك في الإنشاءات مثل التصفيح [ملاحظة 27] والتغميد بالنحاس [ملاحظة 28].[27] كانت منشأة تنقية الفلزات شمالي ألمانيا [ملاحظة 29] في مدينة هامبورغ (المعروفة حالياً باسم آوروبيس [ملاحظة 30] أول وأكبر منشأة للطلي الكهربائي [ملاحظة 31] في أوروبا، وكان الإنتاج فيها قد بدأ سنة 1876.[28]
بعد دخول عصر الكهرباء منذ أواخر القرن التاسع عشر ازداد الطلب بشكل كبير على النحاس، وذلك لاستخدامه في التمديدات الكهربائية؛ وكانت الولايات المتحدة الأمريكية من الدول الرائدة في إنتاج النحاس لتأمين حاجة السوق.[29][30] مع مرور الوقت تطورت وسائل استخراج وإنتاج النحاس، ففي سنة 1949 تمكنت شركة أوتوكمبو [ملاحظة 32] الفنلندية من ابتكار عملية الصهر الومضي [ملاحظة 33] المتميزة بكفائتها.[31] في سنة 1967 قامت كل من تشيلي والبيرو وجمهورية الكونغو الديمقراطية وزامبيا بتأسيس (المجلس الحكومي للدول المصدّرة للنحاس [ملاحظة 34] من أجل التحكم بسوق النحاس، بشكل مماثل لما تقوم به منظمة أوبك في سوق النفط، إلا أنه لم يكتب لهذا المجلس طول الاستمرار، إذ انحل في سنة 1988.[32]
الوفرة الطبيعية
يصنف النحاس ضمن العناصر التي تتخلق في النجوم العملاقة.[33] أما في القشرة الأرضية فيوجد النحاس بنسبة تصل إلى 50 جزء في المليون [ملاحظة 35]،[34] وبذلك يأتي في المرتبة الخامسة والعشرين بالنسبة للوفرة الطبيعية فيها.[34] من الممكن العثور على النحاس في بعض الأحيان بشكله الطبيعي الحر من غير ارتباط مع عناصر كيميائية أخرى. يوجد النحاس الطبيعي غالباً في الحمم البازلتية أما على هيئة قطع [ملاحظة 36] من صبات متكتلة أو على شكل متفرع، فيما يدعى باسم التغصن البلوري [ملاحظة 37].[35] تشير بعض المصادر إلى أن وزن أكبر كتلة من النحاس الطبيعي قد بلغ 420 طن، وكان قد عثر عليها سنة 1857 في ولاية ميشيغان الأمريكية.[34] للنحاس الطبيعي بنية حبيبة بلّورية، ولكن أكبر بلورة أحادية [ملاحظة 38] كانت قد بلغت أبعادها 4.4×3.2×3.2 سم.[36]
 قطع كتلية من النحاس الطبيعي
قطع كتلية من النحاس الطبيعي تغصن بلوري للنحاس الطبيعي
تغصن بلوري للنحاس الطبيعي بلورات مكعبة من النحاس الطبيعي
بلورات مكعبة من النحاس الطبيعي

ولكن على الأغلب يوجد النحاس في الطبيعة مرتبطاً مع عناصر أخرى على هيئة معادن، وخاصة ضمن معادن الكبريتيدات [ملاحظة 41] مثل: كالكوبيريت [ملاحظة 42]، وبورنيت [ملاحظة 43]، وديغينيت [ملاحظة 44]، وكوفيليت [ملاحظة 45]، وكالكوسيت [ملاحظة 46]؛ وكذلك ضمن معادن أملاح السلفو [ملاحظة 47] مثل تتراهدريت [ملاحظة 48] وتينانيت [ملاحظة 49] وإينارغيت [ملاحظة 50]؛ وضمن معادن الزرنيخات [ملاحظة 51] مثل معدني كورنواليت [ملاحظة 52] وكلينوكلاس [ملاحظة 53]؛ وضمن معادن الكربونات مثل معدني آزوريت [ملاحظة 54] ومالاكيت [ملاحظة 55]؛ بالإضافة إلى معادن الأكاسيد مثل معدني كوبريت [ملاحظة 56] وتينوريت [ملاحظة 57]؛ ومعادن الهاليدات مثل معدن أتاكاميت [ملاحظة 58].[37] بلغ عدد معادن النحاس المعروفة حتى سنة 2019 حوالي 635 معدناً؛ وأكثر المعادن احتواءً على النحاس في الخامة هما معدنا الكوبريت (بنسبة تصل حتى 88%) والألغودونيت [ملاحظة 59] (بنسبة 83.6%)، بالإضافة إلى معادن باراميلاكونيت [ملاحظة 60] والتينوريت والكالكوسيت (بنسبة تصل إلى حوالي 80%).[38]
لا يتجاوز تركيز النحاس في الغلاف الجوي مقدار 1 نانوغرام/م3؛ أما تركيزه في التربة فيبلغ 150 مغ/كغ؛ وفي الغطاء النباتي مقدار 30 مغ/كغ؛ أما في الماء العذب فيصل متوسط تركيز النحاس مقدار 2 ميكروغرام/الليتر مقابل 0.5 ميكروغرام/الليتر في ماء البحر.[39]
الاستخراج


يستخرج النحاس غالباً على هيئة معادن الكبريتيدات في مناجم التعدين السطحي [ملاحظة 61] من توضعات الصخر السماقي النحاسية [ملاحظة 62]. من أشهر المواقع الغنية بالنحاس كل من منجم تشوكويكاماتا [ملاحظة 63] في تشيلي؛ ومنجم وادي بينغهام [ملاحظة 64] في ولاية يوتا ومنجم تشينو [ملاحظة 65] في ولاية نيومكسيكو في الولايات المتّحدة. تحتل تشيلي صدارة دول العالم في إنتاج النحاس وفق تقديرات هيئة المساحة الجيولوجية البريطانية [ملاحظة 66] في سنة 2005، وذلك بطاقة إنتاجية تعادل حوالي الثلث من إجمالي الإنتاج العالمي؛ تليها الولايات المتحدة ثم إندونيسيا والبيرو.[37] كما تعد الصين من الدول الرائدة في إنتاج النحاس؛ أما في أوروبا فتعد بولندا والبرتغال والسويد من الدول ذات الإنتاج الوفير نسبياً من النحاس. يمكن استخراج النحاس وفق عملية تصويل في الموقع [ملاحظة 67]، وقد جرى تطبيقها مثلاً في عدة مواقع في ولاية أريزونا الأمريكية؛[40] ولكن الكميات المستحصلة وفق هذه الطريقة ضئيلة ومحدودة نسبياً، ولا تفي بالمتطلبات العالمية التي هي بازدياد مستمر.[41] لذلك يجرى التفكير باتباع أسلوب التعدين في قاع البحر [ملاحظة 68] للحصول على النحاس ضمن عُقَيدَات متعدّدة الفلزّات [ملاحظة 69] المتوضّعة على أعماق تصل بين 3.5 إلى 6 كيلومتر في القاع، مثلما هو الحال مع فلزي النيكل والكوبالت.[42]
يتراوح تركيز النحاس في خاماته بمقدار 0.6% وسطياً، وتعد الخامات الكبريتيدية أكثرها جدوى من الناحية الاقتصادية للاستخراج، وخاصة معدني الكالكوبيريت CuFeS2 والبورنيت Cu5FeS4؛ وبدرجة أقل معدني الكوفيليت CuS والكالكوسيت Cu2S.[43] من جهة أخرى، يقدر أن يكون وسطي تركيز النحاس في العقيدات متعددة الفلزات بحوالي 1.3%؛ وتتضمن الطرائق المستخدمة لاستخراج النحاس منها عملية التصويل الكبريتي [ملاحظة 70] والصهر، بالإضافة إلى عمليات أخرى.[44][45]
الاحتياطي وذروة النحاس
وفق تقديرات دراسة نشرتها مجموعة دراسة النحاس العالمية [ملاحظة 71] فإن الاحتياطات العالمية المخمنة بناء على بيانات مستحصلة من هيئة المساحة الجيولوجية الأمريكية [ملاحظة 72] تبلغ حوالي 870 مليون طن؛ أما موارد النحاس المتعرف عليها فتبلغ 2100 مليون طن، في حين أن الموارد غير المكتشفة من هذا الفلز تقدر بحوالي 3500 مليون طن.[46] ولكن على الرغم من أن النحاس كان معروفاً منذ آلاف السنين، إلا أن بعض التقديرات تشير إلى أن أكثر من حوالي 95% من خامات هذا الفلز قد استخرجت من الأرض وخضعت إلى عمليات صهر ومعالجة منذ بدايات القرن العشرين؛ ولذلك السبب صيغ تعبير فيما يعرف باسم «ذروة النحاس» [ملاحظة 73].[47] إلا أن تلك التقديرات تتفاوت بحد ذاتها مع مرور السنين نظراً اختلاف النمو الاقتصادي العالمي.[48] ولكن هناك تطور مستمر في ترسيخ مفاهيم إعادة التدوير [ملاحظة 74] من أجل تأمين موارد النحاس في العصر الحديث.[47]
الإنتاج
.svg.png.webp)
النحاس الخام
في البداية وقبل عمليات التسخين يعمد إلى زيادة تركيز النحاس في الخامات المستخرجة بعد سحقها وتفتيتها، وذلك إلى تراكيز أولية تتراوح بين 10-15% عن طريق عمليات التعويم الزبدي [ملاحظة 75] أو الرشح الحيوي [ملاحظة 76].[49]
من الأفران الصناعية المستخدمة بشكل واسع في إنتاج النحاس كل من الأفران العاكسة [ملاحظة 77] وكذلك أفران الصهر الومضي منذ بدايات ثمانينيات القرن العشرين. يؤدي تحميص [ملاحظة 78] خامات النحاس مع السيليكا [ملاحظة 79] وفحم الكوك وفق أسلوب الصهر الومضي إلى التخلص من الحديد على هيئة خبث [ملاحظة 80]؛ إذ تستغل هذه العملية سهولة تحول كبريتيدات الحديد إلى الأكاسيد الموافقة:
والتي بدورها تتفاعل مع السيليكا لتشكل خبثاً من السيليكات [ملاحظة 81]:
يطفو الخبث المتشكل على سطح الكتلة المسخنة ليستحصل على خليط كبريتيدي مصهور للنحاس [ملاحظة 82]، والذي يتكون بشكل رئيسي من كبريتيد النحاس الأحادي Cu2S؛ وقد يصل تركيز النحاس فيه إلى حوالي 70%. يصب الخليط الكبريتيدي المصهور والمتوهج في مفاعل ويسخن ثم يمرر فيه تيار من أكسجين الهواء، مما يؤدي إلى تحول كبريتيدات النحاس إلى الأكاسيد الموافقة:[43]
كما يضمن في هذه الخطوة التخلص من باقي الحديد الموجود في الوسط على هيئة خبث. في الخطوة التالية يفاعل الباقي من كبرتيد النحاس الأحادي مع أكسيد النحاس الثنائي للحصول على النحاس الخام:
يصل محتوى النحاس في النحاس الخام إلى حوالي 98%، وتحوي النسبة المتبقية على شوائب من الحديد والزنك، بالإضافة إلى فلزات نبيلة من الذهب والفضة والبلاتين.
وسائل أخرى
يمكن الحصول على النحاس وفق تفاعل ألومنيوم حراري [ملاحظة 83] بين أكسيد النحاس مع مسحوق الألومنيوم باستخدام فلوريد الكالسيوم على هيئة صهارة [ملاحظة 84]. كما يوجد هناك أيضاً أسلوب آخر تاريخي وقديم للحصول على النحاس من خاماته، وذلك وفق عملية التمليط [ملاحظة 85]، وهي عملية تتضمن ترسيب النحاس من مفاعلة كبريتات النحاس الثنائي مع الحديد، لكن النحاس المستحصل وفق هذه العملية غير نقي. كان هذا الأسلوب شائع الاستخدام للحصول على النحاس في الصين قبل حوالي ألف سنة.[50]
التنقية
ينقى النحاس عادة بأسلوب الاستخلاص الكهربائي [ملاحظة 86]؛[51] إذ يوضع النحاس الخام في خلية تحليل على المصعد [ملاحظة 87]؛ مقابل قطع من النحاس مرتفع النقاوة على المهبط [ملاحظة 88] بوجود كهرل [ملاحظة 89] مؤلف من محلول كبريتات النحاس الثنائي في حمض الكبريتيك. عند تطبيق جهد كهربائي ملائم تتأكسد كافة شوائب الفلزات الوضيعة الموجودة ضمن قطعة النحاس الخام وتذهب على هيئة أيونات موجبة الشحنة (كاتيونات) إلى المحلول، في حين أن الشوائب من الفلزات النبيلة تترسب على هيئة وحل مصعدي [ملاحظة 90]، والذي يخضع إلى معالجة لاحقة.

- المصعد
- المهبط
وبتلك العملية تنحل قطعة النحاس الخام الموجودة على المصعد تدريجياً، في حين تترسب أيونات النحاس على المهبط، بحيث يحصل في النهاية على نحاس ذي درجة نقاوة تصل إلى 99.99%.[51]
إعادة التدوير
إن النحاس قابل لإعادة التدوير مثله مثل الألومنيوم؛[52] وبذلك يستحصل على نحاس بجودة جيدة تعادل ما يستحصل من الخامات الأرضية.[53] يأتي النحاس في المرتبة الثالثة من بين الفلزات المدورة بعد الحديد والألومنيوم؛[54] ويقدر أن 80% من النحاس المستخرج على الإطلاق لا يزال مستخدماً حتى الآن نتيجة عمليات التدوير.[55] وفقاً لتقريرٍ دوليٍّ من الهيئة الدولية للموارد الطبيعية [ملاحظة 91] فإنّ الاستهلاك العالمي من النحاس في المجتمع يتراوح بين 35-55 كغ لكل نسمة، وهو يرتفع في الدول المتقدّمة ليصل إلى مجال بين 140-300 كغ لكل نسمة. لا تختلف عملية إعادة تدوير النحاس كثيراً عن إنتاجه من خاماته، ولكنها تتطلب خطوات أقل، إذ تصهر خردة النحاس مرتفع النقاوة في فرن مخصص للصناعات المعدنية [ملاحظة 92]، ثم يخضع المصهور لتفاعلات أكسدة واختزال، ثم يصب على هيئة منتجات نصف مصنعة مثل الكتل الخام [ملاحظة 93] أو الصبات [ملاحظة 94]؛ في حين أن الخردة منخفضة النقاوة تذاب في حمض الكبريتيك، ثم تخضع إلى عملية تنقية كهربائية.[56]
النظائر
يبلغ عدد نظائر النحاس تسعة وعشرون، منها نظيران مستقران، وهما نحاس-63 63Cu ونحاس-65 65Cu، ويؤلف النظير 63Cu حوالي 69% من النحاس في الطبيعة، ولكل من النظيرين المذكورين لفٌّ مغزليّ [ملاحظة 95] مقداره 3⁄2.[57] أما باقي النظائر فهي نظائر مشعة، وأكثرها استقراراً هو النظير المشع نحاس-67 67Cu بعمر نصف [ملاحظة 96] مقداره 61.83 ساعة.[57]
يوجد هناك سبعة مصاوغات نووية [ملاحظة 97] معروفة للنحاس، وهي شبه مستقرة [ملاحظة 98]، وأكثرها استقراراً هو 68mCu بعمر نصف 3.8 دقيقة. تضمحل نظائر النحاس ذات العدد الكتلي الأكبر من 64 وفق نمط اضمحلال بيتا [ملاحظة 99]؛ أما النظائر ذات العدد الكتلي الأقل من 64 فتضمحل وفق نمط انبعاث البوزيترون [ملاحظة 100]؛ مع العلم أن النظير نحاس-64، بعمر نصف مقداره 12.7 ساعة، يضمحل وفق النمطين.[58] يستخدم النظير نحاس-62 62Cu على هيئة قائفة مشعة [ملاحظة 101] في تقنية التصوير المقطعي بالإصدار البوزيتروني [ملاحظة 102].[59]
الخواص الفيزيائية

يوجد النحاس في الظروف القياسية من الضغط ودرجة الحرارة على هيئة فلز ذي لون برتقالي مزهر، وعند التعرض الطويل للهواء فإنه يفقد لمعانه ويأخذ درجة لون بنية محمرة، في حين أن مخدشه [ملاحظة 103] ذو لون أحمر مزهر. للنحاس عموماً لون خاص ومميز، بحيث ينسب إليه فيقال اللون النحاسي؛ وهو بذلك واحد من بضعة عناصر فلزية ذات لون مغاير للون الرمادي أو الفضي النمطي لأغلب الفلزات.[60]
يقع النحاس في الجدول الدوري للعناصر في المجموعة الحادية عشرة إلى جانب الذهب والفضة؛ وهي تعرف باسم فلزات النقود [ملاحظة 104]، وتتميز تلك الفلزات بقابليتها الكبيرة للسحب والطرق، كما تتميز بمواصفاتها من حيث الناقلية الحرارية والموصلية الكهربائية. يعود السبب في تلك الخواص الفيزيائية المميزة إلى البنية الذرية لهذه العناصر، فالتوزيع الإلكتروني [ملاحظة 105] فيها متناظر، إذ يوجد فيه إلكترون تكافؤ وحيد في المدار s خارج غلاف تكافؤ ممتلئ في المدار d. ويؤدي امتلاء الغلاف الإلكتروني d بالإلكترونات فيها إلى انخفاض مساهمة تلك الإلكترونات في التآثرات بين الذرية [ملاحظة 106]، والتي تقوم بها الإلكترونات في الغلاف الإلكتروني s، وتكون على هيئة رابطة فلزية. لكن تلك الرابطة الفلزية في فلزات النقود ضعيفة بالمقارنة مع الفلزات الأخرى التي يكون فيها الغلاف الإلكتروني d غير ممتلئ. تفسر هذه الملاحظة انخفاض الصلادة لدى النحاس، وقابليته الكبيرة للسحب والطرق.[61]

يتميز النحاس بناقليته وموصليته الممتازة، إذ يأتي في المرتبة الثانية بعد الفضة وقبل الذهب من حيث الناقلية الحرارية والكهربائية من بين الفلزات النقية عند درجة حرارة الغرفة.[37] يعود السبب في ذلك بأن مقاومة الإلكترونات للانتقال في الفلزات عند درجة حرارة الغرفة عائد بشكل أساسي إلى تبعثر وتشتت [ملاحظة 110] الإلكترونات نتيجة الاهتزازات الحرارية [ملاحظة 111] للشبكة البلورية، والتي عادة ما تكون ضعيفة في الفلزات الطرية.[61] يتميز النحاس بأنه موصل جيد للكهرباء، إذ تبلغ قيمة الموصلية الكهربائية مقدار 59.6×106 سيمنز/متر. في حين تبلغ كثافة التيار [ملاحظة 112] العظمى للنحاس في الهواء الطلق حوالي 3.1×106 أمبير/متر2؛ وعند قيم أعلى من ذلك يبدأ الفلز بالتسخن بشكل مطرد.[62] يؤثر وجود بعض الشوائب مثل الفوسفور أو الحديد على ناقلية النحاس ويضعفها؛[63] كما قد يخضع النحاس عند تماسه مع فلزات أخرى إلى التآكل الجلفاني [ملاحظة 113].[64]
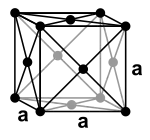
تبلغ كثافة النحاس مقدار 8920 كغ/م³، وبذلك ينتمي تصنيفياً إلى الفلزات الثقيلة. يتبلور النحاس وفق نظام بلوري مكعب مركزي الوجه [ملاحظة 114]، بالتالي يكون للذرات المقدرة على تعبئة الفراغات بشكل متراص [ملاحظة 115]، وتكون فيها الزمرة الفراغية [ملاحظة 116] من النمط Fm3m. أما قيمة ثابت الشبكة البلورية [ملاحظة 117] a فيبلغ 3.615 أنغستروم (Å)،[65] وذلك يوافق وجود أربع وحدات صيغة [ملاحظة 118] لكل وحدة خليّة [ملاحظة 119].[66]
الخواص الهندسية
تبلغ نقطة انصهار النحاس 1083.4 °س؛ ويمكن أن تبدأ عمليات التطريق الحرارية عند درجات حرارة تقع في مجال بين 700-800 °س. تقع صلادة النحاس على مقياس موس [ملاحظة 120] ما بين 2.5 إلى 3، وهي توافق قيمة ما بين 77–99 وفق اختبار فيكرز للصلادة [ملاحظة 121]. يؤدي التصلد الانفعالي [ملاحظة 122] عن طريق التسبب بحدوث عيوب بلورية [ملاحظة 123] في الشبكة البلورية [ملاحظة 124]، مثل الحدود الحبيبية [ملاحظة 125]، إلى إعاقة انسحاب المواد عند تطبيق جهد ميكانيكي، مما يزيد من الصلادة. لهذا السبب فإنه عادة ما يزود النحاس تجارياً على هيئة حبيبات بلورية، والتي تتميز بأنها ذات متانة أعلى من الشكل البلوري الأحادي [ملاحظة 126].[67]

السبائك

يستطيع النحاس أن يشكل عدداً كبيراً من السبائك مع العناصر الكيميائية الأخرى، والذي يتجاوز عددها 400 سبيكة.[70] ولسبائك النحاس خواص مميزة من حيث اللون ومقاومة التآكل وسهولة التشغيل الآلي، لذلك تدخل في العديد من التطبيقات العملية. من أقدم تلك السبائك وأشهرها سبيكة النحاس مع الزنك، والتي تعرف باسم النحاس الأصفر (أو الصفر) [ملاحظة 128]؛ وكذلك سبيكة النحاس مع القصدير المعروفة باسم البرونز. مع مرور الزمن توسع استخدام كلمة «برونز» للإشارة إلى سبيكة النحاس مع عناصر أخرى، مثلما هو الحال مع الزرنيخ أو الفوسفور أو الألومنيوم؛ ويستخدم برونز الألومنيوم بشكل واسع في مجال التزيين من أجل إضفاء لون ذهبي.[34]
يدمج النحاس بشكل شائع في سبائك الفضة والذهب، وخاصة في صياغة المجوهرات، إذ يساهم في التحكم بالعيار ودرجة اللون ونقطة انصهار السبيكة المرجوة.[71] يكثر في اليابان استخدام سبيكة «شاكودو» [ملاحظة 129] لأغراض التزيين، وهي مؤلفة بشكل سائد من النحاس مع نسبة تتراوح بين 4-10% من الذهب.[72] من جهة أخرى، تعرف سبيكة «الذهب الشمالي» [ملاحظة 130]، والخالية عملياً من الذهب، إذ تتكون بأغلبيتها من النحاس (89%) مع 5% ألومنيوم و5% زنك و1% قصدير؛ وهي مستخدمة في سك قطعة 50 سنت في منطقة اليورو.[73]
يشكل النحاس عدداً من السبائك مع النيكل؛ إذ تدعى سبيكة النحاس الحاوية على نسبة (60-90%) مع النيكل باسم النيكل النحاسي [ملاحظة 131]، وهي مستخدمة بشكل واسع في سك النقود المعدنية؛[74] والتي حلت محل النقود المعدنية التي كان يدخل الفضة بشكل واسع في تركيبها.[75] تتميز سبيكة مؤلفة من 90% نحاس و10% نيكل بخواصها الفريدة المقاومة للتآكل، ويوجد لها عدد معتبر من التطبيقات، وخاصة في المجالات التي تكون فيها الأجسام على تماس مع ماء البحر.[76] من السبائك المعروفة أيضاً للنحاس مع النيكل سبيكة فضّة النيكل [ملاحظة 132]، ويكون التركيب لها على الشكل: 47-64% نحاس و10-25% نيكل و15-42% زنك، مع إمكانية إدخال شوائب من عناصر أخرى.[77]
الخواص الكيميائية


لا يتفاعل النحاس مع الماء، لكنه يتفاعل ببطء مع أكسجين الهواء في تفاعل أكسدة مشكلاً طبقة بنية إلى سوداء اللون على السطح من أكسيد النحاس، والتي تقوم على العكس مما هو الحال في الصدأ في الحديد، بحماية بافي كتلة الجسم النحاسي من التآكل، وبذلك تقوم تلك الطبقة بدور مخمّل [ملاحظة 134]. تتشكل على الأسطح النحاسية المتعرضة لوقت طويل إلى الهواء طبقة خضراء من الزنجار [ملاحظة 135]، وهي مادة تتألف كيميائياً من كربونات النحاس القاعدية، وتسمى صدأ النحاس [ملاحظة 136] وتلاحظ عادةً على أسطح المباني القديمة المكسوة بالنحاس؛[6] أو التماثيل المصنوعة من النحاس وسبائكه، كما هو الحال في تمثال الحرية [ملاحظة 137].[78] يفقد النحاس لمعانه عند تعرضه إلى بعض المركبات الكبريتية، والذي يتفاعل معها على السطح مشكلاً عدداً من مركبات كبريتيد النحاس المختلفة.[79]
لا يهاجم النحاس في الشروط العادية من حمض الهيدروكلوريك؛[80] ولكن بوجود شروط مؤكسدة فإن النحاس يصبح عرضة للهجوم من الأحماض، فهو ينحل مثلاً في حمض الكبريتيك الساخن، كما ينحل أيضاً في حمض النتريك،[81] والماء الملكي.[82] يستطيع مزيج من بيروكسيد الهيدروجين (الماء الأكسجيني) مع حمض الهيدروكلوريك أو حمض الكبريتيك أن يذيب النحاس بشكل سريع. يمكن للأحماض العضوية المركزة أن تهاجم النحاس أيضاً؛ ولكن بالمقابل فإنه ثابت تجاه المحاليل القلوية. عند توهّج النحاس لدرجة الاحمرار يتفاعل النحاس مع الأكسجين ويشكل طبقة من أكسيد النحاس الأحادي؛ من جهة أخرى يؤدي تعرض النحاس أثناء المعالجات الحرارية إلى الهيدروجين إلى حدوث تقصف هيدروجيني [ملاحظة 138].
المركبات الكيميائية
| حالات أكسدة النحاس وأمثلة من المركبات الكيميائية عليها | |
|---|---|
| +1 | CuCl، Cu2O، CuH، Cu2C2 |
| +2 | CuCl2، CuO، CuSO4 |
| +3 | KCuO2، K3CuF6 |
| +4 | Cs2CuF6 |
يمكن أن يوجد النحاس بعدة حالات أكسدة في مركباته الكيميائية وهي 0 و +1 و +2 و +3 و+4؛ ولكن أكثرها شيوعاً هما حالتا الأكسدة +1 و +2؛ أما الأكثر استقراراً في المحاليل المائية فهي حالة الأكسدة +2؛ من جهة أخرى، فإن حالة الأكسدة +4 نادرة جداً، ولا تصادف إلا في البعض القليل من المركبات الكيميائية، مثلما هو الحال في سداسي فلوريد النحاس والسيزيوم Cs2CuF6. قياساً على عناصر أخرى تدعى أحياناً المركبات الحاوية على النحاس في حالة الأكسدة +1 باسم مركبات النحاسوز [ملاحظة 139]، أما المركبات الحاوية على النحاس في حالة الأكسدة +2 فتدعى باسم مركبات النحاسيك [ملاحظة 140].[83] النحاس قادر أيضاً على تشكيل معقدات تناسقية [ملاحظة 141] وكذلك مركبات عضوية فلزية [ملاحظة 142]، والتي توجد لها تطبيقات عملية وحيوية مهمة.[84]

اللاعضوية
- الأكاسيد والهيدروكسيد
للنحاس أكسيدان معروفان، وهما أكسيد النحاس الأحادي (أكسيد النحاسوز) وأكسيد النحاس الثنائي (أكسيد النحاسيك)، ولهما العديد من التطبيقات المعروفة. يوجد أكسيد النحاس الأحادي Cu2O على هيئة صلب أحمر ذي نظام بلّوري مكعّب؛[85] بالمقابل، فإن أكسيد النحاس الثنائي CuO هو مسحوق أسود يوجد في بعض الأحيان على هيئة مادّة لابلّورية [ملاحظة 143]، وفي أحيان أخرى على صلب وفق نظام بلّوري أحادي الميل [ملاحظة 144].[85]
أما هيدروكسيد النحاس الثنائي Cu(OH)2، فهو صلب ذو لون أخضر مزرق، ويستخدم في تطبيقات عديدة مثل الخضب وفي صباغة الخشب [ملاحظة 145] وفي تحضير مبيدات الفطريات.[6]
- الهاليدات
_chloride.jpg.webp)
_chloride_dihydrate.jpg.webp)
تعد هاليدات النحاس الأحادي والثنائي من المركبات المعروفة، سواء منها للنحاس الأحادي (من الفلوريد CuF، والكلوريد CuCl، والبروميد CuBr ويوديد النحاس الأحادي CuI) أو النحاس الثنائي (من الفلوريد CuF2 والكلوريد CuCl2 والبروميد CuBr2)، ما عدا يوديد النحاس الثنائي، إذ تؤدي المحاولات لتحضير هذا المركب إلى الحصول على يوديد النحاس الأحادي CuI وعنصر اليود:[83]

يختلف لون هاليدات النحاس بوجود ماء التبلور في البنية البلورية؛ فعلى سبيل المثال، يوجد مركب كلوريد النحاس الثنائي CuCl2 في الحالة النقية على هيئة مسحوق بلوري بني، أما المركب ثنائي الهيدرات CuCl2.2H2O فيوجد على هيئة بلورات ذات لون أخضر مزرق. أما العينات النقية من مركب كلوريد النحاس الأحادي CuCl فهي على هيئة صلب بلوري عديم اللون، في حين أنه في الشروط العادية تكون مشابة بكلوريد النحاس الثنائي نتيجة أثر الأكسدة، ولذلك تبدو على هيئة مسحوق أخضر اللون.[85]
- أملاح أخرى
يعد مركب كبريتات النحاس الثنائي CuSO4 من المركبات الكيميائية المعروفة، ويوجد في العادة بالشكل المائي خماسي هيدرات CuSO4.5H2O على هيئة بلورات زرقاء داكنة، وهو يدعى في كتب التاريخ الكيميائية العربية باسم «الزاج الأزرق». يوجد هذا المركب في الطبيعة في معدني الكلكنتيت [ملاحظة 146] والبوثيت [ملاحظة 147]. لكبريتات النحاس عدد واسع من التطبيقات العملية.[6]
يوجد عدد من المركبات اللاعضوية الأخرى للنحاس، من ضمنها كبريتيد النحاس الأحادي Cu2S والثنائي CuS؛ وكذلك أملاح النترات Cu(NO3)2 والفوسفات Cu3(PO4)2، بالإضافة إلى أملاح السيانيد CuCN والهيدريد CuH.
- حالات الأكسدة غير الشائعة
تعد حالتا الأكسدة +3 و+4 نادرتين بالنسبة لهذا العنصر الكيميائي. تصادف حالة الأكسدة الثلاثية للنحاس غالباً في الأكاسيد، ومن أبسط الأمثلة عليها أملاح النحاسات (كوبرات [ملاحظة 148] مثل نحاسات البوتاسيوم KCuO2، وهو مركب صلب ذو لون أزرق مسود.[86] تحوي مركبات أكسيد النحاس والباريوم والإتريوم [ملاحظة 149] YBa2Cu3O7 على مراكز من النحاس الثنائي والثلاثي، وهي من المواد المتميزة بأنها ذات توصيل فائق عند درجات حرارة مرتفعة [ملاحظة 150].[87] كما هو الحال مع الأكاسيد، فإن مركبات الفلوريد قادرة على تثبيت الأيونات في حالات الأكسدة المرتفعة، مثلما هو الحال في النحاس الثلاثي في مركب سداسي فلورو نحاسات البوتاسيوم [ملاحظة 151] K3CuF6 وفي النحاس الرباعي في مركب سداسي فلورو نحاسات السيزيوم [ملاحظة 152].[83]
تستطيع بعض البروتينات النحاسية أن تشكل معقدات أوكسو [ملاحظة 153]، والتي تحوي على النحاس الثلاثي فيها؛[88] من جهة أخرى، يعود استقرار معقدات النحاس الثلاثي بواسطة رباعيات الببتيد [ملاحظة 154] إلى التآثر مع الربيطات الأميدية منزوعة البروتونات [ملاحظة 155].[89]
المعقدات التناسقية

إن النحاس قادر مثله مثل باقي الفلزات الانتقالية على تشكيل معقدات تناسقية مع ربيطات [ملاحظة 157] متنوعة. في المحاليل المائية يوجد النحاس الثنائي على هيئة الأيون سداسي الهيدرات 2+[Cu(H2O)6]، ويبدي هذا المعقد أسرع معدل استبدال للربيطات لأي معقد مائي [ملاحظة 158] من بين الفلزات الانتقالية.
تؤدي إضافة أنيونات الهيدروكسيد إلى الوسط إلى ترسب [ملاحظة 159] صلب أزرق فاتح اللون من هيدروكسيد النحاس الثنائي
-sulfat-Monohydrat_Kristalle.png.webp)
وذلك الأمر يحدث بدايةً عند إضافة هيدروكسيد الأمونيوم، ولكن إضافة كميات فائضة منه إلى الوسط يؤدي إلى انحلال الراسب مشكلاً معقداً أمينياً [ملاحظة 160] من هيدروكسيد رباعي أمين ثنائي ماءات النحاس الثنائي 2(OH) [Cu(NH3)4(H2O)2]، والمعروف باسم «كاشف شفايتزر» [ملاحظة 161]. تشكل العديد من الأنيونات الأكسجينية [ملاحظة 162] الأخرى معقدات مائية، وتلك تتضمن أسيتات النحاس الثنائي Cu(CH3COO)2 ونترات النحاس الثنائي Cu(NO3)2 وكربونات النحاس الثنائي CuCO3. أما كبريتات النحاس الثنائي CuSO4 فيوجد على شكل مائي خماسي الهيدرات، ويكثر استخدامه مبيداً للفطريات [ملاحظة 163] ضمن مزيج بوردو [ملاحظة 164].[90]
تستطيع مركبات البوليول [ملاحظة 165] الحاوية على مجموعات متعددة من مجموعات الكحول الوظيفية أن تتآثر مع أملاح النحاس الثنائي، وتستخدم لذلك الغرض من أجل اختبار السكريات المختزلة [ملاحظة 166]، إذ يعتمد كاشف بندكت [ملاحظة 167] ومحلول فهلنغ [ملاحظة 168] على وجود أيونات النحاس الثنائي الزرقاء التي تتعرض إلى تحول لوني نتيجة حدوث تفاعل اختزال إلى أكسيد النحاس الأحادي الأحمر.[91] يستطيع كاشف شفايتزر والمعقدات التناسقية المتعلقة مع ثنائي أمين الإيثيلين [ملاحظة 169] والأمينات الأخرى أن تذيب السليولوز.[92] تستطيع الأحماض الأمينية أن تشكل معقدات متمخلبة [ملاحظة 170] شديدة الاستقرار مع النحاس الثنائي.[93][94][95]
المركبات العضوية
تعرف المركبات الحاوية على رابطة كيميائية بين النحاس والكربون باسم مركبات النحاس العضوية؛ وتصطنع من مفاعلة مركبات النحاس الأحادي إما مع كاشف غرينيار [ملاحظة 171] أو الألكاينات الطرفية [ملاحظة 172] أو مركبات الليثيوم العضوية؛[96] وفقاً للتفاعل الأخير المذكور يمكن الحصول على كاشف جلمان [ملاحظة 173]. يمكن لمركبات النحاس العضوية أن تخضع إلى تفاعل استبدال [ملاحظة 174] مع هاليدات الألكيل لتشكل نواتج تفاعل ازدواج، وتلك خطوة مهمة في مجال الاصطناع العضوي. رغم ارتفاع الحساسية للصدمة، ولكن يستعان بمركب أسيتيليد النحاس الأحادي في تفاعلات كيمياء النحاس العضوية، مثل ازدواج كاديوت-خودكيفيتش [ملاحظة 175]؛[97] وازدواج سونوغاشيرا [ملاحظة 176].[98] تساهم مركبات النحاس العضوية أيضاً في إنجاز تفاعلات إضافة مترافقة محبة للنوى [ملاحظة 177] إلى مركبات كربونيل ألفا وبيتا غير المشبعة [ملاحظة 178] (إينونات [ملاحظة 179])؛[99] وفي إنجاز تفاعلات إضافة الكربون الفلزية [ملاحظة 180] للنحاس [ملاحظة 181] إلى الألكاينات.[100] يستطيع النحاس الأحادي أن يشكل العديد من المعقدات الضعيفة مع الألكينات وأحادي أكسيد الكربون، خاصة عند وجود الربيطات الأمينية.[101]

التحليل الكيميائي
يعطي اختبار اللهب التقليدي للكشف عن أيونات النحاس لوناً أزرق إلى أزرق مخضر، وذلك في مجال اللهب المؤكسِد، أما في مجال اللهب المختزِل فلا يعطي الاختبار نتيجة واضحة وذلك لأن اللون الناتج الأحمر أو الأحمر البني يقارب لون اللهب. وفق التحليل النوعي بالوسائل التحليليّة التقليديّة فإن النحاس يندرج ضمن قائمة الكاتيونات التي يمكن فصلها عن الوسط باستخدام كبريتيد الهيدروجين H2S على هيئة كبريتيد النحاس، ويكشف عن النحاس بواسطة تشكيل معقد رباعي أمين النحاس (كاشف شفايتزر). من جهة أخرى، يستطيع محلول فروسيانيد البوتاسيوم أن يرسب أيونات النحاس الثنائي على شكل سداسي سيانوفرّات النحاس الثنائي Cu2[Fe(CN)6]، وهذا التفاعل حساس بالقدر الكافي للكشف عن كميات ضئيلة من أيونات النحاس.
بالنسبة للتحليل الكمّي للنحاس فذاك ينجز بواسطة وفق أسلوب التحليل الوزني الكهربائي [ملاحظة 182] باستخدام أقطاب كهربائية من لبلاتين في محلول من أيونات النحاس الثنائي المحمضة بحمض الكبريت. كما يمكن إجراء معايرة يودية [ملاحظة 183] أو معايرة تشكل المعقدات [ملاحظة 184] باستخدام الموريكسيد [ملاحظة 185] مؤشّراً كيميائيّاً لونيّاً.[102] لكشف عن آثار نزرة من النحاس تستخدم تقنيات التحليل الآلي مثل قياس الاستقطابية [ملاحظة 186] أو المطيافية الذرية [ملاحظة 187] أو مطيافية كتلة مزودة ببلازما مقترنة بالحث [ملاحظة 188]؛ أو باستخدام تقنية القياس الفولتي [ملاحظة 189].[103]
الدور الحيوي
للنحاس دور حيوي مهم لعدد معتبر من الكائنات الحية؛ وهو يعد بالنسبة للإنسان من العناصر المهم وجودها في الغذاء، وهو يتركز في الكبد والعضلات والعظام؛[104] بحيث أن جسم الإنسان يحوي وسطياً على كمية تتراوح بين 1.4 إلى 2.1 ميليغرام لكل كيلوغرام من وزن الجسم.[105]
الكيمياء الحيوية

بدأت الأهمية الحيوية للنحاس مع ظهور الأكسجين في غلاف الأرض الجوي؛[106] فالنحاس أساسي وضروري في عمليات التنفس الخلوي لدى جميع حقيقيّات النوى [ملاحظة 191]؛ إذ يوجد في الميتوكندريون [ملاحظة 192] في إنزيم سيتوكروم سي أكسيداز [ملاحظة 193]، والذي يمثل البروتين الأخير في حلقة الفسفرة التأكسدية [ملاحظة 194]. يقوم الإنزيم المذكور بربط جزيء أكسجين بين ذرتي نحاس وحديد، ويقوم البروتين بنقل ثمانية إلكترونات إلى جزيء الأكسجين، فيحدث تفاعل أكسدة واختزال وينتج جزيئان من الماء. تقوم البروتينات النحاسية [ملاحظة 195] بدور مهم في عمليات انتقال الإلكترون الحيوية.[107] وذلك عبر ضبط وتنسيق عمليات سلسلة نقل الإلكترون الحيوية وفي نقل الأكسجين، وتلك عمليات تستغل تغير حالة الأكسدة السهل نسبياً بين النحاس الأحادي والثنائي.[108]
يوجد النحاس أيضاً في العديد من إنزيمات سوبر أكسيد ديسميوتاز [ملاحظة 196]، وهي بروتينات تحفز تفكك وتحلل مركبات فوق الأكاسيد [ملاحظة 197] بتحويلها وفق تفاعل عدم تناسب [ملاحظة 198] إلى أكسجين وبيروكسيد الهيدروجين؛ كما يوجد في إنزيم مختزلة أكسيد النتروز [ملاحظة 199].[109]
يقوم بروتين هيموسيانين [ملاحظة 200] بدور حامل للأكسجين في بعض الكائنات الحية، وتتضمن أغلب الرخويات وبعض مفصليات الأرجل مثل سرطان حدوة الحصان.[110] نظراً لكون الهيموسيانين ذا لون أزرق، فإن لتلك الكائنات الحية دماً أزرق اللون، على العكس من أغلب الكائنات الأخرى ذات لون الدم الأحمر، التي يقوم فيها بروتين هيموغلوبين المعتمد على الحديد بنقل الأكسجين في الدم. ترتبط إنزيمات اللاكاز [ملاحظة 201] والتايروسيناز [ملاحظة 202] بنيوياً بالهيموسيانين؛ ولكنها تقوم عوضاً عن الارتباط العكوس بالأكسجين بإجراء عملية إضافة هيدروكسيل (هدرلة [ملاحظة 203]) للركيزة، ويتمثل ذلك الدور في تشكل طلاء اللك الطبيعي.[107]
الدور المضاد للميكروبات
يعد النحاس ذا تأثير سمي بالنسبة لبعض الكائنات الحية الدقيقة من الجراثيم والميكروبات، حتى بتراكيز ضئيلة.[111] ووجدت دراسة أن الأسطح المصنوعة من النحاس تقضي على 63% من جراثيم المكورة العنقودية الذهبية [ملاحظة 204]؛ مما دفع بعض العيادات والمشافي إلى تجربة صناعة مقابض الأبواب من النحاس وسبائكه.[112] بينت التجارب أن التماس المباشر بين النحاس والميكروبات يؤدي إلى الإضرار بغلافها الخلوي، مما يضعفها تجاه العوامل المطهرة الأخرى؛ إذ أن أيونات النحاس ذات إلفة كبيرة إلى مجموعات الثيول الطرفية الموجودة في البروتينات الغشائية للميكروبات فترتبط معها وتعطل عملها، كما تقوم أيونات النحاس أيضاً بأكسدة الليبيدات في الغشاء الخلوي، مما يؤدي إلى إطلاق جذور كيميائية حرة تساهم في تخريب جزيئات الحمض النووي الريبوزي منقوص الأكسجين (DNA) لتلك الميكروبات.[113]
التغذية والصحة

من الضروري أن يحوي غذاء الإنسان على النحاس، حتى ولو بتراكيز ضئيلة، لذا فهو من المغذيات الضرورية؛ ويحتاج الإنسان وسطياً إلى حوالي 2 ميليغرام من النحاس لكل كيلوغرام من وزن الجسم.[114] يعثر على النحاس في أصناف مختلفة من الغذاء مثل الحبوب واللحوم والخضراوات الجذرية، والبقول والمكسّرات.[115]
الامتصاص
يمتص النحاس في جسم الإنسان في الأمعاء، ثم ينقل إلى الكبد مرتبطاً مع الألبومين [ملاحظة 205].[116] ومن الكبد يتوزع النحاس إلى الأنسجة الأخرى في مرحلة لاحقة، والتي يقوم فيها بروتين السيرولوبلازمين [ملاحظة 206] بحمل ذرات النحاس في بلازما الدم.[117][118]
يخضع النحاس في الجسم عادةً إلى دورة دموية معوية كبدية [ملاحظة 207]، ويكون الجسم قادراً على طرح الفائض منه، وأحياناً عبر العصارة الصفراوية.[119][120]
الدور الاقتصادي
ان معظم اقتصاديات خامات النحاس تعتمدعلى النسبة المئوية للعنصر الأساسي في الرواسب وعلى حجم المخزون وطبيعة الموقع وعادة يمكن تشغيل منجم نحاس يحتوى على (1%) نحاس مثل مناجم النحاس في الولايات المتحدة الأمريكية، تقدر أدنى قيمة للنحاس الخام (0.4%)على سطح الأرض وتقدرالرواسب (0.7%) في العمق الأرضي أي باطن الأرض.
اما بانسبة لأسعار النحاس فقد بلغ سعر رطل النحاس في الأسواق العالمية في الربع الأول من عـام (2004 م) حوالي (1.24 دولار) مرتفعاً بنسبة تقدر (64%) عن سعره لنفس الفترة في عـام (2003 م) وقد تم تواصل أسعار النحاس في ارتفاع ملحوظ في السنوات الثلاثة الأخيرة حتى وصلت إلى (4246 دولار/ الطن)بحيث في أوائل أو بداية شهر ديسمبر من عـام (2006 م) ثم قفزت (57 دولارا/الطن) أي بنسبة (1، 3%) حتى وصلت إلى (4303 دولار/ الطن) في نهاية نفس الشهر في بورصة لندن للمعادن مسجلة بذلك أعلى سعر للنحاس في آخر عشرين عاماً. ويرجع السبب الأساسي في ذلك إلى زيادة الطلب المحلى في أسواق كل من الدول العظمى الولايات المتحدة الأمريكية والصين وهما الــدولتين الأكثر استهلاكا في العالم لمعدن النحاس.
الاستخدامات
بما أن النحاس مصدر مهم في حد ذاته للطبيعة وللبشرية فقد تعددت استعمالاته واستخداماته.
- صناعة الكهرباء يستخدم في الصناعات الكهربائية لانه ليس باهض الثمن مثل صناعة المولدات الكهربائية وكابلات التوصيل الكهرباء. بما انه شديد المقاومة للمحاليل الكيميائية والتوصيل الحراري والكهربائي استعمل في المباني والمنشات الكيميائية وانابيب التدفئة والمنازل.
- اللحــام تستعمل في الآلات الموسيقية النحاسية مثل الأجهزة الأخرى التي يتم لحامها بالزنك والنحاس من المعروف ان اللحام بالنحاس وهو من أقدم الصناعات التي استخدمها الحدادون والذين يقومون بصناعة المجوهرات والأسلحة وفي الحرف اليدوية. ولوصل الفلزات ببعضها البعض يستعمل أحد الاساليب الرئيسية في حين هذه الطريقة أيضا تستعمل في الآلات الموسيقية النحاسية مثل الأجهزة والابواق التي يتم لحام تلك الأجهزة بالزنك والنحاس.
- الغـــذاء وجــد أن غـذاء الإنسان العادي يحتوى ما بين (2-5 جم) من النحاس يــوميـاً وأن زيــادة نسبة النحاس في الغــذاء تسبب اعتلال الصحة والإصابـة بمرض ويلسون وهو زيـادة النحاس في أغشية الجسم وخاصة الـرأس والكبـد وتجـدر الإشارة إلى أن محلول النحاس المسمى (Fethling Solution) يستخدم في الاختبارات التحليلية لصناعة السكر. يعتقد أن الزنك والنحاس يتنافسا على الامتصاص في الجهاز الهضمي بحيث أن النظام الغذائي الذي يحتوي على كمية مفرطة من أحد هذه المعادن يؤدي إلى نقص في المعدن الآخر. إن التوصيات لاستهلاك النحاس عند الأشخاص البالغين الأصحاء هي 0.9 ملغ يومياً. من الناحية الأخرى توصي البحوث المهنية باستهلاك 3 ملغ يومياًCu
- صناعة السبائك يخـلط النحاس مع عدد كبير من المعـادن الأخـرى لإنتـــاج أكثر من (1000 سبيكة) مختلفة لكل منها صفات صناعيـة تختلف باختلاف المعـادن التي تم خلطها بالنحـاس وكـذلك تتغير ألــوان السبائك باختلاف ألــوان المعـادن المخلوطة ومن أهم هذه السبائك مايلـى:
- سبيكة البرونز وهي من أهـم السبائك حيث يضاف للنحاس نسبة من الـزنك تتراوح مـا بين (5-40%) ويتميز البرونز بالشدة والصلابة والمقاومة العالية للاحتكاك والاحتفاظ بجودته لمدة طويلة وكان الكنغانيون أول من خلط النحاس لإنتــاج البرونز الذي استخدموه في صناعـة الأسلحة مثل السيـوف والـرمـاح ذات الرؤوس الحـادة، وعندمـا يضاف إلى السبيكة نسبة من الرصاص تتراوح ما بين (3-5%) تـزيــد جودة البرونز وتزيد أغراض استعماله.
- سبيكة النحاس والنيكل والزنك وتتكون من النحاس بنسبة (55-65%) والزنك بنسبة (17-27%) والنيكل بنسبة (10%) للحصول على سبيكة تستخدم كأساس لتغطية أنية الطعام مثل الاطباق والملاعق والسكاكين بطبقة فضية اللون وفي طلاء المجوهرات.
- سبيكة البرونز والفسفور والقصدير وتتكون بإضافة الفسفور بنسبة (35%) والقصدير بنسبة (10%) للحصول على سبيكة تتميز بدرجة عالية من المرونة وسهولة التكيف والثبات والبقاء مما يجعلها ملائمة لصناعة الزنبرك الذي له القدرة على استعادة حجمه بعد الضغط وصناعة الأغشية أو الصفائح الرقيقة المسامية التي بين السوائل كما في البطاريات أو الموجودة في قرص سماعة التليفون.
- سبيكة البرونز والسليكون المجوهرات حيث يضاف إلى سبيكة البرونز بنسبة (1-3%) من عنصر السليكون بالإضافة إلى معادن أخرى مثل الرصاص والقصدير والزنك والمنجنيز والحديد والنكيل. وتتميز هذه السبيكة بالقوة مثل الفولاذ وبمقاومة شديدة للاحتكاك ويستخدم في إنتــاج المعدات اللازمة للمنشآت الكيميائية التي تتعرض إلى محاليل تساعد على سرعة تــآكــل المعادن.
- سبيكة البرونز والنحاس والألمنيوم وتحتوى على فلز الألمنيوم بنسبة تتراوح (5-12%) مع نسبة من الزنك والسليكون وتتميز هذه السبيكة بالمقاومة الشديدة للتفاعلات وتستخدم في المصافي ومعامل تكريــر الملــح.
- سبيكة المرايا المعدنية
- صناعة اسلاك الكهرباء بحيث يستهلك 40% من إنتاج النحاس في العالم
- في عملية التسخين والتبريد يستعمل كوسيلة مهمة لنقل الحرارة لان النحاس يتميز بحرارة نوعية عالية.
يدخل في تركيب بعض السبائك التي تختلف طبيعتها من حيث التركيب الداخلي وهي سبائك نحاسية كثيرة نذكر منها سبيكة نحاس حديد ولقد فتحت اليات تقوية المواد المختلفة المجال لاستخدام هذا المعدن بكثره في العديد من الاستخدامات الصناعية

في الحياة والثقافة العامة
يعتبر النحاس من أول معادن تم استخدامه واستعماله من طرف الإنسان وثاني المعادن من حيث تعدد المنافع بعد الحديد وقد تم اكتشافه منذ أكثر من (عشرة آلاف عام) قبل الميلاد. وهو عبارة عن فلز محمر اللون يتغير لونه وخصائصه عندما يتحد مع عناصر أخرى مشكلاً مركبات مختلفة، ويرجع اسم اواشتقاق النحاس إلى الاصول من الاسم اللاتنى لجزيرة قبرص (Cyprus) وسمى الخام (Cyprium) ثم حرف على مدى السنين إلى (Cyprum). يتواجد في الطبيعة في عدة صور اما منفردة أو متحدة منها على سبيل المثال أكاسيد، يتم الحصول على جزءه النقي بواسطة بالكهرلة أو التحليل الكهربائي. والنحاس مادة لينة قابلة للطرق تتفاعل كيميائيا أو فيزيائيا مع المصدر الخارجي وهو الجو مكونة الصدأ يعرف باكسيد النحاس الذي يتميز أيضا بلون الأخضر إضافة إلى المادة السامة. باإضافة إلى مميزاته انه بطيء التفاعل مع الأحماض المخففة.
- ذكر النحاس في القرآن الكريم
قال تعالى: (آتوني زبر الحديد حتى إذا ساوى بين الصدفين قال انفخوا، حتى إذا جعله ناراً قال آتوني أفرغ عليه قطراً) سورة الكهف: 96 بحيث أمر القرآن الكريم الذي هو تبيان لكل شيء في القصة المعروفة التي ذكرت في سورة الكهف.
أمر ذي القرنين بأن يأتوه بقطع الحديد الضخمة، فآتوه إياها، فأخذ يقوم بإبنائه شيئا فشيئا حتى جعل ما بين جانبي الجبلين من البنيان مساوياً لهما في العلو ثم قال للذين يبنون: انفخوا بالكير في القطع الحديدية الموضوعة بين الصدفين فلما تم ذلك وصارت النار عظيمة، قال للعمال للذين يتولون أمر النحاس من الإذابة وغيرها: آتوني القطر وهو النحاس المذاب أفرغه عليه فيصير مضاعف القوة والصلابة، وهي طريقة استخدمت حديثاً في تقوية الحديد، فوجدوا حديثا ان إضافة النحاس أو القطر إلى الحديد يضاعف من قوة السبائك.
طالع أيضاً
- نحاس أصفر
- نحاس-بيريليوم
- برونز (النحاس الأصفر)
- نيكل نحاسي (النحاس الأبيض)
- استخراج النحاس
- نقص النحاس
- ذروة النحاس
- نحاس (مهنة)
- تبييض النحاس
- سوق النحاس
- قائمة الدول حسب إنتاج النحاس
- قائمة الدول حسب إنتاج النحاس المصهور
الهوامش
- Zakros
- Cold working
- أو التخمير Annealing
- Smelting
- Lost-wax casting
- Neolithic
- Bronze Age
- Chalcolithic
- Investment casting
- Ötzi
- Bloomery
- Arsenical bronze
- Vinča culture
- Iron Age
- χαλκός
- Julius Caesar
- Augustus
- Hispania
- Venus
- Corinthian bronze
- Isle Royale National Park
- Tumbaga
- Falun Mine
- plate money (plåtmynt)
- Chalcography
- Daguerreotype
- Copper plating
- Copper sheathing
- Norddeutsche Affinerie
- Aurubis
- electroplating
- Outokumpu
- Flash smelting
- Intergovernmental Council of Countries Exporters of Copper (CIPEC)
- parts per million (ppm)
- Nuggets
- Dendrite
- Single crystal
- Pseudomorph
- Aragonite
- Sulfide mineral
- Chalcopyrite
- Bornite
- Digenite
- Covellite
- Chalcocite
- Sulfosalt mineral
- Tetrahedrite
- Tennantite
- Enargite
- Arsenate mineral
- Cornwallite
- Clinoclase
- Azurite
- Malachite
- Cuprite
- Tenorite
- Atacamite
- Algodonite
- Paramelaconite
- Surface mining
- Porphyry copper deposit
- Chuquicamata
- Bingham Canyon Mine
- Chino mine
- British Geological Survey (BGS)
- in-situ leach
- Deep sea mining
- polymetallic nodules
- sulphuric leaching
- International Copper Study Group (ICSG)
- United States Geological Survey (USGS)
- Peak copper
- Recycling
- froth flotation
- Bioleaching
- Reverberatory furnace
- Roasting
- Silica
- Slag
- Silicate
- copper matte
- Aluminothermic reaction
- Flux
- Cementation
- Electrorefining
- Anode
- Anode
- Electrolyte
- anode mud
- International Resource Panel
- Metallurgical furnace
- billets
- ingots
- Spin
- half-life
- nuclear isomer
- metastable
- beta decay β−
- positron emission β+
- radioactive tracer
- Positron Emission Tomography (PET)
- Streak
- Coinage metals
- Electron configuration
- interatomic interactions
- Continuous casting
- etched
- crystallite
- scattering
- thermal vibrations
- Current density
- Galvanic corrosion
- Face-centered cubic crystal system
- Close-packing
- Space group
- Lattice constant
- Formula unit
- Unit cell
- Mohs scale of mineral hardness
- Vickers hardness test
- Work hardening
- Crystallographic defect
- crystal lattice
- grain boundaries
- monocrystalline forms
- Dime
- Brass
- Shakudō
- Nordic Gold
- cupronickel
- Nickel silver
- Royal Observatory, Edinburgh
- passivation
- Verdigris
- Patina
- Statue of Liberty
- Hydrogen embrittlement
- cuprous
- cupric
- Coordination complex
- Organocopper compound
- amorphous
- Monoclinic crystal system
- Wood stain
- Chalcanthite
- Boothite
- cuprate
- Yttrium barium copper oxide (YBCO)
- High-temperature superconductivity
- Potassium hexafluorocuprate(III)
- Caesium hexafluorocuprate(IV)
- oxo complexes
- tetrapeptides
- deprotonated amide ligands
- Pourbaix diagram
- ligands
- Metal aquo complex
- Precipitation
- Metal ammine complex
- Schweizer's reagent
- oxyanions
- fungicide
- Bordeaux mixture
- Polyols
- reducing sugars
- Benedict's reagent
- Fehling's solution
- ethylenediamine
- chelate complexes
- Grignard reagents
- terminal alkynes
- Gilman reagent
- substitution reaction
- Cadiot–Chodkiewicz coupling
- Sonogashira coupling
- Nucleophilic conjugate addition
- α,β-Unsaturated carbonyl compound
- enones
- carbometalation
- carbocupration
- Electrogravimetry
- Iodometry
- Complexometric titration
- Murexide
- Polarography
- Atomic spectroscopy
- Inductively coupled plasma mass spectrometry (ICP-MS)
- Voltammetry
- plastocyanin
- eukaryotes
- mitochondria
- cytochrome c oxidase
- oxidative phosphorylation
- Copper proteins
- superoxide dismutase
- superoxides
- disproportionation
- nitrous-oxide reductase
- hemocyanin
- laccase
- tyrosinase
- Hydroxylation
- Staphylococcus aureus
- Serum albumin
- Ceruloplasmin
- enterohepatic circulation
المراجع
- A Timeline of Copper Technologies, Copper Development Association, https://www.copper.org/education/history/timeline/
- "Copper"، Elements.vanderkrogt.net، اطلع عليه بتاريخ 12 سبتمبر 2008.
- "CSA – Discovery Guides, A Brief History of Copper"، Csa.com، مؤرشف من الأصل في 03 فبراير 2015، اطلع عليه بتاريخ 12 سبتمبر 2008.
- Rayner W. Hesse (2007)، Jewelrymaking through History: an Encyclopedia، Greenwood Publishing Group، ص. 56، ISBN 978-0-313-33507-5..
- Renfrew, Colin (1990)، Before civilization: the radiocarbon revolution and prehistoric Europe، Penguin، ISBN 978-0-14-013642-5، اطلع عليه بتاريخ 21 ديسمبر 2011.
- Pearce, Mark (01 سبتمبر 2019)، "The 'Copper Age'—A History of the Concept"، Journal of World Prehistory (باللغة الإنجليزية)، 32 (3): 229–250، doi:10.1007/s10963-019-09134-z، ISSN 1573-7802.
- Klimscha, Florian، "Long-range Contacts in the Late Chalcolithic of the Southern Levant. Excavations at Tall Hujayrat al-Ghuzlan and Tall al-Magass_near Aqaba, Jordan"، academia.edu.
- Cowen, R.، "Essays on Geology, History, and People: Chapter 3: Fire and Metals"، اطلع عليه بتاريخ 07 يوليو 2009.
- "CSA – Discovery Guides, A Brief History of Copper"، CSA Discovery Guides، مؤرشف من الأصل في 03 فبراير 2015، اطلع عليه بتاريخ 29 أبريل 2011.
- Radivojevic, M؛ Rehren, T؛ Kuzmanovic-Cvetkovic, J؛ Jovanovic, M؛ Northover, JP (2013)، "Tainted ores and the rise of tin bronzes in Eurasia, ق.6500 years ago"، Antiquity، 87 (338): 1030–1045، doi:10.1017/S0003598X0004984X.
- Thornton, C.P.؛ Lamberg-Karlovsky, C.C.؛ Liezers, M.؛ Young, S.M.M. (2002)، "On pins and needles: tracing the evolution of copper-based alloying at Tepe Yahya, Iran, via ICP-MS analysis of Common-place items."، Journal of Archaeological Science، 29 If a great deal of oxygen is dissolved (29): 1451–1460، doi:10.1006/jasc.2002.0809.
- Lechtman, H.؛ Klein, S. (1999)، "The Production of Copper–Arsenic Alloys (Arsenic Bronze) by cosmelting: Modern Experiment, Ancient Practice"، Journal of Archaeological Science، 26 (5): 497–526، doi:10.1006/jasc.1998.0324، S2CID 128547259.
- McHenry, Charles, المحرر (1992)، The New Encyclopedia Britannica (ط. 15)، Chicago: Encyclopedia Britannica, Inc.، ج. 3، ص. 612، ISBN 978-0-85229-553-3.
- Kaufman, Brett، "Metallurgy and Ecological Change in the Ancient Near East"، Backdirt: Annual Review، 2011: 86.
- Radivojević, Miljana؛ Rehren, Thilo (ديسمبر 2013)، "Tainted ores and the rise of tin bronzes in Eurasia, c. 6500 years ago"، Antiquity Publications Ltd.
- McNeil, Ian (2002)، Encyclopaedia of the History of Technology، London; New York: Routledge، ص. 13, 48–66، ISBN 978-0-203-19211-5.
- Jane C. Waldbaum, From Bronze to Iron: The Transition from the Bronze Age to the Iron Age in the Eastern Mediterranean (Studies in Mediterranean Archaeology, vol. LIV, 1978).
- "History of Europe – The Iron Age"، Encyclopedia Britannica (باللغة الإنجليزية)، اطلع عليه بتاريخ 03 ديسمبر 2018.
- Hong, S.؛ Candelone, J.-P.؛ Patterson, C.C.؛ Boutron, C.F. (1996)، "History of Ancient Copper Smelting Pollution During Roman and Medieval Times Recorded in Greenland Ice"، Science، 272 (5259): 246–249 (247f.)، Bibcode:1996Sci...272..246H، doi:10.1126/science.272.5259.246، S2CID 176767223.
- de Callataÿ, François (2005)، "The Graeco-Roman Economy in the Super Long-Run: Lead, Copper, and Shipwrecks"، Journal of Roman Archaeology، 18: 361–372 (366–369)، doi:10.1017/S104775940000742X، S2CID 232346123.
- Wilhelm Hassenstein: Das Feuerwerksbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdrucks von 1529 mit Übertragung ins Hochdeutsche und Erläuterungen, München 1941, S. 104.
- Savenije, Tom J.؛ Warman, John M.؛ Barentsen, Helma M.؛ van Dijk, Marinus؛ Zuilhof, Han؛ Sudhölter, Ernst J.R. (2000)، "Corinthian Bronze and the Gold of the Alchemists" (PDF)، Macromolecules، 33 (2): 60–66، Bibcode:2000MaMol..33...60S، doi:10.1021/ma9904870، مؤرشف من الأصل (PDF) في 29 سبتمبر 2007.
- Martin, Susan R. (1995)، "The State of Our Knowledge About Ancient Copper Mining in Michigan"، The Michigan Archaeologist، 41 (2–3): 119، مؤرشف من الأصل في 07 فبراير 2016.
- Fester, G. A. (1962)، "Copper and Copper Alloys in Ancient Argentina"، Chymia، 8: 21–31، doi:10.2307/27757215، JSTOR 27757215.
- Lynch, Martin (2004)، Mining in World History، ص. 60، ISBN 978-1-86189-173-0.
- "Gold: prices, facts, figures and research: A brief history of money"، اطلع عليه بتاريخ 22 أبريل 2011.
- "Copper and Brass in Ships"، اطلع عليه بتاريخ 06 سبتمبر 2016.
- Stelter, M.؛ Bombach, H. (2004)، "Process Optimization in Copper Electrorefining"، Advanced Engineering Materials، 6 (7): 558–562، doi:10.1002/adem.200400403، S2CID 138550311.
- Gardner, E. D.؛ وآخرون (1938)، Copper Mining in North America، Washington, D. C.: U. S. Bureau of Mines، اطلع عليه بتاريخ 19 مارس 2019.
- Hyde, Charles (1998)، Copper for America, the United States Copper Industry from Colonial Times to the 1990s، Tucson, Arizona: University of Arizona Press، ص. passim، ISBN 0-8165-1817-3.
- "Outokumpu Flash Smelting" (PDF)، Outokumpu، ص. 2، مؤرشف من الأصل (PDF) في 24 يوليو 2011.
- Karen A. Mingst (1976)، "Cooperation or illusion: an examination of the intergovernmental council of copper exporting countries"، International Organization، 30 (2): 263–287، doi:10.1017/S0020818300018270.
- Romano, Donatella؛ Matteucci, Fransesca (2007)، "Contrasting copper evolution in ω Centauri and the Milky Way"، Monthly Notices of the Royal Astronomical Society: Letters، 378 (1): L59–L63، arXiv:astro-ph/0703760، Bibcode:2007MNRAS.378L..59R، doi:10.1111/j.1745-3933.2007.00320.x، S2CID 14595800.
- Emsley, John (2003)، Nature's building blocks: an A–Z guide to the elements، Oxford University Press، ص. 121–125، ISBN 978-0-19-850340-8، اطلع عليه بتاريخ 02 مايو 2011.
- "Copper" (in German), Handbook of Mineralogy, Mineralogical Society of America, http://www.handbookofmineralogy.org/pdfs/copper.pdf
- Rickwood, P.C. (1981)، "The largest crystals" (PDF)، American Mineralogist، 66: 885.
- Hammond, C.R. (2004)، The Elements, in Handbook of Chemistry and Physics (ط. 81st)، CRC press، ISBN 978-0-8493-0485-9.
- Webmineral – Mineral Species sorted by the element Cu (Copper).
- Rieuwerts, John (2015)، The Elements of Environmental Pollution، London and New York: Earthscan Routledge، ص. 207، ISBN 978-0-415-85919-6، OCLC 886492996.
- Randazzo, Ryan (19 يونيو 2011)، "A new method to harvest copper"، Azcentral.com، اطلع عليه بتاريخ 25 أبريل 2014.
- Gordon, R.B.؛ Bertram, M.؛ Graedel, T.E. (2006)، "Metal stocks and sustainability"، Proceedings of the National Academy of Sciences، 103 (5): 1209–1214، Bibcode:2006PNAS..103.1209G، doi:10.1073/pnas.0509498103، PMC 1360560، PMID 16432205.
- Beaudoin, Yannick C.؛ Baker, Elaine (ديسمبر 2013)، Deep Sea Minerals: Manganese Nodules, a physical, biological, environmental and technical review، Secretariat of the Pacific Community، ص. 7–18، ISBN 978-82-7701-119-6، اطلع عليه بتاريخ 08 فبراير 2021.
- Greenwood, Norman N.؛ Earnshaw, Alan (1997)، Chemistry of the Elements (ط. الثانية)، Butterworth-Heinemann، ISBN 0-08-037941-9.
- Su, Kun؛ Ma, Xiaodong؛ Parianos, John؛ Zhao, Baojun (2020)، "Thermodynamic and Experimental Study on Efficient Extraction of Valuable Metals from Polymetallic Nodules"، Minerals، 10 (4): 360، Bibcode:2020Mine...10..360S، doi:10.3390/min10040360.
- International Seabed Authority، "Polymetallic Nodules" (PDF)، International Seabed Authority، اطلع عليه بتاريخ 08 فبراير 2021.
- "The World Copper Factbook 2021" (PDF)، International Copper Study Group (ICSG)، 2021.
- Leonard, Andrew (03 مارس 2006)، "Peak copper?"، Salon (باللغة الإنجليزية)، اطلع عليه بتاريخ 08 مارس 2022.
- Brown, Lester (2006)، Plan B 2.0: Rescuing a Planet Under Stress and a Civilization in Trouble، New York: W.W. Norton، ص. 109، ISBN 978-0-393-32831-8.
- Watling, H.R. (2006)، "The bioleaching of sulphide minerals with emphasis on copper sulphides – A review" (PDF)، Hydrometallurgy، 84 (1): 81–108، doi:10.1016/j.hydromet.2006.05.001، مؤرشف من الأصل (PDF) في 18 أغسطس 2011.
- T. N. Lung: The history of copper cementation on iron — The world's first hydrometallurgical process from medieval China. In: Hydrometallurgy. Volume 17, Issue 1, November 1986, S. 113–129; doi:10.1016/0304-386X(86)90025-3.
- Samans, Carl (1949)، Engineering metals and their alloys، New York: Macmillan، OCLC 716492542.
- Burton, Julie McCulloch (2015)، Pen to Paper: Making Fun of Life (باللغة الإنجليزية)، iUniverse، ISBN 978-1-4917-5394-1.
- Bahadir, Ali Mufit؛ Duca, Gheorghe (2009)، The Role of Ecological Chemistry in Pollution Research and Sustainable Development (باللغة الإنجليزية)، Springer، ISBN 978-90-481-2903-4.
- Green, Dan (2016)، The Periodic Table in Minutes (باللغة الإنجليزية)، Quercus، ISBN 978-1-68144-329-4.
- "International Copper Association"، مؤرشف من الأصل في 05 مارس 2012، اطلع عليه بتاريخ 22 يوليو 2009.
- "Overview of Recycled Copper" Copper.org. (25 August 2010). Retrieved on 8 November 2011.
- Audi؛ Bersillon؛ Blachot؛ Wapstra (2003)، "The NUBASE evaluation of nuclear and decay properties"، Nuclear Physics A، ج. 729، ص. 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل في 9 أغسطس 2017
- "Interactive Chart of Nuclides"، National Nuclear Data Center، مؤرشف من الأصل في 25 أغسطس 2013، اطلع عليه بتاريخ 08 أبريل 2011.
- Okazawad, Hidehiko؛ Yonekura, Yoshiharu؛ Fujibayashi, Yasuhisa؛ Nishizawa, Sadahiko؛ Magata, Yasuhiro؛ Ishizu, Koichi؛ Tanaka, Fumiko؛ Tsuchida, Tatsuro؛ Tamaki, Nagara؛ Konishi, Junji (1994)، "Clinical Application and Quantitative Evaluation of Generator-Produced Copper-62-PTSM as a Brain Perfusion Tracer for PET" (PDF)، Journal of Nuclear Medicine، 35 (12): 1910–1915، PMID 7989968.
- Chambers, William؛ Chambers, Robert (1884)، Chambers's Information for the People (ط. 5th)، W. & R. Chambers، ج. L، ص. 312، ISBN 978-0-665-46912-1.
- George L. Trigg؛ Edmund H. Immergut (1992)، Encyclopedia of applied physics، VCH Publishers، ج. 4: Combustion to Diamagnetism، ص. 267–272، ISBN 978-3-527-28126-8، اطلع عليه بتاريخ 02 مايو 2011.
- Resistance Welding Manufacturing Alliance (2003)، Resistance Welding Manual (ط. 4th)، Resistance Welding Manufacturing Alliance، ص. 18–12، ISBN 978-0-9624382-0-2.
- H. Keller,K. Eickhoff: Kuper und Kupferlegierungen, Springer-Verlag 2013, 54 Seiten, Seite 7
- "Galvanic Corrosion"، Corrosion Doctors، اطلع عليه بتاريخ 29 أبريل 2011.
- Ralph W. G. Wyckoff (in German), Crystal Structures, 1 (2. ed.), New York, London, Sydney: John Wiley & Sons, pp. 3
- Hugo Strunz, Ernest Henry Nickel (in German), Strunz Mineralogical Tables. Chemical-structural Mineral Classification System (9. ed.), Stuttgart: E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), pp. 34, ISBN 3-510-65188-X
- Smith, William F. & Hashemi, Javad (2003)، Foundations of Materials Science and Engineering، McGraw-Hill Professional، ص. 223، ISBN 978-0-07-292194-6.
- "Dime"، US Mint، اطلع عليه بتاريخ 09 يوليو 2019.[وصلة مكسورة]
- "Pride and skill – the 10-cent coin"، Royal Canadian Mint، اطلع عليه بتاريخ 09 يوليو 2019.
- Kupfer-Legierungen. Retrieved on 19.06.2022.
- "Gold Jewellery Alloys"، World Gold Council، مؤرشف من الأصل في 14 أبريل 2009، اطلع عليه بتاريخ 06 يونيو 2009.
- Oguchi, Hachiro (1983)، "Japanese Shakudō: its history, properties and production from gold-containing alloys"، Gold Bulletin، 16 (4): 125–132، doi:10.1007/BF03214636.
- "What is Nordic Gold?"، European Copper Institute، مؤرشف من الأصل في 25 فبراير 2021، اطلع عليه بتاريخ 20 مارس 2020.
- Deane, D. V.، "Modern Coinage Systems" (PDF)، British Numismatic Society، اطلع عليه بتاريخ 01 يوليو 2019.
- "What is 90% Silver?"، American Precious Metals Exchange (APMEX)، مؤرشف من الأصل في 28 يوليو 2020، اطلع عليه بتاريخ 01 يوليو 2019.
- Corrosion Tests and Standards (باللغة الإنجليزية)، ASTM International، 2005، ص. 368.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 4: M–Pk. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1985, ISBN 3-440-04514-5, S. 2773.
- "Copper.org: Education: Statue of Liberty: Reclothing the First Lady of Metals – Repair Concerns"، Copper.org، اطلع عليه بتاريخ 11 أبريل 2011.
- Rickett, B.I.؛ Payer, J.H. (1995)، "Composition of Copper Tarnish Products Formed in Moist Air with Trace Levels of Pollutant Gas: Hydrogen Sulfide and Sulfur Dioxide/Hydrogen Sulfide"، Journal of the Electrochemical Society، 142 (11): 3723–3728، Bibcode:1995JElS..142.3723R، doi:10.1149/1.2048404.
- Universität Siegen: Reaktion von Metallen mit Salzsäure.
- Universität Siegen: Reaktion von Metallen mit Salpetersäure.
- eLexikon Chemie: Kupferchlorid.
- Holleman, A.F.؛ Wiberg, N. (2001)، Inorganic Chemistry، San Diego: Academic Press، ISBN 978-0-12-352651-9.
- Trammell, Rachel؛ Rajabimoghadam, Khashayar؛ Garcia-Bosch, Isaac (30 يناير 2019)، "Copper-Promoted Functionalization of Organic Molecules: from Biologically Relevant Cu/O2 Model Systems to Organometallic Transformations"، Chemical Reviews، 119 (4): 2954–3031، doi:10.1021/acs.chemrev.8b00368، PMC 6571019، PMID 30698952.
- Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 973-979.
- G. Brauer, المحرر (1963)، "Potassium Cuprate (III)"، Handbook of Preparative Inorganic Chemistry (ط. 2nd)، NY: Academic Press، ج. 1، ص. 1015.
- Wu, M. K.؛ Ashburn, J. R.؛ Torng, C. J.؛ Hor, P. H.؛ Meng, R. L.؛ Gao, L؛ Huang, Z. J.؛ Wang, Y. Q.؛ Chu, C. W. (1987)، "Superconductivity at 93 K in a New Mixed-Phase Y-Ba-Cu-O Compound System at Ambient Pressure"، Physical Review Letters، 58 (9): 908–910، Bibcode:1987PhRvL..58..908W، doi:10.1103/PhysRevLett.58.908، PMID 10035069.
- Lewis, E.A.؛ Tolman, W.B. (2004)، "Reactivity of Dioxygen-Copper Systems"، Chemical Reviews، 104 (2): 1047–1076، doi:10.1021/cr020633r، PMID 14871149.
- McDonald, M.R.؛ Fredericks, F.C.؛ Margerum, D.W. (1997)، "Characterization of Copper(III)–Tetrapeptide Complexes with Histidine as the Third Residue"، Inorganic Chemistry، 36 (14): 3119–3124، doi:10.1021/ic9608713، PMID 11669966.
- Wiley-Vch (02 أبريل 2007)، "Nonsystematic (Contact) Fungicides"، Ullmann's Agrochemicals، ص. 623، ISBN 978-3-527-31604-5.
- Ralph L. Shriner, Christine K.F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson "The Systematic Identification of Organic Compounds" 8th edition, J. Wiley, Hoboken. (ردمك 0-471-21503-1)
- Saalwächter, Kay؛ Burchard, Walther؛ Klüfers, Peter؛ Kettenbach, G.؛ Mayer, Peter؛ Klemm, Dieter؛ Dugarmaa, Saran (2000)، "Cellulose Solutions in Water Containing Metal Complexes"، Macromolecules، 33 (11): 4094–4107، Bibcode:2000MaMol..33.4094S، CiteSeerX 10.1.1.951.5219، doi:10.1021/ma991893m.
- Deodhar, S., Huckaby, J., Delahoussaye, M. and DeCoster, M.A., 2014, August. High-aspect ratio bio-metallic nanocomposites for cellular interactions. In IOP Conference Series: Materials Science and Engineering (Vol. 64, No. 1, p. 012014). https://iopscience.iop.org/article/10.1088/1757-899X/64/1/012014/meta.
- Kelly, K.C., Wasserman, J.R., Deodhar, S., Huckaby, J. and DeCoster, M.A., 2015. Generation of scalable, metallic high-aspect ratio nanocomposites in a biological liquid medium. JoVE (Journal of Visualized Experiments), (101), p.e52901. https://www.jove.com/t/52901/generation-scalable-metallic-high-aspect-ratio-nanocomposites.
- Karan, A., Darder, M., Kansakar, U., Norcross, Z. and DeCoster, M.A., 2018. Integration of a Copper-Containing Biohybrid (CuHARS) with Cellulose for Subsequent Degradation and Biomedical Control. International journal of environmental research and public health, 15(5), p.844. https://www.mdpi.com/1660-4601/15/5/844
- "Modern Organocopper Chemistry" Norbert Krause, Ed., Wiley-VCH, Weinheim, 2002. (ردمك 978-3-527-29773-3).
- Berná, José؛ Goldup, Stephen؛ Lee, Ai-Lan؛ Leigh, David؛ Symes, Mark؛ Teobaldi, Gilberto؛ Zerbetto, Fransesco (26 مايو 2008)، "Cadiot–Chodkiewicz Active Template Synthesis of Rotaxanes and Switchable Molecular Shuttles with Weak Intercomponent Interactions"، Angewandte Chemie، 120 (23): 4464–4468، Bibcode:2008AngCh.120.4464B، doi:10.1002/ange.200800891.
- Rafael Chinchilla & Carmen Nájera (2007)، "The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry"، Chemical Reviews، 107 (3): 874–922، doi:10.1021/cr050992x، PMID 17305399.
- "An Addition of an Ethylcopper Complex to 1-Octyne: (E)-5-Ethyl-1,4-Undecadiene" (PDF)، Organic Syntheses، 64: 1، 1986، doi:10.15227/orgsyn.064.0001، مؤرشف من الأصل (PDF) في 19 يونيو 2012.
- Kharasch, M.S.؛ Tawney, P.O. (1941)، "Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide"، Journal of the American Chemical Society، 63 (9): 2308–2316، doi:10.1021/ja01854a005.
- Imai, Sadako؛ Fujisawa, Kiyoshi؛ Kobayashi, Takako؛ Shirasawa, Nobuhiko؛ Fujii, Hiroshi؛ Yoshimura, Tetsuhiko؛ Kitajima, Nobumasa؛ Moro-oka, Yoshihiko (1998)، "63Cu NMR Study of Copper(I) Carbonyl Complexes with Various Hydrotris(pyrazolyl)borates: Correlation between 63Cu Chemical Shifts and CO Stretching Vibrations"، Inorganic Chemistry، 37 (12): 3066–3070، doi:10.1021/ic970138r.
- Merck KGaA: Komplexometrische Bestimmungen mit Titriplex. Darmstadt.
- R. Neeb: Inverse Polarographie und Voltammetrie. Akademie-Verlag, Berlin 1969, S. 185–188.
- Johnson, MD PhD, Larry E., المحرر (2008)، "Copper"، Merck Manual Home Health Handbook، Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc.، اطلع عليه بتاريخ 07 أبريل 2013.
- "Copper in human health".
- Decker, H. & Terwilliger, N. (2000)، "COPs and Robbers: Putative evolution of copper oxygen-binding proteins"، Journal of Experimental Biology، 203 (Pt 12): 1777–1782، doi:10.1242/jeb.203.12.1777، PMID 10821735.
- S.J. Lippard, J.M. Berg "Principles of bioinorganic chemistry" University Science Books: Mill Valley, CA; 1994. (ردمك 0-935702-73-3).
- Vest, Katherine E.؛ Hashemi, Hayaa F.؛ Cobine, Paul A. (2013)، "Chapter 13 The Copper Metallome in Eukaryotic Cells"، في Banci, Lucia (المحرر)، Metallomics and the Cell، Metal Ions in Life Sciences، Springer، ج. 12، ص. 451–78، doi:10.1007/978-94-007-5561-1_13، ISBN 978-94-007-5560-4، PMID 23595680. electronic-book (ردمك 978-94-007-5561-1) ISSN 1559-0836 electronic-ISSN 1868-0402
- Schneider, Lisa K.؛ Wüst, Anja؛ Pomowski, Anja؛ Zhang, Lin؛ Einsle, Oliver (2014)، "Chapter 8. No Laughing Matter: The Unmaking of the Greenhouse Gas Dinitrogen Monoxide by Nitrous Oxide Reductase"، في Peter M.H. Kroneck؛ Martha E. Sosa Torres (المحررون)، The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment، Metal Ions in Life Sciences، Springer، ج. 14، ص. 177–210، doi:10.1007/978-94-017-9269-1_8، ISBN 978-94-017-9268-4، PMID 25416395.
- "Fun facts"، Horseshoe crab، University of Delaware، مؤرشف من الأصل في 22 أكتوبر 2008، اطلع عليه بتاريخ 13 يوليو 2008.
- S. L. Warnes, C. W. Keevil: Inactivation of norovirus on dry copper alloy surfaces. In: PLoS One. 8(9), 2013, e75017. PMID 24040380, ببمد سنترال 3767632.
- "https://idw-online.de/de/news320667"، Informationsdienst Wissenschaft e. V.، 05.07.2022 (بالألمانية).
{{استشهاد ويب}}: تحقق من التاريخ في:|date=(مساعدة)، روابط خارجية في|title= - Salima Mathews, Michael Hans, Frank Mücklich, Marc Solioz, "Contact Killing of Bacteria on Copper Is Suppressed if Bacterial-Metal Contact Is Prevented and Is Induced on Iron by Copper Ions" (in German), Applied and Environmental Microbiology 79 (8)
- "Amount of copper in the normal human body, and other nutritional copper facts"، اطلع عليه بتاريخ 03 أبريل 2009.
- Denise Herzog, "Die Bedeutung von Kupfer im menschlichen Körper: eine kurze Übersicht" (in German), Schweizer Zeitschrift für Ernährungsmedizin (1/10)
- Adelstein, S. J.؛ Vallee, B. L. (1961)، "Copper metabolism in man"، New England Journal of Medicine، 265 (18): 892–897، doi:10.1056/NEJM196111022651806، PMID 13859394.
- Hellman NE, Gitlin JD (2002)، "Ceruloplasmin metabolism and function"، Annual Review of Nutrition، 22: 439–58، doi:10.1146/annurev.nutr.22.012502.114457، PMID 12055353.
- M.C. Linder؛ Wooten, L.؛ Cerveza, P.؛ Cotton, S.؛ Shulze, R.؛ Lomeli, N. (01 مايو 1998)، "Copper transport"، The American Journal of Clinical Nutrition، 67 (5): 965S–971S، doi:10.1093/ajcn/67.5.965S، PMID 9587137.
- Frieden, E.؛ Hsieh, H.S. (1976)، Ceruloplasmin: The copper transport protein with essential oxidase activity، Advances in Enzymology – and Related Areas of Molecular Biology، ج. 44، ص. 187–236، doi:10.1002/9780470122891.ch6، ISBN 978-0-470-12289-1، JSTOR 20170553، PMID 775938.
- S.S. Percival؛ Harris, E.D. (01 يناير 1990)، "Copper transport from ceruloplasmin: Characterization of the cellular uptake mechanism"، American Journal of Physiology. Cell Physiology، 258 (1): C140–C146، doi:10.1152/ajpcell.1990.258.1.c140، PMID 2301561.
- بوابة العناصر الكيميائية
- بوابة الكيمياء
- بوابة تعدين
- بوابة صيدلة
- بوابة علم الأحجار الكريمة والمجوهرات
- بوابة علم المواد
- بوابة علم طبقات الأرض


