كارنتين
الكارنتين (بالإنجليزية: Carnitine) هو مادة مشابهة للأحماض الأمينية والفيتامينات. تصنع في الجسم بكميات صغيرة من الأحماض الأمينية مثل ميوسين وميثيونين وبالإضافة إلى الفيتامينات مثل فيتامين C وفيتامين B.
| كارنتين | |
|---|---|
| اعتبارات علاجية | |
| معرّفات | |
| CAS | 406-76-8 |
| ك ع ت | A16AA01 |
| بوب كيم | 288 |
| ECHA InfoCard ID | 100.006.343 |
| كيم سبايدر | 282 |
| المكون الفريد | S7UI8SM58A |
| كيوتو | C00318 |
| ChEMBL | CHEMBL172513 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C₇H₁₅NO₃[1] |

كارنيتين هو مركب رباعي من الأمونيوم يشارك في عملية التمثيل الغذائي في معظم الثدييات والنباتات وبعض البكتيريا.[2][3][4][5] لدعم استقلاب الطاقة، ينقل الكارنتين الأحماض الدهنية طويلة السلسلة إلى الميتوكوندريا لتتأكسد لإنتاج الطاقة، كما تشارك في إزالة منتجات التمثيل الغذائي من الخلايا.[4] نظرًا لأدواره الأيضية الرئيسية، يتركز الكارنتين في الأنسجة مثل عضلات الهيكل العظمي والقلب التي تستقلب الأحماض الدهنية كمصدر للطاقة.[4] يصنع الأفراد الأصحاء، بما في ذلك النباتيون الصارمون، ما يكفي من L-carnitine في الجسم الحي بحيث لا يحتاجون إلى مكملات.[2]
يوجد الكارنتين كواحد من اثنين من الأيزومرات الفراغية (المتماثلانd كارنيتين (S - (+) -) وl -كارنيتين (ص - (-) -)).[6] كلاهما نشط بيولوجيًا، ولكن فقطl كارنيتين يحدث بشكل طبيعي في الحيوانات، وd كارنيتين سام لأنه يثبط نشاطl شكل.[7] في درجة حرارة الغرفة، الكارنتين النقي عبارة عن مسحوق أبيض، وzwitterion قابل للذوبان في الماء مع سمية منخفضة. مشتق من الأحماض الأمينية، [8] تم استخراج الكارنتين لأول مرة من مستخلصات اللحوم في عام 1905، مما أدى إلى تسميته من اللاتينية، «كارو / كارنيس» أو اللحم.[3]
بعض الأفراد الذين يعانون من اضطرابات وراثية أو طبية (مثل الخدج) لا يستطيعون إنتاج ما يكفي من الكارنتين، مما يتطلب مكملات غذائية.[2][4][5][9] تشير الأبحاث السريرية الأولية إلى أنه قد يحسن وظائف القلب لدى الأشخاص المصابين بأمراض القلب والأوعية الدموية أو الاعتلال العصبي لدى الأشخاص الذين يتلقون العلاج الكيميائي.[2][10] على الرغم من الاستخدام الشائع بين الرياضيين لاستهلاك مكملات الكارنتين لتحسين أداء التمرين أو التعافي، لا توجد أدلة إكلينيكية عالية الجودة تشير إلى أنها تقدم أي فائدة.[4][5]
التخليق الحيوي والتمثيل الغذائي
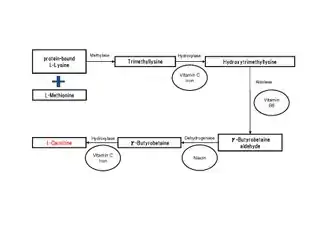
وصلة=https://es.wikipedia.org/wiki/Archivo:Acetylcarnitine_structure.png|تصغير|150x150بك|التركيب الكيميائي لأسيتيل كارنيتين. تمتلك العديد من حقيقيات النوى القدرة على تصنيع الكارنتين، بما في ذلك البشر.[2][4] يصنع البشر الكارنتين من الركيزة TML (6- N -Trimethyllysine)، والتي تُشتق بدورها من مثيلة حمض اللايسين الأميني.[2] يتم بعد ذلك هيدروكسيل TML في هيدروكسي ترايميثيلليسين (HTML) بواسطة ثلاثي ميثيلليسين ديوكسيجيناز (TMLD)، مما يتطلب وجود حمض الأسكوربيك والحديد. ثم يتم شق HTML بواسطة HTML aldolase (وهو فوسفات بيريدوكسال يتطلب إنزيمًا)، مما ينتج عنه 4-تريميثيل أمينوبوتيرالدهيد (TMABA) والجليسين. يتم بعد ذلك نزع الهيدروجين TMABA إلى جاما بيوتيروبتين في تفاعل NAD + المعتمد، محفزًا بواسطة نازعة الهيدروجين TMABA.[2] يتم بعد ذلك هيدروكسيل جاما بيوتيروبيتين بواسطة جاما بيوتيروبتين هيدروكسيلاز (إنزيم رابط بالزنك [11]) فيl كارنيتين، تتطلب الحديد على شكل Fe 2+ .[2][12]
يشارك كارنيتين في نقل الأحماض الدهنية عبر غشاء الميتوكوندريا، عن طريق تكوين إستر أسيتيل كارنيتيني طويل السلسلة ويتم نقله بواسطة كارنيتين بالميتويل ترانسفيراز 1 وكارنيتين بالميتويل ترانسفيراز 2 .[13] يلعب الكارنتين أيضًا دورًا في تثبيت مستويات Acetyl-CoA وcoenzyme A من خلال القدرة على تلقي أو إعطاء مجموعة الأسيتيل.[2]
توزيع أنسجة إنزيمات الكارنتين التخليقية
يشير توزيع أنزيمات الكارنتين التخليقية في الأنسجة في البشر إلى أن TMLD نشط في الكبد والقلب والعضلات والدماغ والأعلى في الكلى.[14] تم العثور على نشاط HTMLA بشكل أساسي في الكبد. يكون معدل أكسدة TMABA أكبر في الكبد، مع نشاط كبير أيضًا في الكلى.[2][14]
نظام مكوك كارنيتين
وصلة=https://es.wikipedia.org/wiki/Archivo:Bios%C3%ADntesis_de_la_carnitina_en_mam%C3%ADferos.png|يسار|تصغير|400x400بك|التخليق الحيوي للكارنتين في الثدييات. الأحماض الدهنية الحرة العائمة، المنبعثة من الأنسجة الدهنية إلى الدم، ترتبط بجزيء البروتين الحامل المعروف باسم ألبومين المصل الذي يحمل الأحماض الدهنية إلى سيتوبلازم الخلايا المستهدفة مثل القلب والعضلات الهيكلية وخلايا الأنسجة الأخرى، حيث تستخدم للوقود. ولكن قبل أن تتمكن الخلايا المستهدفة من استخدام الأحماض الدهنية لإنتاج ATP والأكسدة، يجب تنشيط الأحماض الدهنية ذات أطوال سلسلة من 14 كربونًا أو أكثر ونقلها لاحقًا إلى مصفوفة الميتوكوندريا للخلايا في ثلاثة تفاعلات إنزيمية لمكوك الكارنتين . [15]
التفاعل الأول لمكوك الكارنتين هو عملية من خطوتين يتم تحفيزها بواسطة عائلة من إنزيمات إنزيم أسيل- CoA الموجودة في غشاء الميتوكوندريا الخارجي، حيث تعزز تنشيط الأحماض الدهنية عن طريق تكوين رابطة ثيويستر بين الأحماض الدهنية مجموعة الكربوكسيل ومجموعة الثيول من الإنزيم المساعد A لإنتاج أسيل-CoA الدهني.[15]
في الخطوة الأولى من التفاعل، يحفز مركب acyl-CoA synthetase نقل مجموعة الأدينوزين أحادي الفوسفات (AMP) من جزيء ATP إلى الحمض الدهني لتوليد مجموعة أسيل أدينيلات وسيطة الدهنية ومجموعة بيروفوسفات (PP i). يتم تحلل بيروفوسفات، المتكون من التحلل المائي لاثنين من الروابط عالية الطاقة في ATP، على الفور إلى جزيئين من P i بواسطة بيروفوسفاتيز غير عضوي. هذا التفاعل شديد الطاقة مما يدفع تفاعل التنشيط إلى الأمام ويجعله أكثر ملاءمة. في الخطوة الثانية، تهاجم مجموعة الثيول من الإنزيم المساعد العصاري الخلوي الأسيل أدينيلات، مما يؤدي إلى إزاحة AMP لتشكيل thioester acyl-CoA الدهني.[15]
في التفاعل الثاني، يتم ربط acyl-CoA بشكل عابر بمجموعة الهيدروكسيل من الكارنتين لتكوين أسيل كارنيتين الدهني. يتم تحفيز هذا التحويل بواسطة إنزيم موجود في الغشاء الخارجي للميتوكوندريا المعروف باسم كارنيتين أسيل ترانسفيراز 1 (ويسمى أيضًا كارنيتين بالميتويل ترانسفيراز 1، CPT1).[15]
تشكل إستر الأسيل-كارنيتين الدهني ثم ينتشر عبر الفضاء بين الغشاء ويدخل المصفوفة عن طريق الانتشار السهل من خلال كارنيتين-أسيل كارنيتين ترانسيلوكاز (CACT) الموجود على غشاء الميتوكوندريا الداخلي. هذا المضاد يعيد جزيء واحد من الكارنتين من المصفوفة إلى الحيز بين الغشاء لكل جزيء من الأسيل كارنيتين الدهني الذي ينتقل إلى المصفوفة.[15]
في التفاعل الثالث والأخير لمكوك الكارنتين، يتم نقل مجموعة الأسيل الدهنية من الأسيل كارنيتين الدهني إلى الإنزيم المساعد A، وتجديد الأسيل الدهني - CoA وجزيء الكارنتين الحر. يحدث هذا التفاعل في مصفوفة الميتوكوندريا ويتم تحفيزه بواسطة كارنيتين أسيل ترانسفيراز 2 (يسمى أيضًا كارنيتين بالميتويل ترانسفيراز 2، CPT2)، والذي يقع على الوجه الداخلي للغشاء الداخلي للميتوكوندريا. يتم بعد ذلك نقل جزيء الكارنتين المتكون مرة أخرى إلى الفضاء بين الغشاء بواسطة نفس الناقل المشترك (CACT) بينما يدخل أسيل- CoA الدهني في الأكسدة β .[15] وصلة=https://id.wikipedia.org/wiki/Berkas:Acyl-CoA_from_cytosol_to_the_mitochondrial_matrix.svg|مركز
الشذوذ المجسم
| ايزومرات الكارنيتين | ||
| لقب | ل- كارنيتين | د- كارنيتين |
| اسماء اخرى | (ص) - كارنيتين
</br> (-) - كارنيتين </br> ليفوكارنيتين |
(ق) - كارنيتين
</br> (+) - كارنيتين |
| الصيغة الهيكلية | وصلة=https://ar.wikipedia.org/wiki/Datei:(R)-Carnitine_Structural_Formula_V1.svg|150x150بك|L- كارنيتين | وصلة=https://ar.wikipedia.org/wiki/Datei:(S)-Carnitine_Structural_Formula_V1.svg|150x150بك|D- كارنيتين |
| CAS رقم | 541-15-1 | 541-14-0 |
| 406-76-8 (DL) | ||
| رقم EC | 208-768-0 | 625-884-0 |
| 206-976-6 (DL) | ||
| بطاقة معلومات ECHA | 100.007.972 | 100.154.337 |
| 100.006.343 (DL) | ||
| بوبكيم | بوبكيم 10917 | بوبكيم 2724480 |
| بوبكيم 288 (دل) | ||
| DrugBank | DB00583 | - |
| - (DL) | ||
| ويكي بيانات | Q20735709 | Q27108687 |
| Q243309 (DL) | ||
تنظيم أكسدة الأحماض الدهنية
وصلة=https://es.wikipedia.org/wiki/Archivo:Acyl-CoA_from_cytosol_to_the_mitochondrial_matrix_by_carnitine.svg|يسار|تصغير|349x349بك|تنشيط الأحماض الدهنية وانتقال أسيل CoA الناتج بفضل الكارنتين.1: acyl-CoA synthetase 2: translocase. .A: mitochondrial ب: الفضاء بين الغشاء. ج: الغشاء الداخلي للميتوكوندريا د: مصفوفة الميتوكوندريا. تعتبر عملية الدخول بوساطة الكارنتين عاملاً محددًا لمعدل أكسدة الأحماض الدهنية وهي نقطة تنظيم مهمة.[15]
كبت
يبدأ الكبد بنشاط في إنتاج الدهون الثلاثية من الجلوكوز الزائد عندما يتم إمداده بالجلوكوز الذي لا يمكن أكسدته أو تخزينه كجليكوجين. مما يزيد من تركيز malonyl-CoA، وهو الوسيط الأول في تخليق الأحماض الدهنية، مما يؤدي إلى تثبيط كارنيتن أسيل ترانسفيراز 1، وبالتالي منع دخول الأحماض الدهنية إلى مصفوفة الميتوكوندريا من أجل أكسدة. يمنع هذا التثبيط تكسير الأحماض الدهنية أثناء حدوث التوليف.[15]
التنشيط
يحدث تنشيط مكوك الكارنتين بسبب الحاجة إلى أكسدة الأحماض الدهنية اللازمة لإنتاج الطاقة. أثناء تقلص العضلات القوي أو أثناء الصيام، ينخفض تركيز ATP ويزيد تركيز AMP مما يؤدي إلى تنشيط بروتين كيناز المنشط AMP (AMPK). AMPK فسفوريلات أسيتيل- CoA carboxylase، والذي عادة ما يحفز تخليق malonyl-CoA. تثبط عملية الفسفرة الكربوكسيلاز acetyl-CoA، والذي بدوره يقلل من تركيز malonyl-CoA. تعمل المستويات المنخفضة من malonyl-CoA على تثبيط كارنيتين أسيل ترانسفيراز 1، مما يسمح باستيراد الأحماض الدهنية إلى الميتوكوندريا، مما يؤدي في النهاية إلى تجديد إمداد ATP .[15]
عوامل النسخ
مستقبلات البيروكسيسوم المنشط بالتكاثر (PPAR α) هي مستقبل نووي يعمل كعامل نسخ. يعمل في العضلات والأنسجة الدهنية والكبد لتشغيل مجموعة من الجينات الأساسية لأكسدة الأحماض الدهنية، بما في ذلك ناقلات الأحماض الدهنية كارنيتين أسيل ترانسفيراز 1 و 2، ونزعات هيدروجيناز أسيل - CoA الدهنية لفترة قصيرة ومتوسطة وطويلة وطويلة جدًا سلاسل أسيل والإنزيمات ذات الصلة.[15]
يعمل PPAR α كعامل نسخ في حالتين؛ فكما ذكرنا من قبل عندما يكون هناك طلب متزايد على الطاقة من تقويض الدهون، مثل أثناء الصيام بين الوجبات أو الجوع طويل الأمد. إلى جانب ذلك، الانتقال من الأيض الجنيني إلى الأيض في القلب. في الجنين، مصادر الوقود في عضلة القلب هي الجلوكوز واللاكتات، ولكن في قلب الأطفال حديثي الولادة، تعتبر الأحماض الدهنية الوقود الرئيسي الذي يتطلب تنشيط PPAR α بحيث يكون بدوره قادرًا على تنشيط الجينات الأساسية لاستقلاب الأحماض الدهنية في هذه المرحلة.[15]
عيوب التمثيل الغذائي لأكسدة الأحماض الدهنية
تم تحديد أكثر من 20 عيبًا وراثيًا بشريًا في نقل الأحماض الدهنية أو الأكسدة. في حالة عيوب أكسدة الأحماض الدهنية، تتراكم الأسيل كارنيتينات في الميتوكوندريا وتنتقل إلى العصارة الخلوية، ثم إلى الدم. يمكن الكشف عن مستويات البلازما من الأسيل كارنيتين عند الأطفال حديثي الولادة في عينة دم صغيرة عن طريق قياس الطيف الكتلي الترادفي.[15]
عندما تكون الأكسدة β معيبة بسبب طفرة أو نقص في الكارنتين، فإن أكسدة الأحماض الدهنية تصبح أكثر أهمية في الثدييات. في الواقع، يعتبر ω أكسدة الأحماض الدهنية مسارًا آخر لتدهور FA في بعض أنواع الفقاريات والثدييات التي تحدث في الشبكة الإندوبلازمية للكبد والكلى، وهي أكسدة ω (أوميغا) كربون - وهو الكربون الأكثر بعدًا عن مجموعة الكربوكسيل (على عكس الأكسدة التي تحدث في نهاية الكربوكسيل من الأحماض الدهنية، في الميتوكوندريا).[2][15]
التأثيرات الفسيولوجية
كمثال على التركيب الطبيعي، 70 كيلوغرام (150 رطل) ينتج الشخص 11-34 مجم من الكارنتين يوميًا.[2] يتناول البالغون وجبات مختلطة من اللحوم الحمراء ومنتجات حيوانية أخرى حوالي 60-180 مجم من الكارنتين يوميًا، بينما يستهلك النباتيون حوالي 10-12 مجم يوميًا.[4] يتم امتصاص معظم الكارنتين (54-86٪) الذي تم الحصول عليه من النظام الغذائي في الأمعاء الدقيقة قبل دخول الدم.[4] يبلغ إجمالي محتوى الجسم من الكارنتين حوالي 20 غرام (0.71 أونصة) في شخص وزن 70 كيلوغرام (150 رطل)، مع احتوائه كله تقريبًا داخل خلايا العضلات الهيكلية.[4] كارنيتين يستقلب بمعدلات حوالي 400 ميكرولتر في اليوم، وهي كمية أقل من 1٪ من إجمالي مخزون الجسم.[16]
نقص
يعتبر نقص الكارنتين نادرًا في الأشخاص الأصحاء الذين لا يعانون من اضطرابات التمثيل الغذائي، مما يشير إلى أن معظم الناس لديهم مستويات طبيعية وكافية من الكارنتين التي يتم إنتاجها عادة من خلال استقلاب الأحماض الدهنية.[2] وجدت إحدى الدراسات أن النباتيين لا يظهرون أي علامات على نقص الكارنيتين.[2] الرضع، وخاصة الأطفال الخدج، لديهم مخزون منخفض من الكارنتين، مما يستلزم استخدام تركيبات الرضع المدعمة بالكارنتين كبديل لحليب الثدي، إذا لزم الأمر.[2]
يوجد نوعان من حالات نقص الكارنيتين. نقص الكارنتين الأولي هو اضطراب وراثي في نظام نقل الكارنتين الخلوي الذي يظهر عادةً في سن الخامسة مع أعراض اعتلال عضلة القلب وضعف العضلات والهيكل العظمي ونقص السكر في الدم.[2][4] قد يحدث نقص الكارنتين الثانوي نتيجة اضطرابات معينة، مثل الفشل الكلوي المزمن، أو في ظل ظروف تقلل من امتصاص الكارنتين أو تزيد من إفرازه، مثل استخدام المضادات الحيوية، وسوء التغذية، وسوء الامتصاص بعد الهضم.[2][4][17]
المكملات
تمت دراسة الكارنتين في حالات مختلفة من أمراض القلب، مما يشير إلى استخدامه كعامل مساعد في أمراض القلب والسكري، من بين العديد من الاضطرابات الأخرى.[2] لا يؤثر الكارنتين في منع الوفيات المرتبطة بأمراض القلب والأوعية الدموية، [18] وليس له تأثير كبير على نسبة الدهون في الدم.[19] لا يؤثر كارنيتين على معظم العوامل في مرض الكلى في المرحلة النهائية، على الرغم من أنه قد يخفض بروتين سي التفاعلي.[20]
على الرغم من الاهتمام الواسع بين الرياضيين باستخدام الكارنتين لتحسين أداء التمرين، أو تثبيط تقلصات العضلات، أو تعزيز التعافي من التدريب البدني، كانت جودة البحث عن هذه الفوائد المحتملة منخفضة، مما يحظر أي نتيجة للتأثير.[2][4] بكميات تكميلية 2–6 غرام (0.071–0.212 أونصة) يوميًا على مدار شهر، لم يكن هناك دليل ثابت على أن الكارنتين يؤثر على التمرين أو الأداء البدني.[4] لا تؤدي مكملات الكارنتين إلى تحسين استهلاك الأكسجين أو وظائف التمثيل الغذائي عند ممارسة الرياضة، كما أنها لا تزيد من كمية الكارنتين في العضلات.[2][4] في الواقع، على عكس العديد من المفاهيم الخاطئة، لا يؤثر L-Carnitine أيضًا على استقلاب الدهون، أي حرق الدهون دون ممارسة الرياضة.[21]
عقم الذكور
يرتبط محتوى الكارنتين في السائل المنوي ارتباطًا مباشرًا بعدد الحيوانات المنوية وحركتها، مما يشير إلى أن المركب قد يكون ذا قيمة في علاج عقم الذكور. خلصت إحدى الدراسات إلى أن مكملات الكارنتين قد تحسن جودة الحيوانات المنوية، وقد تتعلق الفوائد المبلغ عنها بزيادة أكسدة الأحماض الدهنية للميتوكوندريا (توفير المزيد من الطاقة للحيوانات المنوية) وتقليل موت الخلايا في خصيتين الفئران المعرضة للإجهاد البدني للخصيتين.[22]
أمراض القلب والأوعية الدموية والشرايين الطرفية
أقرت العديد من الدراسات فعالية الكارنتين التكميلي في إدارة نقص تروية القلب (تقييد تدفق الدم إلى القلب) وأمراض الشرايين الطرفية. إذا كانت مستويات الكارنتين منخفضة في عضلة القلب الفاشلة، فإن الكميات التكميلية قد تقاوم الآثار السامة للأحماض الدهنية الحرة وتحسن التمثيل الغذائي للكربوهيدرات.[23] يحتوي الكارنتين على خصائص مضادة للإقفار عند تناوله عن طريق الفم والحقن.[24][25]
تصلب الشرايين
Koeth et al. من Cleveland Clinic، أفادوا أن الكارنتين [26] من لحم الحيوانات (أربعة أضعاف الكمية الموجودة في اللحوم الحمراء في الأسماك أو الدجاج)، وكذلك الفوسفاتيديل كولين من صفار البيض، يتم تحويلها بواسطة البكتيريا المعوية إلى ثلاثي ميثيل أمين (ال المركب الذي يسبب رائحة الفم اليوريمية مريب). يتأكسد Trimethylamine في الكبد إلى ثلاثي ميثيل أمين N -oxide (TMAO)، والذي يسبب تصلب الشرايين في النماذج الحيوانية. كان لدى المرضى في الربع الأعلى من TMAO زيادة بمقدار 2.5 ضعف في خطر 3 سنوات من السكتة الدماغية أو الموت أو احتشاء عضلة القلب.
القضية الرئيسية هي أن النباتيين الذين استهلكواlلم ينتج -carnitine TMAO لأنهم لم يكن لديهم البكتيريا المعوية التي تنتج TMA من الكارنيتين.[27]
داء السكري من النوع 2
داء السكري من النوع 2، الذي يتميز بمقاومة الأنسولين، قد يترافق مع خلل في أكسدة الأحماض الدهنية في العضلات. تشير العديد من الدراسات إلى أن مكملات الكارنتين قد يكون لها تأثير مفيد على استخدام الجلوكوز وتقليل الاعتلال العصبي السكري.[28]
الإيدز وفيروس نقص المناعة البشرية

بشكل عام، المرضى المصابون بفيروس نقص المناعة البشرية تتراكم الدهون في بعض مناطق الجسم وتفقد الدهون في مناطق أخرى، إلى جانب ارتفاع مستويات الدهون في الدم (فرط شحميات الدم) ومقاومة الأنسولين والتي تعرف باسم متلازمة الحثل الدهني. هذه المتلازمة تسبب نقص فيl كارنيتين الذي يسبب عيوب التمثيل الغذائي للدهون في الميتوكوندريا.[29] قد تؤدي إضافة الكارنتين في الأشخاص المصابين بفيروس نقص المناعة البشرية إلى إبطاء موت الخلايا الليمفاوية وتقليل الاعتلال العصبي والتأثير بشكل إيجابي على مستويات الدهون في الدم.[29]
الجهاز المناعي
كمكمل غذائي، يبدو أن L-Carnitine يساعد في مكافحة COVID-19 (فيروس كورونا) والميكوبلازما عن طريق تقليل الأعراض مثل السعال. يبدو أن إل-كارنتين أكثر فائدة للذكور (انظر خصوبة الذكور أعلاه). قد يفسر هذا الارتباط بين الجنسين أيضًا ارتفاع معدل الوفيات بفيروس COVID-19 بين الرجال [30]
مرض الكلى في نهاية المرحلة وغسيل الكلى
تساهم الكلى في التوازن العام في الجسم، بما في ذلك مستويات الكارنيتين. في حالة القصور الكلوي، يمكن أن يؤدي التخلص من زيادة الكارنتين في البول، وانخفاض التوليف الداخلي، وسوء التغذية نتيجة لفقدان الشهية الناجم عن المرض إلى نقص الكارنيتين. يمكن أن تصبح مستويات الكارنتين في الدم ومخزون العضلات منخفضة للغاية، مما قد يساهم في فقر الدم وضعف العضلات والتعب وتغيير مستويات الدهون في الدم واضطرابات القلب أظهرت بعض الدراسات أن تناول جرعات عالية منl -carnitine (غالبًا ما يتم حقنه) قد يساعد في إدارة فقر الدم.[31][32]
مصادر الكارنتين
المصادر الطبيعية التي تحتوي على الكارنتين ليست كثيرة. وأهمها اللحوم الحمراء وتحديدا لحوم البقر حيث تحتوي على الكم الأكبر بين الاغذية، ثم سمك القد ثم لحم الدجاج ومنتجات الألبان، ويوجد في كميات صغيرة جدا في الخضروات. مما يجعل استخدام المكملات الغذائية الخيار الأفضل في حالات النقص.
الشكل الموجود في الجسم هوl كارنيتين، وهو أيضًا الشكل الموجود في الطعام. مصادر الغذاء غنيةl كارنيتين هي منتجات حيوانية، وخاصة لحوم البقر ولحم الخنزير.[2] تميل اللحوم الحمراء إلى أن تحتوي على مستويات أعلى منl كارنيتين.[17][19][33] البالغون الذين يتناولون وجبات غذائية متنوعة تحتوي على منتجات حيوانية يحصلون على حوالي 60-180 مجم من الكارنتين يوميًا.[34] يصبح النباتيون أقل بشكل ملحوظ (حوالي 10–12 mg) لأن وجباتهم الغذائية تفتقر إلى هذه الأطعمة المشتقة من الحيوانات الغنية بالكارنيتين. يتم امتصاص حوالي 54٪ إلى 86٪ من الكارنتين الغذائي في الأمعاء الدقيقة، ثم يدخل الدم.[17][34] حتى الأنظمة الغذائية التي تفتقر إلى الكارنتين لها تأثير ضئيل على محتوى الكارنتين الكلي، حيث تحافظ الكلى على الكارنيتين.[17][19]
مصادر غذائية مختارة من الكارنتين [2]
| طعام | ملليغرام (ملغ) |
|---|---|
| شريحة لحم بقري، مطبوخة، 4 أونصة (110 غ) | 56–162 |
| لحم بقري مفروم مطبوخ، 4 أونصة (110 غ) | 87-99 |
| حليب كامل الدسم 1 كوب (237 ز) | 8 |
| سمك القد، مطبوخ، 4 أونصة (110 غ) | 4-7 |
| صدر دجاج مطبوخ، 4 أونصة (110 غ) | 3-5 |
| آيس كريم نصف كوب (125 مل) | 3 |
| جبنة، شيدر، 2 أونصة (57 غ) | 2 |
| خبز القمح الكامل، شريحتان | 0.2 |
| الهليون المطبوخ، نصف كوب (62 غرام) | 0.1 |
| طعام | ل- كارنيتين
> ملغم / 100 جم |
طعام | ل- كارنيتين
</br> ملغم / 100 جم |
طعام | ل- كارنيتين
</br> ملغم / 100 جم |
طعام | ل- كارنيتين
</br> ملغم / 100 جم |
|---|---|---|---|---|---|---|---|
| اللحوم | 3686 | عجل | 69.7-105 | الفطر | 1.3-15 | بديل لبن الأم | 1-4.3 |
| أيل، أيل، إلك، رنة | 35-193 | خنزير بري | 18-46 | دواجن | 4.3-13.3 | زيت طبخ، زبدة، سمن | 0-1.1 |
| الأغنام والماعز | 16.7-190 | منتجات اللحوم | 1.2-38.6 | حيوانات البحر | 1.7-13.2 | الحبوب (الخبز والمعكرونة والأرز) | 0.33-0.75 |
| الحصان، الكنغر | 117-166 | أرانب | 10.2-24.4 | جبنه | 0.6-12.7 | المكسرات | 0.02-0.67 |
| لحم بقري | 45-143 | خنزير محلي | 14.4-24 | الحليب ومنتجات الألبان | 2.1-9.7 | خضروات | 0.05-0.53 |
| أرنب | 44.1-120 | طيور برية | 3-21.1 | مرق | 1.1-6.1 | فاكهة | 0.01-0.35 |
بشكل عام، يستهلك البشر النهمون كل يوم ما بين 2 و 12 µ مول كجم − 1 من وزن الجسم، وهو ما يمثل 75٪ من الكارنتين في الجسم. ينتج البشر داخليًا 1.2 µ مول كجم − 1 من وزن الجسم من الكارنتين بشكل يومي، وهو ما يمثل 25٪ من الكارنتين في الجسم.[35][36][37] يحصل النباتيون المتشددون على القليل من الكارنتين من المصادر الغذائية (0.1 µ مول كجم − 1 من وزن الجسم يومياً)، حيث توجد بشكل أساسي في الأطعمة المشتقة من الحيوانات.[2][36][38]
مآخذ الكارنتين الموصى بها
في عام 1989، خلص مجلس الغذاء والتغذية إلى أن الكارنتين لم يكن عنصرًا غذائيًا أساسيًا لأن الكبد والكلى البشري السليم يصنعان كميات كافية من الكارنتين من اللايسين والميثيونين لتلبية متطلبات الجسم اليومية دون الحاجة إلى تناوله من المكملات الغذائية أو الطعام.[17][33] أيضًا، لم يؤسس FNB المدخول الغذائي المرجعي (DRIs) للكارنيتين.[39]
المصادر التكميلية للكارنتين
يتوفر كلاً من L-carnitine (الكارنتين) وacetyl-l-carnitine (أستيل الكارنتين) وpropionyl-l-carnitine في صورة حبوب أو مساحيق من المكملات الغذائية.[40] كما أنه دواء معتمد من قبل إدارة الغذاء والدواء لعلاج متلازمات نقص الكارنتين الأولية والثانوية.[40]
فوائده
الكارنتين له فوائد عديدة للجسم، وأهمها في عملية فقد الدهون وتحديداً بعملية أكسدة الاحماض الدهنية، فالكارنتين مسئول عن نقل الأحماض الدهنية للميتوكوندريا في الخلايا، وهناك تستعمل الاحماض الدهنية لإنتاج الطاقة المهمة جداً للجسم. فالسلاسل الطويلة من الدهون المشبعة من الأحماض الدهنية لها قابلية ضعيفة جداً ومحدودة لاجتياز الجدار الداخلي للميتوكندريا عندما تكون على شكل CoA ثيو إستر، ولكن هذه القابلية تزيد بتحفيز الكارنتين، وهنا تكمن الاهمية .[41]
كمية الدهون التي تفقد من الجسم خلال التدريب تعتمد اعتمادا مباشرا على كمية الأحماض الدهنية المنقولة إلى الميتوكوندريا. على هذا النحو، سوف يتم حرق الدهون في الجسم فقط وبقدر ما يتم نقله من الأحماض الدهنية بواسطة الكارنتين إلى الميتوكوندريا، بغض النظر عن مقدار داعمات حرق الدهون التي يتم تناولها.
التفاعلات الدوائية والآثار الضارة
يتفاعل الكارنتين مع المضادات الحيوية المقترنة ببيالتات مثل البيفامبيسيلين. يؤدي الاستخدام المزمن لهذه المضادات الحيوية إلى زيادة إفراز بيفالويل كارنيتين، مما قد يؤدي إلى نضوب الكارنيتين.[17][34] العلاج بمضادات الاختلاج حمض الفالبرويك، الفينوباربيتال، الفينيتوين، أو الكاربامازيبين يقلل بشكل كبير من مستويات الكارنتين في الدم.[5][42]
عندما تؤخذ بكمية تقارب 3 غرام (0.11 أونصة) يوميًا، قد يسبب الكارنتين الغثيان والقيء وتشنجات البطن والإسهال ورائحة الجسم مثل رائحة السمك.[5] تشمل الآثار الضائرة المحتملة الأخرى الطفح الجلدي أو ضعف العضلات أو النوبات لدى الأشخاص المصابين بالصرع.[5]
التاريخ
تمت الموافقة على Levocarnitine من قبل إدارة الغذاء والدواء الأمريكية ككيان جزيئي جديد تحت الاسم التجاري Carnitor في 27 ديسمبر 1985.[5][6]
انظر أيضًا
مصادر ومراجع
- العنوان : DL-Carnitine — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/288 — تاريخ الاطلاع: 19 نوفمبر 2016 — الرخصة: محتوى حر
- "L-Carnitine"، Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis, OR، 01 ديسمبر 2019، مؤرشف من الأصل في 26 نوفمبر 2020، اطلع عليه بتاريخ 29 أبريل 2020.
- "Carnitine--metabolism and functions"، Physiological Reviews، 63 (4): 1420–80، أكتوبر 1983، doi:10.1152/physrev.1983.63.4.1420، PMID 6361812.
- "Carnitine"، Office of Dietary Supplements, US National Institutes of Health، 10 أكتوبر 2017، مؤرشف من الأصل في 24 نوفمبر 2020، اطلع عليه بتاريخ 29 أبريل 2020.
- "L-carnitine: Uses, benefits and dosage"، Drugs.com، 20 يناير 2020، مؤرشف من الأصل في 31 أكتوبر 2020، اطلع عليه بتاريخ 29 أبريل 2020.
- "Levocarnitine"، PubChem, National Library of Medicine, US National Institutes of Health، 25 أبريل 2020، مؤرشف من الأصل في 7 أغسطس 2020، اطلع عليه بتاريخ 29 أبريل 2020.
- "Comparison of the effects of L-carnitine, D-carnitine and acetyl-L-carnitine on the neurotoxicity of ammonia"، Biochemical Pharmacology، 46 (1): 159–64، يوليو 1993، doi:10.1016/0006-2952(93)90360-9، PMID 8347126.
- "Biosynthesis of carnitine and 4-N-trimethylaminobutyrate from 6-N-trimethyl-lysine"، The Biochemical Journal، 136 (4): 1083–90، ديسمبر 1973، doi:10.1042/bj1361083، PMID 4786530.
- "Preface: Carnitine: Lessons from One Hundred Years of Research"، Annals of the New York Academy of Sciences، 1033 (1): ix–xi، نوفمبر 2004، Bibcode:2004NYASA1033D...9.، doi:10.1196/annals.1320.019.
- "L-Carnitine"، Linus Pauling Institute (باللغة الإنجليزية)، 23 أبريل 2014، مؤرشف من الأصل في 26 نوفمبر 2020، اطلع عليه بتاريخ 25 أغسطس 2020.
- "Crystal structure of human gamma-butyrobetaine hydroxylase"، Biochemical and Biophysical Research Communications، 398 (4): 634–9، أغسطس 2010، doi:10.1016/j.bbrc.2010.06.121، PMID 20599753.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - "Enzymology of the carnitine biosynthesis pathway"، IUBMB Life، 62 (5): 357–62، مايو 2010، doi:10.1002/iub.323، PMID 20306513.
- "Role of carnitine in disease"، Nutrition & Metabolism، 7: 30، أبريل 2010، doi:10.1186/1743-7075-7-30، PMID 20398344.
- "Tissue distribution of carnitine biosynthetic enzymes in man"، Biochimica et Biophysica Acta (BBA) - General Subjects، 630 (1): 22–9، يونيو 1980، doi:10.1016/0304-4165(80)90133-6، PMID 6770910.
- Lehninger principles of biochemistry (ط. 7th)، New York, NY: W.H. Freeman and Company، 2017.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - "Carnitine deficiency disorders in children"، Annals of the New York Academy of Sciences، 1033 (1): 42–51، نوفمبر 2004، Bibcode:2004NYASA1033...42S، doi:10.1196/annals.1320.004، PMID 15591002.
- "Carnitine"، Modern Nutrition in Health and Disease (ط. 9th)، New York: Lippincott Williams & Wilkins، 1999، ص. 505–12.
- "Effective dosing of ʟ-carnitine in the secondary prevention of cardiovascular disease: a systematic review and meta-analysis"، BMC Cardiovascular Disorders، 14: 88، يوليو 2014، doi:10.1186/1471-2261-14-88، PMID 25044037.
- "Influence of ʟ-carnitine supplementation on serum lipid profile in hemodialysis patients: a systematic review and meta-analysis"، Kidney & Blood Pressure Research، 38 (1): 31–41، 01 يناير 2013، doi:10.1159/000355751، PMID 24525835.
- "ʟ-Carnitine supplementation for adults with end-stage kidney disease requiring maintenance hemodialysis: a systematic review and meta-analysis"، The American Journal of Clinical Nutrition، 99 (2): 408–22، فبراير 2014، doi:10.3945/ajcn.113.062802، PMID 24368434.
- "Facts About Liquid L-Carnitine: Features, Side Effects, Effectiveness"، Fitness Site about Healthy Lifestyle (باللغة الإنجليزية)، 16 يونيو 2020، مؤرشف من الأصل في 29 أكتوبر 2020، اطلع عليه بتاريخ 25 أغسطس 2020.
- "The role of carnitine in the male reproductive system"، Annals of the New York Academy of Sciences، 1033 (1): 177–88، نوفمبر 2004، Bibcode:2004NYASA1033..177N، doi:10.1196/annals.1320.017، PMID 15591015.
- "Carnitine therapy for the treatment of metabolic syndrome and cardiovascular disease: evidence and controversies"، Nutrition, Metabolism, and Cardiovascular Diseases، 24 (8): 808–14، أغسطس 2014، doi:10.1016/j.numecd.2014.03.007، PMID 24837277، مؤرشف من الأصل (print, online review) في 10 يوليو 2020، اطلع عليه بتاريخ 22 يناير 2016.
- "Therapeutic effects of ʟ-carnitine and propionyl-ʟ-carnitine on cardiovascular diseases: a review"، Annals of the New York Academy of Sciences، 1033 (1): 79–91، نوفمبر 2004، Bibcode:2004NYASA1033...79F، doi:10.1196/annals.1320.007، PMID 15591005.
- "Carnitine and peripheral arterial disease"، Annals of the New York Academy of Sciences، 1033 (1): 92–8، نوفمبر 2004، Bibcode:2004NYASA1033...92H، doi:10.1196/annals.1320.008، PMID 15591006.
- "Intestinal microbiota metabolism of ʟ-carnitine, a nutrient in red meat, promotes atherosclerosis"، Nature Medicine، 19 (5): 576–85، مايو 2013، doi:10.1038/nm.3145، PMID 23563705.
- "Recent advances in pathogenesis, assessment, and treatment of atherosclerosis"، F1000Research، 5: 1880، 28 يوليو 2016، doi:10.12688/f1000research.8459.1، PMID 27540477.
- "Role of carnitine and its derivatives in the development and management of type 2 diabetes"، Nutrition & Diabetes، 8 (1): 8، مارس 2018، doi:10.1038/s41387-018-0017-1، PMID 29549241.
- "Acetyl-ʟ-carnitine for the treatment of HIV lipoatrophy"، Annals of the New York Academy of Sciences، 1033 (1): 139–46، نوفمبر 2004، Bibcode:2004NYASA1033..139D، doi:10.1196/annals.1320.013، PMID 15591011.
- COVID-19 National Incident Room Surveillance Team (24 أبريل 2020)، "COVID-19, Australia: Epidemiology Report 12: Reporting week ending 23:59 AEST 19 April 2020"، Communicable Diseases Intelligence، 44، doi:10.33321/cdi.2020.44.36، ISSN 2209-6051، PMID 32343939.
- "Carnitine replacement in end-stage renal disease and hemodialysis"، Annals of the New York Academy of Sciences، 1033 (1): 52–66، نوفمبر 2004، Bibcode:2004NYASA1033...52C، doi:10.1196/annals.1320.005، PMID 15591003.
- "Effects of ʟ-carnitine supplementation in maintenance hemodialysis patients: a systematic review"، Journal of the American Society of Nephrology، 13 (3): 708–14، مارس 2002، PMID 11856775.
- National Research Council (US) Subcommittee on the Tenth Edition of the Recommended Dietary Allowances (1989)، "Carnitine" (PDF)، Recommended Dietary Allowances (ط. 10th)، Washington DC: دار نشر الأكاديميات الوطنية، ص. 265–266، PMID 25144070.
- Rebouche, C. J. (2004)، "Kinetics, pharmacokinetics, and regulation of ʟ-carnitine and acetyl-ʟ-carnitine metabolism"، Annals of the New York Academy of Sciences، 1033 (1): 30–41، Bibcode:2004NYASA1033...30R، doi:10.1196/annals.1320.003، PMID 15591001.
- Rebouche, C. J. (1996)، "Role of carnitine biosynthesis and renal conservation of carnitine in genetic and acquired disorders of carnitine metabolism"، في Seim, Hermann؛ Löster, Heinz (المحررون)، Carnitine: Pathobiochemical Basics and Clinical Applications، Bochum: Ponte Press، ص. 111–121، ISBN 9783920328249.
- "Carnitine function and requirements during the life cycle"، FASEB Journal، 6 (15): 3379–86، ديسمبر 1992، doi:10.1096/fasebj.6.15.1464372، PMID 1464372.
- "Characterization of the human plasmalemmal carnitine transporter in cultured skin fibroblasts"، Archives of Biochemistry and Biophysics، 329 (2): 145–55، مايو 1996، doi:10.1006/abbi.1996.0203، PMID 8638946.
- "Carnitine status of lactoovovegetarians and strict vegetarian adults and children"، The American Journal of Clinical Nutrition، 50 (2): 301–6، أغسطس 1989، doi:10.1093/ajcn/50.2.301، PMID 2756917.
- "Carnitine: Fact Sheet for Health Professionals"، Office of Dietary Supplements, معاهد الصحة الوطنية الأمريكية، 10 أكتوبر 2017، مؤرشف من الأصل في 24 نوفمبر 2020، اطلع عليه بتاريخ 12 يناير 2020.
- "Office of Dietary Supplements - Carnitine"، ods.od.nih.gov (باللغة الإنجليزية)، مؤرشف من الأصل في 24 نوفمبر 2020، اطلع عليه بتاريخ 22 ديسمبر 2020.
- activation-and-transportation-of-fatty-acids-to-the-mitochondria-via-the-carnitine-shuttle نسخة محفوظة 07 يوليو 2017 على موقع واي باك مشين.
- "Reduction of serum carnitine concentrations during anticonvulsant therapy with phenobarbital, valproic acid, phenytoin, and carbamazepine in children"، The Journal of Pediatrics، 119 (5): 799–802، نوفمبر 1991، doi:10.1016/s0022-3476(05)80306-3، PMID 1941389.