نيكل
النيكل عنصرٌ كيميائي رمزه Ni وعدده الذرّي 28، وهو ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة العاشرة في الجدول الدوري؛ ويصنّف كيميائياً ضمن الفلزّات الانتقالية. النيكل فلزٌ أبيض فضّي بمظهرٍ ذهبيٍّ خفيفٍ، وهو أحد المواد المغناطيسية. لمسحوق النيكل النقي نشاط كيميائي جيّد؛ أمّا القطع كبيرة الحجم فهي بطيئة التفاعل في الظروف القياسية من الضغط ودرجة الحرارة، ويعود سبب ذلك إلى تشكّل طبقةٍ مُخَمّلةٍ من الأكسيد على السطح. لا يوجد النيكل في الطبيعة بشكله الحرّ إلّا نادراً، ولكنّه غالباً ما يكون مرتبطاً مع عناصرَ أخرى ضمن معادن مختلفة، وخاصة في طبقات الصخور فوق المافية. تكثر خامات النيكل في روسيا وكندا، وكذلك في جزر كاليدونيا الجديدة في المحيط الهادي. ينتج النيكل في الكون من عملية التخليق النووي في المستعرات العظمى؛ وهو يدخل في تركيب الحديد النيزكي والمستحصل من النيازك الحديدية، والتي كانت منتشرة على سطح الأرض في العصور التاريخية الأولى من عمر الأرض. يدخل النيكل أيضاً مع الحديد في تركيب اللبّ الداخلي والخارجي لباطن الأرض.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي ذو بريق ذهبي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | نيكل، 28، Ni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 10، 4، d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 58.6934(4) غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d8 4s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 17, 1 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 8.908 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 7.81 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1728 ك، 1455 °س، 2651 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3186 ك، 2913 °س، 5275 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 17.48 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 377.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 26.07 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 4[1], 3, 2, 1 [2], -1 (أكاسيده قاعدية ضعيفة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.91 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 737.1 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1753.0 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3395 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 124 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±124 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 163 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية حديدية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 69.3 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 90.9 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 13.4 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) 4900 متر·ثانية−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 200 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 76 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 180 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 4.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 638 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 700 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-02-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر النيكل | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
كان أكسل فريدريك كرونستيد أوّل من تمكّن من عزل فلزّ النيكل، وذلك في سنة 1751، ولكنه أخطأ في البداية وظنّه معدناً من معادن النحاس؛ ثمّ تمكّن بعد ذلك من تمييزه على أنّه عنصرٍ كيميائيٍّ جديد. تُشتَقّ تسمية هذا العنصر من الأساطير الجرمانية، إذ كان ينتشر بين عمال المناجم لفظ «نيكل» للإشارة إلى اسم عفريت، والذي كان يطلق على خامة من خامات النيكل والنحاس، والتي لم يكن ينتج عن صهرها فلزّ النحاس المنشود. استُخدِمَ النيكل منذ اكتشافه في طلي الحديد والنحاس الأصفر، وفي صناعة السبائك؛ كما يكثر استخدام النيكل في سكّ النقود المعدنية. للنيكل تطبيقاتٍ عمليّةٍ أخرى في مجال التحفيز الكيميائي، مثل نيكل راني، وفي صناعة بطّاريات المَرْكبات الكهربائية.
يقوم النيكل بدورٍ حيويٍّ مهمٍّ لبعض النباتات، إذ تحوي بعض الإنزيمات المهمة لها على النيكل في الموقع النشط. من جهةٍ أخرى، قد يسبّب تماس الجلد لدى البعض مع الأشياء المصنوعة من النيكل إلى حدوث حالة من التهاب الجلد التماسي التحسّسي، والمعروفة باسم «حساسية النيكل»
التاريخ

بسبب سهولة الخلط بين خامات النيكل وبين خامات الفضّة والنحاس، فإنّ الفهم الكامل لخواص فلزّ النيكل لم يتمّ إلّا في العصور الحديثة نسبياً. بالرغم من ذلك، فإنّ النيكل المرافق لخامات النحاس والفضّة قد بُرْهِنَ على دخوله بنسبة عظمى تصل إلى 2% من تركيب قطع أثريّة تاريخيّة قديمة مصنوعة من البرونز، عثر عليها في سورية، وتعود إلى أقدم من 3500 ألف سنة قبل الميلاد.[3] كما تشير بعض النصوص الصينية القديمة إلى سبيكة من النحاس الأبيض، والتي كانت تعرف باسم بايتونغ [ملاحظة 1]، وهي تعرف حالياً باسم سبيكة «النيكل النحاسي» كبرونيكل [ملاحظة 2]، وكانت مستخدمةً حينها في عهود تتراوح بين 1700 إلى 1400 سنة قبل الميلاد. صُدِّرَ هذا النحاس الأبيض إلى دول أوروبا الغربية في بدايات القرن السابع عشر، ولكن لم يعرف أنّ تلك السبيكة كانت حاويةً على النيكل إلّا في سنة 1822.[4] وُجِدَ أيضاً أنّ نقوداً معدنية كانت قد سُكَّت من سبيكة النيكل النحاسي من الملوك البُخْتريين [ملاحظة 3]: أغاثوكليس [ملاحظة 4] وإيوثيديموس الثاني [ملاحظة 5] وبانتاليون [ملاحظة 6] في القرن الثاني قبل الميلاد، والتي غالباً كانت مُستقدَمةً من الصين.[5]
عُثِرَ في ألمانيا في فترة القرون الوسطى على معدن مصفَرّ في منطقة جبال الخام [ملاحظة 7]، والذي كان يشبه خام النحاس؛ إلّا أنّ عمال المناجم لم يتمكّنوا من استخراج النحاس من ذلك الخام، ممّا دفعهم إلى الاعتقاد بوجود قدرة خارقة تحول دون الحصول على مبتغاهم، لذلك أطلقوا اسم عفريت من الأساطير الجرمانية يدعى نيكل [ملاحظة 8] على اسم ذلك الخام، ليدعى حينها باسم Kupfernickel (كُبفرنيكل، حيث تعني كلمة Kupfer النحاس في اللغة الألمانية).[6][7]

يُعرَف هذا الخام حالياً تحت اسم نيكلين [ملاحظة 9] (سابقاً تحت اسم نيكوليت [ملاحظة 10] [8])؛ وهو يتكوّن كيميائياً من زرنيخيد النيكل. في سنة 1751 تمكّن البارون أكسل فريدريك كرونستيد [ملاحظة 11] أثناء تجاربه لعزل النحاس من معدن كُبفرنيكل في منجم للكوبالت في السويد من الحصول على فلزّ أبيض، ليتبيّن له فيما بعد أنّه عنصر جديد، وأعلن اكتشافه وأطلق عليه اسم «نيكل»، نسبةً إلى أسطورة العفريت التي مَنَحَت الخام ذلك الاسم.[9] لا يزال اسم كُبفرنيكل مستخدماً في اللغة الألمانية، ولكن للإشارة إلى سبيكة النيكل النحاسي (كبرونيكل).[10] [11]
حتّى بداية القرن التاسع عشر كان خام كُبفرنيكل هو الوسيلة الوحيدة للحصول على النيكل، ولكن منذ سنة 1824 أصبح من الممكن الحصول على هذا الفلزّ ناتجاً ثانوياً من عمليات استخراج خضاب أزرق الكوبالت [ملاحظة 12]؛ أمّا الإنتاج على صعيدٍ كبيرٍ فكان قد بدأ في النرويج في سنة 1848 من خامات معدن البيروتيت [ملاحظة 13] الغنيّة بالنيكل. أدّت إضافة النيكل إلى صناعة الحديد والفولاذ في سنة 1889 إلى ازدياد الطلب العالمي على النيكل، وقد ساهم اكتشاف التوضّعات الرسوبية الغنيّة بالنيكل في جزر كاليدونيا الجديدة في تأمين حاجة السوق حتّى بدايات القرن العشرين، ثمّ تلاها اكتشاف كمّيّات كبيرة من خامات النيكل في كندا وروسيا وجنوب أفريقيا، بالشكل الذي أمّن حاجة السوق من هذا الفلزّ.[4]
الوفرة الطبيعية

يتركّز وجود النيكل على كوكب الأرض بمرافقة الحديد في تركيب اللبّ الداخلي [ملاحظة 15] والخارجي [ملاحظة 16] لباطن الأرض؛[12] وتقدّر نسبة الكسر الكتلي للنيكل في لبّ الأرض بحوالي 5%.[13] يدخل النيكل أيضاً في تركيب النيازك الحديدية [ملاحظة 17] وذلك على هيئة شكلين محدّدين من أشكال السبيكة مع الحديد، وهما الكاماسيت [ملاحظة 18] والتاينيت [ملاحظة 19]. تتراوح نسبة النيكل في الكاماسيت بين 5-10%، مع احتمالية وجود شوائب من الكوبالت أو الكربون؛ في حين أنّ محتوى النيكل في التاينيت يتراوح بين 20% إلى 65%.[14] اكتُشِفَ وجود النيكل في النيازك الحديدية أوّل مرّة سنة 1799 من العالم جوزيف لويس بروست [ملاحظة 20]، والذي كان حينها يحلّل عيّنات من النيازك الحديدية المُستَجْلَبَة من موقع كامبو دل ثيلو [ملاحظة 21] الأرجنتيني؛ وَوَجد أنّ نسبة النيكل فيها تصل إلى حوالي 10%.[15]
في الغلاف الصخري
تبلغ وفرة النيكل في القشرة الأرضية مقدار 0.008%؛[16] ومن النادر العثور عليه فيها بشكله الطبيعي الحرّ؛[17][18] بل يوجد غالباً في القشرة الأرضية ضمن معادن مختلفة، وذلك في معدن البنتلانديت [ملاحظة 22] بمرافقة الكبريت والحديد؛ وفي معدن الميلريت [ملاحظة 23] بمرافقة الكبريت؛ وفي معدن النيكلين [ملاحظة 24] بمرافقة الزرنيخ.[19] تُستخرَج خامات النيكل من طبقة اللاتيريت [ملاحظة 25]، والتي تنتشر فيها مزائج للنيكل مع فلزّات أخرى ضمن معادن مختلفة، وذلك مع الحديد مثلاً ضمن الليمونيت [ملاحظة 26]. كما يوجد النيكل في خام الغارنيريت [ملاحظة 27] النادر والمتوضّع في الصخور فوق المافية [ملاحظة 28] والحاوي على النيكل على هيئة سيليكات؛ والمؤلّف من معدن النبويت [ملاحظة 29] ومن معدن الوليمزيت [ملاحظة 30]؛ وكذلك في التوضّعات الكبريتيدية الصُهَاريّة [ملاحظة 31].[20] من معادن النيكل الأخرى كلّ من البنزنيت [ملاحظة 32] والأوارويت [ملاحظة 33]، وتلك أمثلةٌ على معادن نادرة، ولكنّها حاوية على النيكل بنسبة مرتفعة.[21]
في الغلاف المائي
عُثِرَ على كمّيّات كبيرة نسبياً من النيكل في أعماق المحيطات، وخاصّةً في منطقة تصدّع كليبرتون [ملاحظة 34] في المحيط الهادي، وذلك على هيئة عُقَيدَات متعدّدة الفلزّات [ملاحظة 35] المتوضّعة على أعماق تصل بين 3.5 إلى 6 كيلومتر في القاع.[22][23] تتألّف هذه العُقَيدات من عدّة عناصر أرضية نادرة [ملاحظة 36]، ويُقدّر أن يصل محتوى النيكل فيها إلى حوالي 1.7%.[24] مع تطوّر الأساليب والتقنيات العلمية والهندسية تقوم السلطة الدولية لقاع البحار [ملاحظة 37] بسنّ قوانين لوضع شروط ناظمة من أجل استخراج وجمع تلك العُقَيدات بشكلٍ يراعي الضوابط البيئية، وبشكلٍ متوافقٍ مع أهداف التنمية المستدامة [ملاحظة 38] للأمم المتّحدة.[25]
الاستخراج
| المرتبة | البلد | الإنتاج (مقدراً بالأطنان) |
|---|---|---|
| 1. | إندونيسيا | 606.000 |
| 2. | الفلبين | 345.000 |
| 3. | روسيا | 272.000 |
| 4. | كاليدونيا الجديدة (فرنسا) | 216.000 |
| 5. | كندا | 176.000 |
| 6. | أستراليا | 170.000 |
| 7. | الصين | 110.000 |
| 8. | البرازيل | 74.400 |
| 9. | كوبا | 51.000 |

تشير بعض التقديرات إلى أنّ النيكل يُعَدّن عالمياً بأكثر من حوالي 2.5 مليون طن سنوياً؛ ووفقاً لبيانات سنة 2020 تتصدّر إندونيسيا تلك الدول بإنتاج عالمي سنوي مقداره 760 ألف طن، ثمّ الفلبين بمقدار 320 ألف طن، ثمّ روسيا بمقدار 280 ألف طن، ثمّ كاليدونيا الجديدة بمقدار 200 ألف طن، ثمّ أستراليا بمقدار 170 ألف طن، ثمّ كندا بمقدار 150 ألف طن.[28] توجد توضّعات مهمّة لخامات النيكل في حوض سدبري [ملاحظة 39] في كندا، وفي مدينة نوريلسك [ملاحظة 40] وشبه جزيرة كولا [ملاحظة 41] في روسيا، وفي ولاية كوينزلاند [ملاحظة 42] في أستراليا، وفي مدينة موا في كوبا. إجمالاً تمتلك دولتا أستراليا وإندونيسيا أكبر احتياطيٍّ عالميٍّ من النيكل، وذلك بنسبةٍ تبلغ 43.6% من الاحتياطيّ العالميّ.[29]
حتّى يكون استخراج النيكل مجدٍ اقتصادياً ينبغي أن يقع محتوى النيكل في الخامة بين 0.5-1%. تُستخرَج خامات النيكل عادةً إمّا من التوضّعات الكبريتيدية التقليدية، أو من تلك الموجودة في الطبقات اللاتيريتية؛ وهناك نزعة إلى استخراج خامات النيكل من الأخيرة على حساب الأولى؛[30] رغم ما يرافق ذلك من صعوبات تقنية، إذ يتطلب الاستخراج من الطبقات اللاتيريتية إجراء عملية تصويل حمضي مرتفع الضغط [ملاحظة 43].[31]
الإنتاج
يُستَخلص فلزّ النيكل من خاماته تقليدياً وفق عمليات تتضمّن تحميص الخامة [ملاحظة 44] ثمّ الاختزال [ملاحظة 45]، ممّا يمكّن من الحصول على فلزٍّ بنقاوة أكبر من 75%. في تلك العمليّات الحرارية [ملاحظة 46] التقليدية تتعرّض خامات النيكل الكبريتيدية لدرجات حرارة مرتفعة، ممّا يؤدّي إلى الحصول على خليط كبريتيدي مصهور [ملاحظة 47]، والذي يخضع إلى عمليات تنقية [ملاحظة 48] لاحقة. أدّى التطوّر في عمليّات المعالجة المائية [ملاحظة 49] إلى الحصول على ناتج من النيكل ذي نقاوة مرتفعة نسبياً، وذلك عبر تركيز الخامات الكبريتيدية بعملية تعويم زَبَديّ [ملاحظة 50]، ثمّ تخضع لاحقاً إلى عمليّات صَهْرٍ حرارية.[32]
ُُتُجرَى عمليّات الصَهْر وفق مراحل تدريجية من أجل فصل الفلزّات المرافقة، إذ للتخلّص من الحديد يُسخّن الخليط الكبريتيدي المصهور أوّلاً من أجل تحويل كبريتيد الحديد إلى أكسيد الحديد؛ ثمّ تضاف السيليكات وفحم الكوك لاحقاً من أجل الحصول على خَبَثٍ [ملاحظة 51] من سيليكات الحديد. أمّا النحاس فيُفصَل وفق عملية عملية شيريت غوردون [ملاحظة 52] بإضافة كبريتيد الهيدروجين وكبريتيد الصوديوم، ممّا يؤدّي إلى تشكيل كبريتيدات مضاعفة من النحاس والصوديوم سهلة الانصهار والفصل. بعد ذلك يُعرّض كبريتيد النيكل إلى الحرارة ويُحوّل إلى الأكسيد، والذي يُختَزل لاحقاً باستخدام فحم الكوك إلى فلز النيكل. يُنقّى فلزّ النيكل الناتج بعمليّات استخلاص كهربائي [ملاحظة 53] لاحقة.[33]
التنقية

- التحليل الكهربائي
لإجراء عمليّة التنقية يُوضَع النيكل الخام في خليّة تحليل كهربائي على المصعَد [ملاحظة 54]، أمّا على المهبط [ملاحظة 55] فتوضع صفيحةٌ من النيكل مرتفع النقاوة، في حين يُستخدَم كهرلٌ [ملاحظة 56] من أملاح النيكل.[33]
- عملبة موند

يُستَحصل على النيكل مرتفع النقاوة وفق عملية موند [ملاحظة 57]، وذلك بدرجة نقاوة تصل إلى 99.99%.[34] تُنسَب العملية إلى لودفيغ موند [ملاحظة 58]، والذي طوّرها أواخر القرن التاسع عشر. في هذه العملية يتفاعل النيكل مع أحادي أكسيد الكربون بوجود حفّاز من الكبريت عند درجة حرارة بين 40–80 °س، ليتشكّل مركّب كيميائي من رباعي كربونيل النيكل [ملاحظة 59]:
قد تتشكّل نواتج ثانوية من خماسي كربونيل الحديد [ملاحظة 60] أو من ثماني كربونيل ثنائي الكوبالت [ملاحظة 61]، ولكن يسهل فصلها عن الناتج الرئيسي.[35] يُمرّر رباعي كربونيل النيكل الناتج ضمن حجرة كبيرة عند درجات حرارة مرتفعة، الأمر الذي يؤدّي إلى تفكّكه وانطلاق غاز أحادي أكسيد الكربون والحصول على كُرَيّات [ملاحظة 62] من النيكل مرتفع النقاوة؛ أو يمكن بشكلٍ آخر أن تجرى عمليّة تفكك رباعي كربونيل النيكل في حجرة أصغر عند درجات حرارة تصل إلى 230 °س، ممّا يؤدّي إلى الحصول على مسحوق ناعم دقيق من النيكل مرتفع النقاوة.[36]
التحضير المخبري
يمكن الحصول مخبرياً على كمّيّات صغيرة من النيكل بعدّة طرائق؛[37] منها:
- اختزال الأكسيد باستخدام الهيدروجين عند درجات حرارة تقع بين 150 °س إلى 250 °س:
- اختزال كلوريد النيكل الثنائي ضمن مستعلق في ثنائي إيثيل الإيثر باستخدام كاشف غرينيار [ملاحظة 63]؛ أو باستخدام الصوديوم:
- التفكّك الحراري لمركّب أكسالات النيكل [ملاحظة 64] بوجود الأكسجين:
النظائر
يوجد إحدى وثلاثون نظيراً معروفاً للنيكل، والتي تتراوح أعدادها الكتلية بين 48 و78، منها خمسة نظائر مستقرّة وهي: نيكل-58 58Ni ونيكل-60 60Ni ونيكل-61 61Ni ونيكل-62 62Ni ونيكل-64 64Ni. أكثر هذه النظائر المستقرّة وفرةً طبيعيةً هو النظير نيكل-58، والذي يشكّل 68.077% من النيكل في الطبيعة، يليه النظير نيكل-60 بوفرة طبيعية مقدارها 26.22%.[38] هنالك ستّة وعشرون نظيراً مشعّاً للنيكل، أطولها عمراً هو نيكل-59 59Ni والذي له عمر نصف 76,000 سنة، يليه النظير نيكل-63 63Ni بعمر نصف 100.1 سنة، والنظير نيكل-56 56Ni بعمر نصف 6.077 يوم؛ ولباقي نظائر النيكل المشعّة أعمار نصف أقلّ من 60 ساعة، ومعظمها دون 30 ثانية؛ مع العلم أنّه لا يوجد مصاوغ نووي [ملاحظة 65] لهذا العنصر.[39]
للنظير نيكل-62 62Ni أعلى قيمة وسطية لطاقة الترابط النووي [ملاحظة 66] لكلّ نُوَيّة [ملاحظة 67] من جميع نُوَيْدات [ملاحظة 68] العناصر الكيميائية المعروفة، وذلك بمقدار 8.7946 ميغاإلكترون-فولت/نُوَيّة [ملاحظة 69]؛[40][41] وتلك قيمة أعلى من تلك التي لِنَظيرَي الحديد: حديد-56 56Fe وحديد-58 58Fe.[42] بالرغم من ذلك، فإنّ النيكل لا يعدّ أكثر عنصرٍ كيميائيٍّ ثقيلٍ وفرةً في الكون، وذلك يعود بسبب الانحلال الضوئي [ملاحظة 70] للنيكل داخل لبّ النجوم، وذلك يجعل الحديدَ أكثرَ وفرةً من النيكل بشكلٍ كبيرٍ.[42] يعدّ النظير نيكل-60 60Ni المستقرّ ناتجَ اضمحلالٍ للنُوَيدة المشعّة المنقرضة [ملاحظة 71] حديد-60 60Fe، والتي تضمحلّ بعمر نصف مقداره 2.6 مليون سنة. يَنتُج النظير المشعّ نيكل-56 56Ni في الكون من عملية احتراق السيليكون [ملاحظة 72] ويُطرَح بكمّيّات كبيرة من المستعرات العظمى من النوع Ia [ملاحظة 73]، ويشير شكل المنحنى الضوئي [ملاحظة 74] لتلك المستعرات العظمى في أعمار متوسطة إلى متأخرة إلى حدوث اضمحلال عن طريق التقاط إلكترون من النظير نيكل-56 متحوّلاً إلى كوبالت-56، والذي يضمحلّ بدوره إلى النظير حديد-56.[43] أمّا النظير نيكل-59 59Ni فهو نُوَيدة كونيّة [ملاحظة 75] مشعّة بعمر نصف مقداره 76 ألف سنة. يُستخدَم النظير نيكل-59 في جيوكيمياء النظائر، وذلك في التأريخ الإشعاعي من أجل تقدير عمر الأحجار النيزكية، ومن أجل معرفة الأصل الكوني للغبار في الجليد وفي الرواسب. من جهةٍ أخرى، وُجِدَ أيضاً أنّ للنظير المشعّ نيكل-78 عمر نصف مقداره 110 ميلي ثانية، ويُظَنّ أنّ له دوراً مهمّاً في التخليق النووي في المستعرات العظمى [ملاحظة 76] للعناصر الكيميائية الأثقل من الحديد.[44] اكتُشِفَ النظير نيكل-48 48Ni سنة 1999، وهو أكثر نظيرِ لعنصرِ ثقيلِ غنىً بالبروتونات، فهو يمتلك 28 بروتوناً و20 نيوتروناً؛ وهو يمتلك عدداً سحريّاً مضاعفاً [ملاحظة 77] مثلما هو الحال في النظير نيكل-78 (28 بروتون و50 نيوترون).[39][45] يوجد النظير نيكل-63 على هيئة شائبة في البُنَى الداعمة للمفاعلات النووية؛ وينتج من التقاط نيوترون [ملاحظة 78] من نيكل-62، ويُستخدَم من أجل الاستدلال والكشف عن اختبارات الأسلحة النووية.[46]
الخواص الفيزيائية

البنية الذرية
هناك نمطان للتوزيع الإلكتروني داخل ذرّة النيكل، واللذان يَصِفَان ترتيب الإلكترونات داخل المدارات الذرّية؛ الأوّل: Ar]; 3d8 4s2] والثاني: Ar]; 3d9 4s1] (يشير [Ar] إلى التوزيع الإلكتروني في ذرّة الآرغون). هناك تقاربٌ كبيرٌ في حسابات السويّة الطاقية بين هَذَين التوزيعَين، إلّا أنّ هناك خلافٌ في تحديد أيّهما الأقلّ طاقياً.[48] تُدرِجُ المراجع الكيميائية التوزيعَ الإلكتروني الأوّل للنيكل على الشاكلة Ar]; 3d8 4s2]؛[49] والذي يُكتَب أيضاً بشكلٍ شائعٍ على الشكل Ar]; 4s2 3d8].[50] يتّفق هذا التوزيع مع قاعدة ماديلونغ [ملاحظة 82] في مبدأ أوفباو [ملاحظة 83] لترتيب المدارات الذرّية طاقياً، والذي يتنبّأ أنّ المدار 4s يُملَأ أوّلاً قبل المدار 3d؛ وذلك مثبتٌ عليه تجريبيّاً.[51]
من جهةٍ أخرى، ونظراً للبنية الدقيقة [ملاحظة 84] السائدة في تركيب الذرّات، فإنّ التوزيع الإلكتروني للمدارَين 3d و 4s ينقسم بدوره إلى عدّة مستويات طاقيّة متعدّدة؛[51] ممّا يؤدّي إلى حدوث تداخل بينها نظراً للتقارب بين المستويات الطاقية لذانك المدارَين؛ بالتالي فإنّه وفق حسابات الكيمياء النظرية يكون التوزيع الإلكتروني على الشكل الثاني Ar]; 3d9 4s1] أخفض طاقياً من الأوّل، لذلك يُدرَج هذا التوزيع الإلكتروني للنيكل أيضاً في مراجع الأبحاث الكيميائية.[48]
الخواص الفلزية
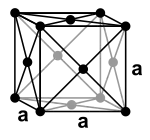
يوجد النيكل في الظروف القياسية من الضغط ودرجة الحرارة على هيئة فلزٍ ذي لون أبيض فضّي، مع وجود مًسْحَةٍ ذهبيّةٍ طفيفةٍ في حال الصقْل؛ وهو يُصنّف ضمن الفلزّات الثقيلة، إذ تبلغ كثافته مقدار 8.91 غ/سم3. يعدّ النيكل واحداً من أربعة عناصر، إلى جانب الحديد والكوبالت والغادولينيوم، تمتلك خواصاً مغناطيسية حديدية [ملاحظة 85] عند أو بالقرب من درجة حرارة الغرفة. تبلغ قيمة درجة حرارة كوري [ملاحظة 86] مقدار 354 °س،[52] أي أنّ النيكل يصبح لا مغناطيسياً فوق تلك الدرجة.[53] تترتّب البنية الذرّية للنيكل وفق نظامٍ بلّوريٍّ مكعّبٍ مركزيّ الوجه [ملاحظة 87]، وتبلغ فيه قيمة ثابت الشبكة البلّورية [ملاحظة 88] a مقدار 352.4 بيكومتر؛ مع وجود أربع وحدات صيغة [ملاحظة 89] في وحدة الخليّة [ملاحظة 90].[54]
النيكل فلزٌّ متوسّط الصلادة (تبلغ قيمة الصلادة وفق مقياس موس مقدار 3.8)، ولكنّه مطواع وقابل للسحب والطرق [ملاحظة 91]، كما أنّه قابل للصهر وللصقل؛ ويتميّز بأنّه موصلٌ جيّدٌ للكهرباء وناقلٌ جيّدٌ الحرارة.[10] تبلغ قيمة مقاومة الشدّ [ملاحظة 92] للنيكل المتوهّج بين 400–450 ميغاباسكال. إنّ قيمة مقاومة الانضغاط [ملاحظة 93] المرتفعة بمقدار 34 غيغاباسكال لا يمكن الوصول إليها في الظروف التجريبية للفلزات نظراً لتشكّل وحركة الانحرافات في البنية البلّورية؛ إلّا أنّها محقّقة في الجسيمات النانوية [ملاحظة 94] للنيكل.[55]
الخواص الكيميائية
النيكل مستقرٌّ كيميائيّاً عند درجة حرارة الغرفة تجاه الرطوبة والماء والمحاليل القلويّة؛ أمّا الأحماض الممدّدة، مثل حمض الكبريتيك الممدّد، فتتفاعل مع النيكل ببطء، في حين تستطيع الأحماض المركّزة المؤكسدة، مثل حمض النتريك المركّز، أن تتفاعل مع سطح النيكل في البداية إلى أن تتشكّل طبقةٌ مُخَمّلةٌ من الأكسيد على السطح، والتي تقي باقي كتلة الفلزّ من التفاعل اللاحق.
يشكّل النيكل عدداً من المعقّدات التناسقية الملوّنة، ويكون العدد التناسقي فيها غالباً 4 أو 6؛ وتوجد تلك المعقّدات في ترتيبٍ هندسيٍّ جزيئيٍّ على نمط بنية جزيئية رباعية السطوح [ملاحظة 95] أو على نمط بنية جزيئية مستوية مربّعة [ملاحظة 96]؛ وتكون المعقّدات على النمط الأول رباعي السطوح ذات مغناطيسية مسايرة [ملاحظة 97]، أمّا النمط الثاني المستوي المربع فتكون فيه المعقّدات ذات مغناطيسية معاكسة [ملاحظة 98]؛ وفي عناصر المجموعة العاشرة لا تلاحظ هذه الظاهرة سوى عند النيكل، إذ أنّ البالاديوم الثنائي والبلاتين الثنائي يشكّلان معقداتٍ ذات بنية مستوية مربعة فقط.
المركبات الكيميائية بحالات الأكسدة المختلفة
يمكن أن يوجد النيكل بعدّة حالات أكسدة، مثله مثل باقي الفلزّات الانتقالية، وهي تتراوح من -1 إلى +4، إذ يوجد النيكل في حالة الأكسدة 0 مثلاً في معقّداته التناسقية، مثلما هو الحال في مركّب رباعي كربونيل النيكل. وتعدّ حالة الأكسدة +2 الأكثر شيوعاً بين حالات الأكسدة المذكورة في كيمياء النيكل.[32]
النيكل الثنائي
_complexes_in_aqueous_solution.jpg.webp)
يشكّل النيكل الثنائي مع مختلف الأنيونات الشائعة عدداً معتبراً من المركّبات الكيميائية اللاعضوية، التي تتضمّن الكبريتيد NiS، والكبريتات NiSO4، النترات Ni(NO3)2 والكربونات NiCO3، والهيدروكسيد Ni(OH)2، بالإضافة إلى الهاليدات المعروفة من الفلوريد NiF2 والكلوريد NiCl2 والبروميد NiBr2 واليوديد NiI2. يعدّ كلوريد النيكل الثنائي مثالاً نمطياً على هاليدات النيكل الثنائي، وهو صلب أصفر اللون في شكله اللامائي، لكنّه يوجد غالباً في شكله المائي على هيئة سداسي هيدرات أخضر اللون، والذي يُستحصَل عند إذابة النيكل أو أكسيده في حمض الهيدروكلوريك. لكلوريد النيكل الثنائي اللامائي بنية بلّورية تتبع النظام البلّوري الثلاثي متساوي الأحرف [ملاحظة 99] وفق نمط يشبه تبلور كلوريد الكادميوم؛[56] في حين أنّ الشكل المائي سداسي الهيدرات يتبلور وفق نظامٍ بلّوري أحاديّ الميل [ملاحظة 100].[57]
-sulfate-hexahydrate-sample.jpg.webp)
يوجد أكسيد النيكل الثنائي NiO على هيئة مسحوق بلّوري أخضر اللون، ويُستخدَم في مجال صناعة الزجاج وتلوين السيراميك وصناعة الأقطاب الكهربائية، بالإضافة إلى استخدامه في مجال التحفيز الكيميائي في تفاعلات هدرجة المركّبات العضوية. من جهةٍ أخرى، يُستحصَل عادةً على كبريتات النيكل الثنائي بكمّيّات كبيرةٍ من حلّ وإذابة فلزّ النيكل في حمض الكبريتيك، ممّا يؤدّي إلى الحصول على بلّورات مُمَيّهة [ملاحظة 101] سداسية وسباعية الهيدرات؛ وعادةً ما يُستخدَم من أجل عمليّات الطلي الكهربائي بالنيكل [ملاحظة 102].[58] على العموم تميل أملاح النيكل الثنائي عند انحلالها في الماء إلى تشكيل معقّدات مائية 2+ [Ni(H2O)6] ذات لون أخضر.[59]
يشكّل النيكل الثنائي بعضاً من المعقّدات التناسقية وذلك مع رُبَيطاتٍ ضخمةٍ مثل ثنائي كلورو مضاعف (ثلاثي فينيل فوسفين) النيكل الثنائي [ملاحظة 103]؛ وكذلك الأمر مع رُبَيطات بسيطةٍ مثل الكلوريد في معقّد أنيون رباعي كلوريد النيكل الثنائي 2− [NiCl4] الأصفر؛ وكذلك مع ثنائي أمين الإيثيلين [ملاحظة 104] في معقّد 2+ [Ni(C2H4(NH2)2)] البنفسجي. يشكّل النيكل الثنائي أيضاً معقّداً تناسقياً مع رُبَيطة ثنائي ميثيل غليوكسيم [ملاحظة 105] ثنائيّة السنّ [ملاحظة 106]، وذلك في معقّد مضاعف (ثنائي ميثيل غليوكسيماتو) النيكل الثنائي [ملاحظة 107]، وهو معقّدٌ مستقرٌّ بسبب تشكّل روابط هيدروجينية تعمل على تثبيته؛ وله تطبيقات في الكشف التقليدي عن النيكل في الكيمياء التحليلية.[60]

تعدّ المعقّدات الأمينية مع رُبَيطات من الأمونيا من المعقّدات التناسقية المعروفة للنيكل الثنائي، وهي توجد إمّا على هيئة معقّد رباعي أمين النيكل الثنائي 2+ [Ni(NH3)4] الأزرق الفاتح؛ أو على هيئة معقّد سداسي أمين النيكل الثنائي 2+ [Ni(NH3)6] الأزرق الداكن إلى البنفسجي. تُستحصَل هذه المعقّدات من إضافة كمّيّات فائضةٍ من الأمونيا إلى ملح للنيكل الثنائي:[60]
أمّا المعقّدات السيانيدية فتُستحصَل عند إضافة سيانيد البوتاسيوم إلى محلولٍ ملحيٍّ للنيكل الثنائي، حيث يَنتجُ أوّلاً مركّب سيانيد النيكل الثنائي Ni(CN)2، والذي ينحلّ عند إضافة كمّيّاتٍ فائضةٍ من سيانيد البوتاسيوم بسبب تشكّل معقّد رباعي سيانو نيكلات البوتاسيوم [ملاحظة 108] الأصفر:[60]
من معقّدات النيكل الثنائي المعروفة أيضاً معقّد نيكلوسين [ملاحظة 109]، وهو مركّب نيكل عضوي ينتمي إلى مجموعة الميتالوسينات [ملاحظة 110] الشطيرية [ملاحظة 111]؛ إذ يتألّف النيكلوسين من مركز من أيون النيكل الثنائي المحصور بين وحدتين من أنيون حلقي البنتاديينيل [ملاحظة 112]، وهو يحوي على عشرين إلكتروناً في بنيته، والتي تأخذ فيها الحلقتان تصاوُغاً هندسياً مقارباً [ملاحظة 113].[61]
النيكل الثلاثي
أشهر مركّبان للنيكل الثلاثي هما الأكسيد Ni2O3 وأكسيد الهيدروكسيد NiO(OH)، واللذان يجدان لهما تطبيقات في بطّاريات النيكل المختلفة. يُعثَر أيضاً على النيكل في حالة الأكسدة الثلاثية في بعض من المركّبات الكيميائية، منها مركّبات ثلاثي هالو فوسفينات النيكل الثلاثي [ملاحظة 114] Ni(PPh3)X3.[62] إلّا أنّ مركّبات النيكل الثلاثي غير مستقرّة على العموم، وتحتاج إلى تثبيت عبر الارتباط مع رُبَيطات مانحة للرابطة سيغما [ملاحظة 115] مثل الثيولات أو الفوسفينات العضوية [ملاحظة 116].[63]
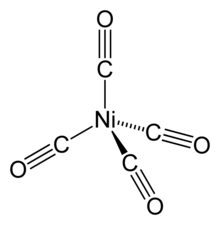
حالات أكسدة أخرى
تعدّ حالات الأكسدة الأخرى المتبقيّة للنيكل نادرةً وغير شائعة، وتوجد في أشكال معيّنة محدّدة، فالنيكل في حالة الأكسدة 0 (الصفري) يلاحظ في المعقّد رباعي كربونيل النيكل Ni(CO)4، وهو مركّب نيكل عضوي يوجد على هيئة سائل متطاير، والذي يتفكّك إلى النيكل عند تسخينه؛ وتُستغَلّ هذه الخاصّية في الحصول على شكل نقيٍّ من النيكل في عملية موند.[64] من المعقّدات الأخرى للنيكل في حالة الأكسدة الصفرية معقّد مضاعف (حلقي أوكتاديين) النيكل الصفري [ملاحظة 117] والمستخدم في مجال الاصطناع العضوي وكيمياء النيكل العضوية.[65] أمّا النيكل الأحادي فهو أيضاً غير شائع، وتوجد حالة الأكسدة هذه غالباً في المعقّدات التناسقية الحاوية على رابطة Ni-Ni، مثل معقّد K4[Ni2(CN)6] المُستحصَل من اختزال معقّد K2[Ni2(CN)6] باستخدام ملغمة صوديوم.[63] لا يعرف للنيكل الرباعي أيضاً إلّا عددٌ قليلٌ من المركّبات الكيميائية،[66][67] منها معقّدات تناسقية مع ربيطة الديكربوليد [ملاحظة 118] الضخمة (2-[C2B9H11]).[68][69]
التحليل الكيميائي


يمكن الكشف عن النيكل نوعياً وفق الوسائل التقليدية للكيمياء التحليلية عن طريق إجراء تفاعل تشكّل معقّد للنيكل الثنائي مع مركّب ثنائي ميثيل غليوكسيم. قبل إجراء تفاعل الكشف فإنّه عادةً ما تُرَسّب أملاح النيكل الثنائي من الوسط المائي عبر إضافة كبريتيد الأمونيوم، الأمر الذي يؤدّي إلى الحصول على راسبٍ أسودٍ من كبريتيد النيكل الثنائي، والذي يُرشَح ويُفصَل ثمّ يذاب في حمض النتريك للحصول على أيونات النيكل الثنائي المائية خضراء اللون. يجرى تفاعل الكشف النوعي مع ثنائي ميثيل غليوكسيم في وسطٍ قلويٍّ بإضافة هيدروكسيد الأمونيوم، ممّا يؤدّي إلى الحصول على راسب أحمر توتي من معقّد مضاعف (ثنائي ميثيل غليوكسيماتو) النيكل الثنائي.[70]
اعتماداً على تفاعل تشكّل هذا المعقّد فإنّه من الممكن وفق الوسائل التقليدية إجراء تحليل كمّي للنيكل الثنائي، وذلك مثلاً وفق أسلوب التحليل الوزني الكهربائي [ملاحظة 119] باستخدام أقطاب كهربائية من لبلاتين؛ أو باستخدام أسلوب القياس الفولتي باستخدام قطب الزئبق المتقاطر [ملاحظة 120]. تُستخدَم حالياً وسائل التحليل الآلي الحديثة للكشف الكمّي عن النيكل، وذلك وفق تقنيات المطيافية الذرّية [ملاحظة 121] المختلفة، أو باستخدام تقنية مطيافية الكتلة المزوّدة ببلازما مقترنة بالحثّ [ملاحظة 122] على سبيل المثال؛ إذ تُمكّن هذه التقنيّات الحديثة من الحصول على نتائج للتحاليل حتى بكميّات نزرة. [71]
الدور الحيوي
يصنّف النيكل ضمن المغذّيات الأساسية لبعض الكائنات الحيّة المجهرية والنباتات التي تحتاج إلى إنزيمات يوجد فيها هذا الفلز ضمن الموقع النشط الفعّال فيها؛[72][73] لذلك يقوم النيكل بدورٍ حيويٍّ مهمٍّ في البكتيريا والعتائق وكذلك الفطور.[74][75] يوجد عددٌ معتبرٌ من الأمثلة على الإنزيمات الحاوية على النيكل؛ منها إنزيم اليورياز [ملاحظة 123]، والذي يحفّز تفاعل حلمهة [ملاحظة 124] اليوريا ليشكّل الأمونيا والكربامات،[74][73] وهو بالتالي ذو دورٍ حيويٍّ مهمٍّ؛[76][77] يوجد أيضاً نوعٌ من أنواع إنزيمات الهيدروجيناز [ملاحظة 125] المعتمدة على وجود النيكل والحديد في تركيبها، والمسؤولة عن تحفيز تفاعل أكسدة واختزال الهيدروجين الجزيئي إلى بروتونات وإلكترونات وبالعكس.[74][73] يُذكَر أيضاً العامل المرافق F430 [ملاحظة 126]، والحاوي على النيكل ضمن رباعي بيرول [ملاحظة 127]، والموجود ضمن إنزيم ميثيل-مرافق الإنزيم M ريدوكتاز [ملاحظة 128] والذي يحفّز التشكل الحيوي للميثان.[78] هناك أيضاً صنفٌ من إنزيمات نازعة هيدروجين أحادي أكسيد الكربون [ملاحظة 129] الحاوي على عناقيد تجميعيّة من ذرّات Fe-Ni-S في بنيته.[79] من إنزيمات النيكل أيضاً كلٌ من سوبر أكسيد ديسميوتاز [ملاحظة 130]؛[80] وغلايوكسيلاز [ملاحظة 131].[81]
لا يوجد دليلٌ قاطعٌ على أنّ النيكل من العناصر المغذّية الأساسية بالنسبة للإنسان، ولكن قد يكون النيكل ضرورياً بالنسبة للبكتريا الموجودة في الأمعاء الغليظة، وذلك بقيامه بدور مغذٍّ للمُعينَات الحيوية [ملاحظة 132].[82] لم تؤكّد الأكاديمية الوطنية للطبّ [ملاحظة 133] في الولايات المتّحدة الأمريكية أنّ النيكل من العناصر المغذّية الأساسية بالنسبة للإنسان، لذلك لم تضع لهذا العنصر قِيَماً للمدخول الكافي [ملاحظة 134] أو الكمّيّة المُوصى بتناولها [ملاحظة 135]؛ في حين أنّها وضعت الحدّ الأقصى للمدخول المقبول [ملاحظة 136] بمقدار 1000 ميكروغرام/اليوم على هيئة أملاح نيكل منحلّة؛ إذ أنّ ما يُمتصّ من النيكل يُطرَح في البول.[83] تعدّ أواني الطهو من المصادر التي قد يدخل فيها النيكل إلى الغذاء، وذلك من خلال عملية الرشح أثناء الطهو؛ فقد وُجِدَ مثلاً أنّه بعد 10 عمليات طهو لصلصة الطماطم بذات الآنية المصنوعة من الفولاذ المقاوم للصدأ الحاوي على النيكل فقد رَشَحَ إليها مقدار 88 ميكروغرام من النيكل.[84][85]
الأثر البيئي
يوجد النيكل عادةً بتراكيز منخفضة في الطبيعة؛ وهي لا تتجاوز 20 نانوغرام/م3 في الغلاف الجوّي؛ و100 مغ/كغ في التربة؛ و10 مغ/كغ في الغطاء النباتي؛ و10 ميكروغرام/ليتر في الماء العذب؛ و1 ميكروغرام/ليتر في ماء البحر.[86] يساهم النشاط البشري في رفع مستويات النيكل في الطبيعة؛ وذلك يتمثّل في عدّة أشكال، مثل رشوح النيكل من صنابير المياه المطليّة بالنيكل ممّا يؤدّي إلى تلوّث المياه والتربة؛ وكذلك طرح مخلّفات تعدين النيكل الصلبة من غير معالجة إلى الوسط البيئي، أو طرح أملاحه في مياه الصرف. من مصادر التعرّض الأخرى كلّ من حرق الوقود الأحفوري ودخان التبغ.[87]
الدور الاقتصادي
سك النقود

شاع استخدام النيكل في سكّ النقود المعدنية منذ أواخر القرن الثامن عشر وأوائل القرن التاسع عشر؛ فعلى سبيل المثال سَكّتِ الإمبراطورية البريطانية سنة 1786 في مدينة برمنغهام نقوداً معدنيّة من النيكل من أجل إدارة التعاملات المالية في ماليزيا.[88] أمّا في الولايات المتّحدة فتُستخدَم تسمية « نيكل » [ملاحظة 137] عبر تاريخها للإشارة إلى عددٍ من فئاتِ النقود المعدنية الحاوية على النيكل في تركيبها، مثل « سنت العقاب الطائر » [ملاحظة 138] المتدوال بين سنتي 1857–1858، و« سنت الرأس الهندي » [ملاحظة 139] المتداول بين سنتي 1859–1909، بالإضافة إلى « نيكل ثلاثة سنتات » [ملاحظة 140] المتداول بين سنتي 1865–1889. أمّا حالياً فتُستخدَم التسمية للإشارة إلى فئة خمسة سنتات التي لا تزال متداولةً حالياً، وهي تحوي على 25% من تركيبها من فلز النيكل و75% المتبقيّة من النحاس، وذلك يعادل وزناً مقدار 1.1 غرام بالنسبة للنيكل، ومقدار 3.75 غرام من النحاس. مع ارتفاع أسعار الفلزّات عالمياً منذ بداية القرن الحادي والعشرين فقد فاق الثمن الحقيقي لهذه القطعة النقدية مقدار قيمتها النقدية؛ ممّا جعلها هدفاً مغرياً للبعض، الذين بدأوا بصهرها والاتّجار بفلزَّي النيكل والنحاس لكسب مرابح مالية؛ الأمر الذي دفع دار السكّ الأمريكية [ملاحظة 141] إلى تجريم صهر وتصدير فئات النقود الأمريكية؛[89] وفرضت غراماتٍ مالية قد تصل إلى 10 آلاف دولار أمريكي، وبالسجن لمدّة قد تصل إلى خمس سنوات.[90] تجدر الإشارة إلى أنه أثناء الحرب العالمية الثانية جرى سكّ هذه الفئة النقدية من غير إدخال النيكل في تركيبها، من أجل استخدام هذا الفلزّ في تطبيقات عسكرية.[7][91]
أدّى ارتفاع سعر النيكل عالمياً إلى التفكير بتأمين بديلٍ عن هذا الفلز في سكّ النقود المعدنية في مختلف أرجاء العالم، ولكنه لا يزال داخلاً مثلاً في تركيب نقود اليورو المعدنية من فئة 1 و2 يورو؛ وفي نقود الجنيه الإسترليني المعدنية من فئة 20 و50 بنس وكذلك 1 و2 جنيه إسترليني؛ وفي نقود الدولار الأمريكي المعدنية من فئة 5 و10 و25 و50 سنت وكذلك 1 دولار أمريكي.[92] قامت المملكة المتحدة تدريجياً منذ سنة 2012 بطرح نقود معدنية مصنوعة من الفولاذ المطلي بالنيكل لفئتي 5 و10 بنس، وهو ما حدا بالبعض إلى الاعتراض بسبب حساسيتهم تجاه النيكل.[93]
القيمة السوقية
ازداد سعر النيكل في السوق العالمية بكل مطّردٍ منذ بدايات القرن الحادي والعشرين، ففي شهر أبريل من سنة 2007 كان سعر هذا الفلز 52,300 دولار أمريكي/الطن.[94] انخفض سعر الطن بعد ذلك بشكلٍ كبير، ووصل في سنة 2017 إلى سعر 11,000 دولار أمريكي/الطن.[95] أثناء الغزو الروسي لأوكرانيا في سنة 2022 زادت المخاوف بأنّ العقوبات على روسيا قد تؤدّي إلى ارتفاعٍ حادٍّ قصير الأجل [ملاحظة 142] في سعر النيكل في السوق العالمية، ممّا أدّى بالفعل إلى تضاعف سعر النيكل بأربع مرّات في مجرد يومَين، ليصل إلى 100,000 دولار أمريكي/الطن في شهر مارس من سنة 2022.[96][97] وفي تلك الفترة أيضاً ألغت بورصة لندن للمعادن [ملاحظة 143] عقوداً بقيمة 3.9 بليون دولار أمريكي، وعلّقت التداول التجاري بالنيكل لمدّة أكثر من أسبوع.[98]
الاستخدامات
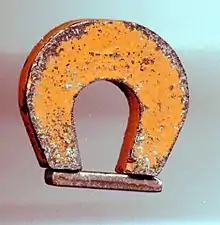
تنقسم تطبيقات النيكل الصناعية على النحو التالي: 68% في صناعة الفولاذ المقاوم للصدأ؛ 10% في صناعة السبائك اللاحديدية [ملاحظة 144]؛ 9% في مجال الطلي الكهربائي [ملاحظة 145]؛ 7% في مجال سبائك الفولاذ المختلفة؛ 3% في ورشات المسابك [ملاحظة 146]؛ و4% في استخدامات أخرى؛.[99] وتلك تتضمّن صناعة البطّاريات بما فيها بطّاريات المَرْكَبات الكهربائية.[100]
صناعة السبائك
يدخل النيكل بشكلٍ واسعٍ وبارزٍ في صناعة عددٍ معتبرٍ من السبائك، إذ يساهم في تعزيز مقاومة الشدّ [ملاحظة 147] والمتانة [ملاحظة 148] وزيادة اللدونة [ملاحظة 149]. من أهمّ الفلزّات التي تُسبَك مع النيكل كلّ من الحديد والكروم والكوبالت والنحاس والألومنيوم، بالإضافة إلى الرصاص والذهب والفضّة. تعدّ سبيكة الفولاذ المقاوم للصدأ [ملاحظة 150] من سبائك النيكل المعروفة، بالإضافة إلى سبائك أخرى تتضمّن: سبيكة ألنيكو (من الألومنيوم والنيكل والكوبالت)؛ وسبيكة برمالوي [ملاحظة 151] (من النيكل والحديد)؛ وسبيكة إيلنفار [ملاحظة 152] (من الحديد والنيكل والكروم)؛ وسبيكة إنفار [ملاحظة 153] (من النيكل والحديد)؛ وكذلك سبيكة إنكونيل [ملاحظة 154] (من النيكل والكروم)؛ وسبيكة إنكولوي [ملاحظة 155] وسبيكة نيمونيك [ملاحظة 156] (وهي علامات تجارية لسبائك فائقة مقاومة للتآكل مؤلّفة من النيكل والكروم)؛ وكذلك سبيكة مونيل [ملاحظة 157] وسبيكة كونستانتان [ملاحظة 158] (من النيكل والنحاس).[33]
لسبائك النيكل تطبيقات مختلفة، فهي على العموم تتميّز بمقاومتها للتآكل والحرارة، لذا تُستخدَم مثلاً في صناعة العنفات الغازية [ملاحظة 159]. من جهةٍ أخرى تتميّز سبيكة كونستانتان بأنّ ذات مقاومة نوعية [ملاحظة 160] ثابتة ضمن مجال واسع من درجات الحرارة، لذا تجد لها استخدامات في صناعة المقاومات الكهربائية. أمّا سبيكة فضّة النيكل [ملاحظة 161] فهي مقاومة للتآكل بشكل كبير، وتُستخدَم في صناعة أدوات تناول الطعام؛ وسبيكة النيكل النحاسي تُستخدَم بشكلٍ كبيرٍ في سكّ النقود المعدنية. في حين تُستخدَم سبيكة نيكل راني [ملاحظة 162]، وهي علامة تجارية لسبيكة دقيقة الحبيبات من النيكل والألومنيوم، في مجال التحفيز الكيميائي وذلك بشكلٍ واسعٍ في تفاعلات الهدرجة [ملاحظة 163].[101]
متفرقات

هناك طيفٌ واسعٌ من التطبيقات المخنلفة التي يدخل فيها النيكل ومركّباته وسبائكه في مجالات الحياة اليومية؛ تتفاوت بين صناعة البطّاريات الكهربائية (مثل بطارية النيكل وهيدريد الفلز وبطارية النيكل والهيدروجين) وبين صناعة الخضب والطلي الكهربائي بالنيكل.[102] إذ تُستخدَم مركّبات النيكل اللاعضوية خضباً لإضافة اللون الأخضر في صناعة الزجاج. أمّا فلزّ النيكل فكان يستخدم سابقاً في صناعة إطارات النظّارات. ونظراً لتمتّع النيكل بمقاومةٍ كيميائية تجاه الأحماض والقلويّات، فإنّه يُستخدَم في صناعة بعض التجهيزات المخبرية مثل البواتق [ملاحظة 165]. يُستخدَم أسلوب الطلي الكهربائي بالنيكل من أجل منع تآكل المشغولات المعدنية.[103][104] في حين تُستخدَم رغوة النيكل [ملاحظة 166] في صناعة أقطاب الانتشار الغازي [ملاحظة 167] في خلايا الوقود القلوية [ملاحظة 168].[105][106]
يُستخدَم النيكل مادّةً رابطةً [ملاحظة 169] في صناعة المنتَجات الصلدة المبنية على كربيد التنغستن، إذ يُضاف بنسبةٍ تتراوح بين 6-12% وزناً؛ ممّا يساهم في إضفاء خواص مغناطيسية على المنتَجات النهائية، بالإضافة إلى خواصَّ مقاومةٍ للتآكل؛ إلّا أن تلك المنتَجات ذات صلادة أقلّ من المنتَجات التي تستخدم الكوبالت مادّةً رابطةً فيها.[107] للنظير نيكل-63 63Ni عمر نصف مقداره 100.1 سنة، وهو يدخل في مجال الصناعات الإلكترونية في تركيب أجهزة كريترون [ملاحظة 170] إذ يعد مصدراً لانبعاث جسيمات بيتّا [ملاحظة 171] مرتفعة السرعة؛[108] ويُستخدَم لذلك في تركيب مكشاف التقاط الإلكترون [ملاحظة 172] في أجهزة مطيافية الاستشراب الغازي [ملاحظة 173]؛ وتجرى دراساتٌ لاستخدامه مصدراً للطاقة في البطّاريات البيتافولتائية.[109][110]
المخاطر
| نيكل | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H317, H351, H372, H402, H412 |
| بيانات وقائية وفق GHS | P201, P202, P260, P264, P270, P272, P273, P280, P302+352, P308+313, P333+313, P363, P405, P501[111] |
| NFPA 704 |
0
2
0
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
هناك عدّة أشكال للتعرّض لعنصر النيكل؛ ونظراً لكون هذا العنصر أساسياً في غذاء النباتات، لذلك يمثّل الاستهلاك الفموي عبر تناول الغذاء مصدر تعرّضٍ طبيعيٍّ أساسيٍّ للنيكل.[112] بالرغم من ذلك، فإنّ النيكل يوجد عادةً بتراكيز منخفضة في الطبيعة؛ وما يتناوله الإنسان فإنّه يطرح يومياً مع البول أو البراز من غير امتصاص.[86] تصنّف مركّبات النيكل ضمن المسرطنات [ملاحظة 174]؛[113][114][115] وخاصّةً عند استنشاق أبخرتها،[116][117] وذلك وفق بيانات لدراسات تقييمية للحالة الصحّية للعمال الذين يتعرّضون لأبخرة مركّبات النيكل أثناء عمليات التعدين؛[118] بالإضافة إلى دراسات داعمة لتجارب أجريت على الجرذان والفئران.[119][120][121] يمثّل مركّب رباعي كربونيل النيكل خاصّةً واحداً من مركّبات النيكل الخطرة، فخطورته تنبع من كونه غازاً سامّاً، وذلك من فلز النيكل بحدّ ذاته، ومن خطر انطلاق غاز أحادي أكسيد الكربون السام.[122][123]
يمثّل النيكل ومركّباته خطراً مهنياً؛[124] وخاصّةً على النسوة العاملات في مجال التعدين.[125][126][127][128] يمكن أن يتعرّض الإنسان إلى النيكل في مكان العمل عبر استنشاق الأبخرة أو الابتلاع أو التماس مع الجلد أو العين. في الولايات المتّحدة الأمريكية حدّدت إدارة السلامة والصحّة المهنية [ملاحظة 175] حدّ التعرّض المسموح [ملاحظة 176] به من النيكل في مكان العمل بمقدار 1 مغ/م3 ليوم عمل من ثمان ساعات؛ أمّا المعهد الوطني للسلامة والصحّة المهنية [ملاحظة 177] فوضع حدّ التعرّض الموصى به [ملاحظة 178] من النيكل بمقدار 0.015 مغ/م3؛ ويمثّل مقدار 10 مغ/م3 الحدّ الذي يسبّب خطورةً فوريةً للحياة أو الصحّة [ملاحظة 179].[129]
قد يؤدّي التماس المباشر للجلد مع فلز النيكل عند البعض إلى حدوث نوعٍ من التهاب الجلد التماسيّ التحسّسيّ [ملاحظة 180]، والذي يُعرَف أيضاً تحت اسم «حساسية النيكل» [ملاحظة 181]؛[130] وهي حالة شائعة الانتشار نسبياً.[131] إذ يكثر دخول النيكل في المجوهرات، وخاصّةً في صياغة الأقراط.[132] كما وجد في سنة 2002 أن نقود اليورو المعدنية من فئة 1 و2 يورو كانت حاويةً على تراكيز مرتفعة نسبياً من النيكل؛[133] ممّا أدّى إلى ظهور حالات من حساسية النيكل لدى البعض.[93]
طالع أيضاً
الهوامش
- baitong
- Cupronickel
- Bactrian kings
- Agathocles of Bactria
- Euthydemus II
- Pantaleon
- Erzgebirge
- Nickel
- nickeline
- niccolite
- Axel Fredrik Cronstedt
- cobalt blue
- pyrrhotite
- Widmanstätten pattern
- inner core
- outer core
- iron meteorites
- Kamacite
- Taenite
- Joseph Louis Proust
- Campo del Cielo
- Pentlandite
- Millerite
- Nickeline
- laterite
- Limonite
- Garnierite
- Ultramafic rock
- Népouite
- Willemseite
- magmatic sulfide deposits
- Bunsenite
- Awaruite
- Clarion Clipperton Zone
- polymetallic nodules
- rare-earth metals
- International Seabed Authority (ISA)
- Sustainable Development Goals
- Sudbury Basin
- Norilsk
- Kola Peninsula
- Queensland
- high pressure acid leaching
- roasting
- reduction
- pyrometallurgical techniques
- Matte
- refining
- hydrometallurgical techniques
- Froth flotation
- Slag
- Sherritt-Gordon process
- Electrorefining
- Anode
- Cathode
- Electrolyte
- Mond process
- Ludwig Mond
- Nickel tetracarbonyl
- Iron pentacarbonyl
- tetracobalt dodecacarbonyl
- pellets
- Grignard reagent
- Nickel oxalate
- Nuclear isomer
- nuclear binding energy
- Nucleon
- Nuclide
- MeV/nucleon
- Photodisintegration
- extinct radionuclide
- silicon burning process
- Type Ia supernova
- light curve
- Cosmogenic nuclide
- supernova nucleosynthesis
- doubly magic
- neutron capture
- Transmission electron microscopy
- nanocrystal
- single wall carbon nanotube
- Madelung rule
- Aufbau principle
- fine structure
- Ferromagnetism
- Curie temperature
- Face-centered cubic crystal system (fcc)
- Lattice constant
- Formula unit
- Unit cell
- malleable and ductile
- Tensile strength
- compressive strength
- nanoparticles
- Tetrahedral molecular geometry
- Square planar molecular geometry
- paramagnetic
- diamagnetic
- trigonal crystal system
- Monoclinic crystal system
- hydrated
- nickel electroplating
- Dichlorobis(triphenylphosphine)nickel(II)
- Ethylenediamine
- Dimethylglyoxime
- bidentate
- Bis(dimethylglyoximato)nickel(II)
- Potassium tetracyanonickelate(II)
- Nickelocene
- metallocenes
- Sandwich compound
- Cyclopentadienyl anion
- Staggered conformation
- Nickel(III) trihalophosphines
- σ-donor ligands
- Organophosphine
- Bis(cyclooctadiene)nickel(0)
- Dicarbollide
- Electrogravimetry
- dropping mercury electrode (DME)
- Atomic spectroscopy
- Inductively coupled plasma mass spectrometry (ICP-MS)
- urease
- hydrolysis
- NiFe hydrogenase
- cofactor F430
- tetrapyrrole
- methyl coenzyme M reductase
- carbon monoxide dehydrogenase
- superoxide dismutase
- glyoxalase I
- prebiotic
- National Academy of Medicine (NAM)
- Adequate Intakes (AIs)
- Recommended Dietary Allowances (RDAs)
- Tolerable Upper Intake Level (UL)
- nickel
- Flying Eagle cent
- Indian Head cent
- Three-cent nickel
- United States Mint
- short squeeze
- London Metal Exchange
- nonferrous alloys
- electroplating
- foundries
- tensile strength
- toughness
- elastic limit
- Stainless steel
- Permalloy
- Elinvar
- Invar
- Inconel
- Incoloy
- Nimonic
- Monel
- Constantan
- Gas turbine
- specific electrical resistance
- Nickel silver
- Raney nicke
- hydrogenation reactions
- Turboprop
- Crucibles
- Nickel foam
- gas diffusion electrode
- Alkaline fuel cell (AFC)
- binder
- krytron
- beta particle emitter
- electron capture detector (ECD)
- Gas chromatography
- carcinogens
- Occupational Safety and Health Administration (OSHA)
- permissible exposure limit (PEL)
- National Institute for Occupational Safety and Health (NIOSH)
- recommended exposure limit (REL)
- IDLH
- Allergic contact dermatitis
- Nickel allergy
المراجع
- M. Carnes (2009)، "A Stable Tetraalkyl Complex of Nickel(IV)"، Angewandte Chemie International Edition، 48: 3384، doi:10.1002/anie.200804435.
- S. Pfirrmann (2009)، "A Dinuclear Nickel(I) Dinitrogen Complex and its Reduction in Single-Electron Steps"، Angewandte Chemie International Edition، 48: 3357، doi:10.1002/anie.200805862.
- Rosenberg, Samuel J. (1968)، Nickel and Its Alloys (PDF)، National Bureau of Standards، مؤرشف من الأصل (PDF) في 8 ديسمبر 2020.
- McNeil, Ian (1990)، "The Emergence of Nickel"، An Encyclopaedia of the History of Technology، Taylor & Francis، ص. 96–100، ISBN 978-0-415-01306-2.
- Needham, Joseph; Wang, Ling; Lu, Gwei-Djen; Tsien, Tsuen-hsuin; Kuhn, Dieter and Golas, Peter J. (1974) Science and civilisation in China نسخة محفوظة May 3, 2016, على موقع واي باك مشين.. Cambridge University Press. (ردمك 0-521-08571-3), pp. 237–250.
- Chambers Twentieth Century Dictionary, p888, W&R Chambers Ltd., 1977.
- Baldwin, W. H. (1931)، "The story of Nickel. I. How "Old Nick's" gnomes were outwitted"، Journal of Chemical Education، 8 (9): 1749، Bibcode:1931JChEd...8.1749B، doi:10.1021/ed008p1749. & Baldwin, W. H. (1931)، "The story of Nickel. II. Nickel comes of age"، Journal of Chemical Education، 8 (10): 1954، Bibcode:1931JChEd...8.1954B، doi:10.1021/ed008p1954. & Baldwin, W. H. (1931)، "The story of Nickel. III. Ore, matte, and metal"، Journal of Chemical Education، 8 (12): 2325، Bibcode:1931JChEd...8.2325B، doi:10.1021/ed008p2325.
- Fleisher, Michael and Mandarino, Joel. Glossary of Mineral Species. Tucson, Arizona: Mineralogical Record, 7th ed. 1995.
- Weeks, Mary Elvira (1932)، "The discovery of the elements: III. Some eighteenth-century metals"، Journal of Chemical Education، 9 (1): 22، Bibcode:1932JChEd...9...22W، doi:10.1021/ed009p22.
- Hammond, C.R.؛ Lide, C. R. (2018)، "The elements"، في Rumble, John R. (المحرر)، CRC Handbook of Chemistry and Physics (ط. 99th)، Boca Raton, FL: CRC Press، ص. 4.22، ISBN 9781138561632.
- Hans Lüschen (in German), Die Namen der Steine. Das Mineralreich im Spiegel der Sprache (2. ed.), Thun: Ott Verlag, pp. 104, 260, ISBN 3-7225-6265-1
- Stixrude؛ Waserman؛ Cohen (نوفمبر 1997)، "Composition and temperature of Earth's inner core"، Journal of Geophysical Research، 102 (B11): 24729–24740، Bibcode:1997JGR...10224729S، doi:10.1029/97JB02125.
- William F. McDonough, [Online "Compositional Model for the Earth's Core"] (in German), Treatise on Geochemistry (Elsevier) 2: pp. 559–577, doi:10.1016/B0-08-043751-6/02015-6, Online نسخة محفوظة 2022-03-08 على موقع واي باك مشين.
- Rasmussen؛ Malvin؛ Wasson (1988)، "Trace element partitioning between taenite and kamacite – Relationship to the cooling rates of iron meteorites"، Meteoritics، 23 (2): a107–112، Bibcode:1988Metic..23..107R، doi:10.1111/j.1945-5100.1988.tb00905.x.
- Calvo, Miguel (2019)، Construyendo la Tabla Periódica، Zaragoza, Spain: Prames، ص. 118، ISBN 978-84-8321-908-9.
- Liste der Elemente und ihre Häufigkeit in der Erdkruste bei uniterra.de نسخة محفوظة 2020-02-21 على موقع واي باك مشين.
- Anthony, John W.؛ Bideaux, Richard A.؛ Bladh, Kenneth W.؛ Nichols, Monte C., المحررون (1990)، "Nickel" (PDF)، Handbook of Mineralogy، Chantilly, VA, US: Mineralogical Society of America، ج. I، ISBN 978-0962209703.
- "Nickel: Nickel mineral information and data"، Mindat.org، مؤرشف من الأصل في 3 مارس 2016، اطلع عليه بتاريخ 02 مارس 2016.
- National Pollutant Inventory – Nickel and compounds Fact Sheet نسخة محفوظة December 8, 2011, على موقع واي باك مشين.. Npi.gov.au. Retrieved on January 9, 2012.
- Kuck, Peter H.، "Mineral Commodity Summaries 2019: Nickel" (PDF)، United States Geological Survey، مؤرشف من الأصل (PDF) في 21 أبريل 2019، اطلع عليه بتاريخ 18 مارس 2019.
- Webmineral – Mineral Species containing Nickel (Ni) (englisch). نسخة محفوظة 2022-04-07 على موقع واي باك مشين.
- "Nickel" (PDF)، U.S. Geological Survey, Mineral Commodity Summaries، يناير 2013، مؤرشف من الأصل (PDF) في 9 مايو 2013، اطلع عليه بتاريخ 20 سبتمبر 2013.
- Gazley؛ Tay؛ Aldrich، "Polymetallic Nodules"، Research Gate، New Zealand Minerals Forum، مؤرشف من الأصل في 11 أبريل 2022، اطلع عليه بتاريخ 27 يناير 2021.
- Mero (01 يناير 1977)، "Chapter 11 Economic Aspects of Nodule Mining"، Marine Manganese Deposits، Elsevier Oceanography Series، ج. 15، ص. 327–355، doi:10.1016/S0422-9894(08)71025-0، ISBN 9780444415240.
- International Seabed Authority، "Strategic Plan 2019-2023" (PDF)، isa.org، International Seabed Authority، مؤرشف من الأصل (PDF) في 12 أبريل 2022، اطلع عليه بتاريخ 27 يناير 2021.
- United States Geological Survey: Mineral Commodity Summaries — Nickel Data Sheet, S. 2 نسخة محفوظة 2022-04-12 على موقع واي باك مشين.
- Kelly؛ Matos، "Nickel Statistics" (PDF)، U.S. Geological Survey، مؤرشف من الأصل (PDF) في 12 أغسطس 2014، اطلع عليه بتاريخ 11 أغسطس 2014.
- "Nickel Data Sheet - Mineral Commodity Summaries 2021" (PDF)، US Geological Survey، مؤرشف من الأصل (PDF) في 12 أبريل 2022، اطلع عليه بتاريخ 29 مارس 2021.
- "Nickel reserves worldwide by country 2020"، Statista (باللغة الإنجليزية)، مؤرشف من الأصل في 24 أبريل 2022، اطلع عليه بتاريخ 29 مارس 2021.
- Gavin M. Mudd, 2009, Nickel Sulfide Versus Laterite: The Hard Sustainability Challenge Remains. Proc. “48 th Annual Conference of Metallurgists”, Canadian Metallurgical Society, Sudbury, Ontario, Kanada, August 2009. نسخة محفوظة 2022-03-05 على موقع واي باك مشين.
- Xue-yi GUO, Wen-tang SHI, Dong LI, Qing-hua TIAN, "Leaching behavior of metals from limonitic laterite ore by high pressure acid leaching" (in German), Transactions of Nonferrous Metals Society of China 21 (1): pp. 191, doi:10.1016/S1003-6326(11)60698-5
- Greenwood, Norman N.؛ Earnshaw, Alan (1997)، Chemistry of the Elements (ط. الثانية)، Butterworth-Heinemann، ISBN 0-08-037941-9.
- Davis, Joseph R. (2000)، "Uses of Nickel"، ASM Specialty Handbook: Nickel, Cobalt, and Their Alloys، ASM International، ص. 7–13، ISBN 978-0-87170-685-0.
- Mond؛ Langer؛ Quincke (1890)، "Action of carbon monoxide on nickel"، Journal of the Chemical Society، 57: 749–753، doi:10.1039/CT8905700749، مؤرشف من الأصل في 13 أبريل 2022.
- Kerfoot, Derek G. E. (2005)، "Nickel"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، doi:10.1002/14356007.a17_157
- Neikov, Oleg D.؛ Naboychenko, Stanislav؛ Gopienko, Victor G & Frishberg, Irina V (15 يناير 2009)، Handbook of Non-Ferrous Metal Powders: Technologies and Applications، Elsevier، ص. 371–، ISBN 978-1-85617-422-0، مؤرشف من الأصل في 29 مايو 2013، اطلع عليه بتاريخ 9 يناير 2012.
- T. P. Whaley, "Nickel powder" (in German), Inorganic Syntheses (McGraw-Hill, Inc.) 5: pp. 195–197
- "Isotopes of the Element Nickel"، Science education، Jefferson Lab، مؤرشف من الأصل في 18 أكتوبر 2017.
- Audi؛ Bersillon؛ Blachot؛ Wapstra (2003)، "The NUBASE evaluation of nuclear and decay properties"، Nuclear Physics A، ج. 729، ص. 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل في 9 أغسطس 2017
- Shurtleff؛ Derringh (1989)، "The Most Tightly Bound Nuclei"، American Journal of Physics، 57 (6): 552، Bibcode:1989AmJPh..57..552S، doi:10.1119/1.15970، مؤرشف من الأصل في 14 مايو 2011، اطلع عليه بتاريخ 19 نوفمبر 2008.
- "Nuclear synthesis"، hyperphysics.phy-astr.gsu.edu، مؤرشف من الأصل في 8 أبريل 2022، اطلع عليه بتاريخ 15 أكتوبر 2020.
- Fewell, M. P. (1995)، "The atomic nuclide with the highest mean binding energy"، American Journal of Physics، 63 (7): 653، Bibcode:1995AmJPh..63..653F، doi:10.1119/1.17828.
- Pagel, Bernard Ephraim Julius (1997)، "Further burning stages: evolution of massive stars"، Nucleosynthesis and chemical evolution of galaxies، ص. 154–160، ISBN 978-0-521-55958-4.
- Castelvecchi, Davide (22 أبريل 2005)، "Atom Smashers Shed Light on Supernovae, Big Bang"، مؤرشف من الأصل في 23 يوليو 2012، اطلع عليه بتاريخ 19 نوفمبر 2008.
- W, P. (23 أكتوبر 1999)، "Twice-magic metal makes its debut – isotope of nickel"، Science News، مؤرشف من الأصل في 24 مايو 2012، اطلع عليه بتاريخ 29 سبتمبر 2006.
- Carboneau؛ Adams (1995)، "Nickel-63"، National Low-Level Waste Management Program Radionuclide Report Series، 10، doi:10.2172/31669، مؤرشف من الأصل في 16 أغسطس 2021.
- Shiozawa؛ Briones-Leon؛ Domanov؛ Zechner؛ وآخرون (2015)، "Nickel clusters embedded in carbon nanotubes as high performance magnets"، Scientific Reports، 5: 15033، Bibcode:2015NatSR...515033S، doi:10.1038/srep15033، PMC 4602218، PMID 26459370.
- Scerri, Eric R. (2007)، The periodic table: its story and its significance، Oxford University Press، ص. 239–240، ISBN 978-0-19-530573-9، مؤرشف من الأصل في 22 مارس 2022.
- Petrucci, R.H. et al. (2002) General Chemistry 8th ed., Prentice–Hall. p. 950. (ردمك 0130143294).
- Miessler, G.L. and Tarr, D.A. (1999) Inorganic Chemistry 2nd ed., Prentice–Hall. p. 38. (ردمك 0138418918).
- NIST Atomic Spectrum Database نسخة محفوظة March 20, 2011, على موقع واي باك مشين. To read the nickel atom levels, type "Ni I" in the Spectrum box and click on Retrieve data.
- Ying Zhu, Ping Yu, Xiaofeng Jin, Ding-sheng Wang: Curie temperature of body-centered-tetragonal Ni. In: Journal of Magnetism and Magnetic Materials. 2007, 310, 2, S. e301-e303, doi:10.1016/j.jmmm.2006.10.240.
- Kittel, Charles (1996)، Introduction to Solid State Physics، Wiley، ص. 449، ISBN 978-0-471-14286-7.
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, B30, S. 193–204, doi:10.1107/S0567740874002469.
- Sharma؛ Hickman؛ Gazit؛ Rabkin؛ Mishin (2018)، "Nickel nanoparticles set a new record of strength"، Nature Communications، 9 (1): 4102، Bibcode:2018NatCo...9.4102S، doi:10.1038/s41467-018-06575-6، PMC 6173750، PMID 30291239.
- A. F. Wells: Structural Inorganic Chemistry, Oxford Press, Oxford, 1984.
- J. Mizuno: The Crystal Structure of Nickel Chloride Hexahydrate, NiCl2 · 6 H2O, in: Journal of the Physical Society of Japan, 1961, 16 (8), S. 1574. بيب كود: 1961JPSJ...16.1574M.
- Lascelles, Keith; Morgan, Lindsay G.; Nicholls, David and Beyersmann, Detmar (2005) "Nickel Compounds" in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a17_235.pub2
- University Of Abuja؛ Av؛ Ah؛ Ai؛ Ne (31 ديسمبر 2020)، "A Review On The Metal Complex Of Nickel (Ii) Salicylhydroxamic Acid And Its Aniline Adduct"، Journal of Translational Science and Research، 2 (1): 1–9، doi:10.24966/TSR-6899/100006، S2CID 212626015، مؤرشف من الأصل في 24 فبراير 2022.
- Wolfgang Glöckner: Die Komplexverbindungen, Aulis Verlag Köln 1962, S. 103–107.
- P. Seiler؛ J. D. Dunitz (1980)، "The structure of nickelocene at room temperature and at 101 K"، Acta Crystallogr، B36: 2255–2260، doi:10.1107/S0567740880008539.
- Jensen (1936)، "Zur Stereochemie des koordinativ vierwertigen Nickels"، Zeitschrift für Anorganische und Allgemeine Chemie، 229 (3): 265–281، doi:10.1002/zaac.19362290304.
- Housecroft؛ Sharpe (2008)، Inorganic Chemistry (ط. 3rd)، Prentice Hall، ص. 729، ISBN 978-0-13-175553-6.
- "The Extraction of Nickel from its Ores by the Mond Process"، Nature، 59 (1516): 63–64، 1898، Bibcode:1898Natur..59...63.، doi:10.1038/059063a0.
- Wilke, G. (1988)، "Contributions to Organo-Nickel Chemistry"، Angewandte Chemie International Edition، 27 (1): 185–206، doi:10.1002/anie.198801851.
- Camasso؛ Sanford (2015)، "Design, synthesis, and carbon-heteroatom coupling reactions of organometallic nickel(IV) complexes"، Science، 347 (6227): 1218–20، Bibcode:2015Sci...347.1218C، CiteSeerX 10.1.1.897.9273، doi:10.1126/science.aaa4526، PMID 25766226، S2CID 206634533.
- Baucom؛ Drago (1971)، "Nickel(II) and nickel(IV) complexes of 2,6-diacetylpyridine dioxime"، Journal of the American Chemical Society، 93 (24): 6469–6475، doi:10.1021/ja00753a022.
- Spokoyny؛ Li؛ Farha؛ Machan؛ She؛ Stern؛ Marks؛ Hupp؛ Mirkin (28 يونيو 2010)، "Electronic Tuning of Nickel-Based Bis(dicarbollide) Redox Shuttles in Dye-Sensitized Solar Cells"، Angew. Chem. Int. Ed.، 49 (31): 5339–5343، doi:10.1002/anie.201002181، PMID 20586090.
- Hawthorne (1967)، "(3)-1,2-Dicarbollyl Complexes of Nickel(III) and Nickel(IV)"، Journal of the American Chemical Society، 89 (2): 470–471، doi:10.1021/ja00978a065.
- E. Schweda (in German), Jander/Blasius: Anorganische Chemie II – Quantitative Analyse & Präparate (16. ed.), Hirzel, pp. 87, ISBN 978-3-7776-2133-3
- Herbert Feltkamp, Peter Fuchs, Heinz Sucker (Hrsg.): Pharmazeutische Qualitätskontrolle. Georg Thieme Verlag, 1983, ISBN 3-13-611501-5, S. 351.
- Mulrooney؛ Hausinger (01 يونيو 2003)، "Nickel uptake and utilization by microorganisms"، FEMS Microbiology Reviews (باللغة الإنجليزية)، 27 (2–3): 239–261، doi:10.1016/S0168-6445(03)00042-1، ISSN 0168-6445، PMID 12829270.
- Astrid Sigel؛ Helmut Sigel؛ Roland K. O. Sigel, المحررون (2008)، Nickel and Its Surprising Impact in Nature، Metal Ions in Life Sciences، Wiley، ج. 2، ISBN 978-0-470-01671-8.
- Sydor؛ Zamble (2013)، Banci, Lucia (المحرر)، Nickel Metallomics: General Themes Guiding Nickel Homeostasis، Metal Ions in Life Sciences، Dordrecht: Springer، ج. 12، ص. 375–416، doi:10.1007/978-94-007-5561-1_11، ISBN 978-94-007-5561-1، PMID 23595678.
- Zamble, Deborah؛ Rowińska-Żyrek, Magdalena؛ Kozlowski, Henryk (2017)، The Biological Chemistry of Nickel، Royal Society of Chemistry، ISBN 978-1-78262-498-1، مؤرشف من الأصل في 24 أبريل 2022.
- Covacci؛ Telford؛ Giudice؛ Parsonnet؛ Rappuoli (21 مايو 1999)، "Helicobacter pylori Virulence and Genetic Geography"، Science، 284 (5418): 1328–1333، Bibcode:1999Sci...284.1328C، doi:10.1126/science.284.5418.1328، PMID 10334982، S2CID 10376008، مؤرشف من الأصل في 24 أبريل 2022.
- Cox؛ Mukherjee؛ Cole؛ Casadevall؛ Perfect (01 فبراير 2000)، "Urease as a Virulence Factor in Experimental Cryptococcosis"، Infection and Immunity، 68 (2): 443–448، doi:10.1128/IAI.68.2.443-448.2000، PMC 97161، PMID 10639402.
- Stephen W. (2014)، "Chapter 6"، في Peter M.H. Kroneck؛ Martha E. Sosa Torres (المحررون)، The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment، Metal Ions in Life Sciences، Springer، ج. 14، ص. 125–145، doi:10.1007/978-94-017-9269-1_6، ISBN 978-94-017-9268-4، PMID 25416393.
- Wang؛ Ragsdale؛ Armstrong (2014)، "Chapter 4."، في Peter M.H. Kroneck؛ Martha E. Sosa Torres (المحررون)، The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment، Metal Ions in Life Sciences، Springer، ج. 14، ص. 71–97، doi:10.1007/978-94-017-9269-1_4، ISBN 978-94-017-9268-4، PMC 4261625، PMID 25416391.
- Szilagyi, R. K.؛ Bryngelson, P. A.؛ Maroney, M. J.؛ Hedman, B.؛ وآخرون (2004)، "S K-Edge X-ray Absorption Spectroscopic Investigation of the Ni-Containing Superoxide Dismutase Active Site: New Structural Insight into the Mechanism"، Journal of the American Chemical Society، 126 (10): 3018–3019، doi:10.1021/ja039106v، PMID 15012109.
- Greig N؛ Wyllie S؛ Vickers TJ؛ Fairlamb AH (2006)، "Trypanothione-dependent glyoxalase I in Trypanosoma cruzi"، Biochemical Journal، 400 (2): 217–23، doi:10.1042/BJ20060882، PMC 1652828، PMID 16958620.
- Zambelli؛ Ciurli (2013)، "Chapter 10. Nickel: and Human Health"، في Astrid Sigel؛ Helmut Sigel؛ Roland K. O. Sigel (المحررون)، Interrelations between Essential Metal Ions and Human Diseases، Metal Ions in Life Sciences، Springer، ج. 13، ص. 321–357، doi:10.1007/978-94-007-7500-8_10، ISBN 978-94-007-7499-5، PMID 24470096.
- Nickel. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Copper نسخة محفوظة September 22, 2017, على موقع واي باك مشين.. National Academy Press. 2001, PP. 521–529.
- Kamerud KL؛ Hobbie KA؛ Anderson KA (28 أغسطس 2013)، "Stainless Steel Leaches Nickel and Chromium into Foods During Cooking"، Journal of Agricultural and Food Chemistry، 61 (39): 9495–501، doi:10.1021/jf402400v، PMC 4284091، PMID 23984718.
- Flint GN؛ Packirisamy S (1997)، "Purity of food cooked in stainless steel utensils"، Food Additives & Contaminants، 14 (2): 115–26، doi:10.1080/02652039709374506، PMID 9102344.
- Rieuwerts, John (2015)، The Elements of Environmental Pollution، London and New York: Earthscan Routledge، ص. 255، ISBN 978-0-415-85919-6، OCLC 886492996، مؤرشف من الأصل في 11 نوفمبر 2021.
- Genchi G, Carocci A, Lauria G, Sinicropi MS, Catalano A. (2020)، "Nickel: Human Health and Environmental Toxicology"، Int J Environ Res Public Health، 17 (3): 679، doi:10.3390/ijerph17030679.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "nikkelen dubbele wapenstuiver Utrecht"، nederlandsemunten.nl، مؤرشف من الأصل في 7 يناير 2015، اطلع عليه بتاريخ 7 يناير 2015.
- United States Mint Moves to Limit Exportation & Melting of Coins نسخة محفوظة May 27, 2016, على موقع واي باك مشين., The United States Mint, press release, December 14, 2006
- "Prohibition on the Exportation, Melting, or Treatment of 5-Cent and One-Cent Coins"، Federal Register، 16 أبريل 2007، مؤرشف من الأصل في 24 أبريل 2022، اطلع عليه بتاريخ 28 أغسطس 2021.
- Molloy, Bill (8 نوفمبر 2001)، "Trends of Nickel in Coins – Past, Present and Future"، The Nickel Institute، مؤرشف من الأصل في 29 سبتمبر 2006، اطلع عليه بتاريخ 19 نوفمبر 2008.
- "Coin Specifications"، usmint.gov، مؤرشف من الأصل في 6 مايو 2022، اطلع عليه بتاريخ 13 أكتوبر 2021.
- Lacey, Anna (22 يونيو 2013)، "A bad penny? New coins and nickel allergy"، BBC Health Check، مؤرشف من الأصل في 7 أغسطس 2013، اطلع عليه بتاريخ 25 يوليو 2013.
- "LME nickel price graphs"، London Metal Exchange، مؤرشف من الأصل في فبراير 28, 2009، اطلع عليه بتاريخ يونيو 6, 2009.
- "London Metal Exchange"، LME.com، مؤرشف من الأصل في 20 سبتمبر 2017.
- Hume؛ Lockett (08 مارس 2022)، "LME introduces emergency measures as nickel hits $100,000 a tonne"، Financial Times، مؤرشف من الأصل في 27 مارس 2022، اطلع عليه بتاريخ 08 مارس 2022.
- Burton؛ Farchy؛ Cang، "LME Halts Nickel Trading After Unprecedented 250% Spike"، Bloomberg News، مؤرشف من الأصل في 6 مايو 2022، اطلع عليه بتاريخ 08 مارس 2022.
- Farchy؛ Cang؛ Burton (14 مارس 2022)، "The 18 Minutes of Trading Chaos That Broke the Nickel Market"، Bloomberg News، مؤرشف من الأصل في 27 أبريل 2022.
- "Nickel Use In Society"، Nickel Institute، مؤرشف من الأصل في 21 سبتمبر 2017.
- Treadgold, Tim، "Gold Is Hot But Nickel Is Hotter As Demand Grows For Batteries In Electric Vehicles"، Forbes (باللغة الإنجليزية)، مؤرشف من الأصل في 1 مايو 2022، اطلع عليه بتاريخ 14 أكتوبر 2020.
- Yang؛ Lee؛ Haas (2005)، "Raney Nickel"، Encyclopedia of Reagents for Organic Synthesis، New York: John Wiley & Sons، doi:10.1002/047084289X.rr001.pub2، ISBN 0471936235.
- "Nickel Compounds – The Inside Story"، Nickel Institute، مؤرشف من الأصل في 31 أغسطس 2018.
- Mosallanejad؛ Shafyei؛ Akhavan (18 أبريل 2016)، "Simultaneous co-deposition of SiC and CNT into the Ni coating"، Canadian Metallurgical Quarterly، 55 (2): 147–155، doi:10.1080/00084433.2016.1150406، S2CID 138392838، مؤرشف من الأصل في 1 مايو 2022، اطلع عليه بتاريخ 09 أغسطس 2016.
- Zhang (18 يونيو 2010)، Nanostructured Thin Films and Coatings: Mechanical Properties (باللغة الإنجليزية)، Taylor & Francis، ISBN 9781420094022، مؤرشف من الأصل في 1 مايو 2022، اطلع عليه بتاريخ 09 أغسطس 2016.
- Kharton, Vladislav V. (2011)، Solid State Electrochemistry II: Electrodes, Interfaces and Ceramic Membranes، Wiley-VCH، ص. 166–، ISBN 978-3-527-32638-9، مؤرشف من الأصل في 10 سبتمبر 2015، اطلع عليه بتاريخ 27 يونيو 2015.
- Bidault, F.؛ Brett, D. J. L.؛ Middleton, P. H.؛ Brandon, N. P.، "A New Cathode Design for Alkaline Fuel Cells (AFCs)" (PDF)، Imperial College London، مؤرشف من الأصل (PDF) في 20 يوليو 2011.
- Cheburaeva؛ Chaporova؛ Krasina (1992)، "Structure and properties of tungsten carbide hard alloys with an alloyed nickel binder"، Soviet Powder Metallurgy and Metal Ceramics، 31 (5): 423–425، doi:10.1007/BF00796252، S2CID 135714029.
- "Krytron Pulse Power Switching Tubes"، Silicon Investigations، 2011، مؤرشف من الأصل في 16 يوليو 2011.
- Uhm؛ وآخرون (يونيو 2016)، "Study of a Betavoltaic Battery Using Electroplated Nickel-63 on Nickel Foil as a Power Source"، Nuclear Engineering and Technology، 48 (3): 773–777، doi:10.1016/j.net.2016.01.010.
- Bormashov؛ وآخرون (أبريل 2018)، "High power density nuclear battery prototype based on diamond Schottky diodes"، Diamond and Related Materials، 84: 41–47، Bibcode:2018DRM....84...41B، doi:10.1016/j.diamond.2018.03.006.
- "Nickel 203904"، Sigma Aldrich، مؤرشف من الأصل في 26 يناير 2020، اطلع عليه بتاريخ 26 يناير 2020.
- Haber؛ Bates؛ Allen؛ Vincent؛ Oller (2017)، "Derivation of an oral toxicity reference value for nickel"، Regulatory Toxicology and Pharmacology، 87: S1–S18، doi:10.1016/j.yrtph.2017.03.011، PMID 28300623.
- IARC (2012). "Nickel and nickel compounds" نسخة محفوظة September 20, 2017, على موقع واي باك مشين. in IARC Monogr Eval Carcinog Risks Hum. Volume 100C. pp. 169–218..
- Globally Harmonised System of Classification and Labelling of Chemicals (GHS) نسخة محفوظة August 29, 2017, على موقع واي باك مشين., 5th ed., United Nations, New York and Geneva, 2013..
- National Toxicology Program. (2016). "Report on Carcinogens" نسخة محفوظة September 20, 2017, على موقع واي باك مشين., 14th ed. Research Triangle Park, NC: U.S. Department of Health and Human Services, Public Health Service..
- Cogliano؛ Baan؛ Straif؛ Grosse؛ Lauby-Secretan؛ El Ghissassi؛ Bouvard؛ Benbrahim-Tallaa؛ Guha؛ Freeman, C؛ Galichet, L؛ Wild, C. P (2011)، "Preventable exposures associated with human cancers"، JNCI Journal of the National Cancer Institute، 103 (24): 1827–39، doi:10.1093/jnci/djr483، PMC 3243677، PMID 22158127.
- Heim؛ Bates؛ Rush؛ Oller (2007)، "Oral carcinogenicity study with nickel sulfate hexahydrate in Fischer 344 rats"، Toxicology and Applied Pharmacology، 224 (2): 126–37، doi:10.1016/j.taap.2007.06.024، PMID 17692353.
- "Report of the International Committee on Nickel Carcinogenesis in Man"، Scandinavian Journal of Work, Environment & Health، 16 (1 Spec No): 1–82، 1990، doi:10.5271/sjweh.1813، JSTOR 40965957، PMID 2185539.
- National Toxicology Program (1996)، "NTP Toxicology and Carcinogenesis Studies of Nickel Subsulfide (CAS No. 12035-72-2) in F344 Rats and B6C3F1 Mice (Inhalation Studies)"، National Toxicology Program Technical Report Series، 453: 1–365، PMID 12594522.
- National Toxicology Program (1996)، "NTP Toxicology and Carcinogenesis Studies of Nickel Oxide (CAS No. 1313-99-1) in F344 Rats and B6C3F1 Mice (Inhalation Studies)"، National Toxicology Program Technical Report Series، 451: 1–381، PMID 12594524.
- Oller؛ Kirkpatrick؛ Radovsky؛ Bates (2008)، "Inhalation carcinogenicity study with nickel metal powder in Wistar rats"، Toxicology and Applied Pharmacology، 233 (2): 262–75، doi:10.1016/j.taap.2008.08.017، PMID 18822311.
- Stellman, Jeanne Mager (1998)، Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations، International Labour Organization، ص. 133–، ISBN 978-92-2-109816-4، مؤرشف من الأصل في 29 مايو 2013، اطلع عليه بتاريخ 9 يناير 2012.
- Barceloux؛ Barceloux (1999)، "Nickel"، Clinical Toxicology، 37 (2): 239–258، doi:10.1081/CLT-100102423، PMID 10382559.
- Butticè (2015)، "Nickel Compounds"، في Colditz, Graham A. (المحرر)، The SAGE Encyclopedia of Cancer and Society (ط. Second)، Thousand Oaks: SAGE Publications, Inc.، ص. 828–831، ISBN 9781483345734.
- Vaktskjold؛ Talykova؛ Chashchin؛ Nieboer؛ Thomassen؛ Odland (2006)، "Genital malformations in newborns of female nickel-refinery workers"، Scandinavian Journal of Work, Environment & Health، 32 (1): 41–50، doi:10.5271/sjweh.975، PMID 16539171.
- Vaktskjold؛ Talykova؛ Chashchin؛ Odland؛ Nieboer (2008)، "Spontaneous abortions among nickel-exposed female refinery workers"، International Journal of Environmental Health Research، 18 (2): 99–115، doi:10.1080/09603120701498295، PMID 18365800، S2CID 24791972.
- Vaktskjold؛ Talykova؛ Chashchin؛ Odland؛ Nieboer (2007)، "Small-for-gestational-age newborns of female refinery workers exposed to nickel"، International Journal of Occupational Medicine and Environmental Health، 20 (4): 327–38، doi:10.2478/v10001-007-0034-0، PMID 18165195، S2CID 1439478، مؤرشف من الأصل في 11 أبريل 2022.
- Vaktskjold؛ Talykova؛ Chashchin؛ Odland؛ Nieboer (2008)، "Maternal nickel exposure and congenital musculoskeletal defects"، American Journal of Industrial Medicine، 51 (11): 825–33، doi:10.1002/ajim.20609، PMID 18655106.
- "CDC – NIOSH Pocket Guide to Chemical Hazards – Nickel metal and other compounds (as Ni)"، www.cdc.gov، مؤرشف من الأصل في 18 يوليو 2017، اطلع عليه بتاريخ 20 نوفمبر 2015.
- Dow, Lea (3 يونيو 2008)، "Nickel Named 2008 Contact Allergen of the Year"، Nickel Allergy Information، مؤرشف من الأصل في 03 فبراير 2009.
- A. Schnuch, W. Uter, J. Geier, O. Gefeller: Epidemiology of contact allergy. An estimation of morbidity employing the clinical epidemiology and drug-utilization research (CE-DUR) approach. In: Contact Dermatitis 47(1), 2002, S. 32–39; PMID 12225411.
- Thyssen J. P.؛ Linneberg A.؛ Menné T.؛ Johansen J. D. (2007)، "The epidemiology of contact allergy in the general population—prevalence and main findings"، Contact Dermatitis، 57 (5): 287–99، doi:10.1111/j.1600-0536.2007.01220.x، PMID 17937743، S2CID 44890665.
- Nestle؛ Speidel؛ Speidel (2002)، "High nickel release from 1- and 2-euro coins"، Nature، 419 (6903): 132، Bibcode:2002Natur.419..132N، doi:10.1038/419132a، PMID 12226655، S2CID 52866209.
- بوابة العناصر الكيميائية
- بوابة علم المواد
- بوابة الكيمياء
