نيوترون
النيوترون جسيم تحت ذري كان يظن في بادئ الأمر أنه جسيم أولي (لا يتكون من جسيمات أصغر) ولكن تبين فيما بعد خطأ هذا الاعتقاد[3]، كتلته تساوي تقريباً كتلة البروتون، يوجد في أنوية الذرات، كما يمكن أن يوجد خارجها حيث يدعى بالنيوترون الحر. النيوترون الحر غير مستقر له متوسط عمر قدره حوالي 886 ثانية (حوالي 15 دقيقة)، حيث يتحلل بعد هذه الفترة القصيرة إلى بروتون وإلكترون. ولأن النيوترونات غير مشحونة يجعل من الصعب كشفها أو التحكم بها، الأمر الذي أدى لتأخر اكتشافها. فقد اكتشفها عالم الفيزياء حامل جائزة نوبل «جيمس شادويك».[4]
| ||||
|---|---|---|---|---|
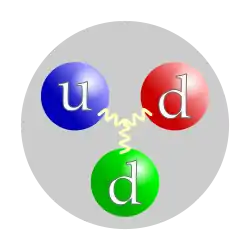 تكوين الكوارك للنيوترون. | ||||
| التصنيف | باريون | |||
| التكوين | 1 كوارك علوي, 2 كواركات سفلية | |||
| العائلة | فرميون | |||
| المجموعة | هادرون | |||
| التفاعل | جاذبية, ضعيف, قوي | |||
| جسيم مضاد | نيوترون مضاد | |||
| واضع النظرية | إرنست رذرفورد[1] (1920) | |||
| المكتشف | جيمس تشادويك[1] (1932) | |||
| الرمز | n , n0 , N0 | |||
| الكتلة | 1.67492729(28)×10−27 كـg 939.565560(81) MeV/c2 1.0086649156(6) u[2] | |||
| متوسط العمر | 885.7(8) ثانية (نيوترون حر) | |||
| الشحنة الكهربائية | 0 e 0 C | |||
| العزم المغناطيسي | عزم مغناطيسي للنيوترون مغنطون نووي | |||
| الدوران | 2⁄1 | |||
| دوران النظير | 2⁄1- | |||
| المكافئ | +1 | |||
| Condensed | I(JP) = 1⁄2(1⁄2+) | |||
كما أن النيوترونات الحرة (الإشعاعات النيوترونية) لها قدرتها العالية على النفاذ في المواد. الطريقة الوحيدة لتغيير مسار النيوترون هي بوضع نواة في مساره، حيث يتم تصادم تام المرونة. لكن احتمال اصطدام نيوترون حر متحرك بنواة إحدى الذرات في المادة ضعيف جداً بسبب الفرق الهائل بين حجم النيوترون والنواة، علما ً بأن نواة الذرة أصغر كثيرا جدا من حجم الذرة (أي أن الذرة تحوي فراغاً كبيراً)، مما يعطي النيوترونات قدرة كبيرة على الاختراق.
تستخدم النيوترونات في شطر أنوية اليورانيوم في المفاعلات النووية.وينتج عند انشطار نواة اليورانيوم نيوترونين في المتوسط، تتفاعل هي الأخرى مع نوايا يورانيوم أخرى، بهذا تتزايد النيوترونات وكذلك معدل الانشطار يزداد بما يسمى التفاعل المتسلسل. وفي المفاعل النووي توجد مواد لامتصاص النيوترونات الزائدة بحيث يبقى التفاعل متوازناً، ونستطيع بذلك إنتاج الطاقة عن طريق المفاعلات الذرية أو النووية.
اكتشاف النيوترون
تاريخ المحاولات طويل وكانت قد بدأت بتوقعات ومحاولة اثبات هذه التوقعات على أسس مختلفة مثل دراسة الخواص المميزة، دراسة اختلاف التصادم، دراسة الطاقة الفائضة الناتجة عنها في شكل حرارة وكثير منها باء بالفشل.
كان رذرفورد قد تنبأ بوجودها عام 1920 وبعدها بعشر سنوات لاحظ الفيزيائيان الألمانيان والتر وهيربرت شيئاً غريباً عند إطلاقهما أشعة ألفا على عنصر البريليوم (عددها الذري 4). انبعثت من البريليوم اشعاعات متعادلة قادرة على اختراق 200 مم من الرصاص في حين أن البروتونات كانت لا تستطيع اختراق 1 مم من الرصاص. افترض الاثنان أن السبب هو إشعاعات من غاما عالية الطاقة.
بعدها جاء دور علماء آخرين لفحص الأشعة عن كثب، حيث وضعوا حاجزا من شمع البارافين مقابل أشعة البريليوم فلاحظوا قدوم بروتونات عالية السرعة من البارافين. كانوا على علم حينها أن اشعاع غاما يفترض بها انتزاع الكترونات من المعادن لذا توقعوا أن نفس الشيء حاصل مع البروتونات في البارافين.
بعدها رفض العالم شادويك هذه الفكرة معللا السبب أن انتزاع بروتونات بسرعات عالية كهذه ينبغي أن تكون له طاقة مقدارها 50 مليون إلكترون فولت وبالمقارنة فإن اشعاعات الفا كانت قادرة على إنتاج 14 مليون الكترون فولت تقريبا فقط..
وضع شادويك تجربة أخرى ليوضح ما يحدث أكثر حيث وضع قطعة من البريليوم في غرفة مفرغة مع بعض البولونيوم. انبعثت اشعاعات الفا من البلونبوم والذي اعترض البريليوم. أثناء الاعتراض انطلقت أشعة متعادلة محيرة. وفي مسار الأشعة وضع شادويك حاجزا آخر وعندم اصطدمت به الأشعة، ضربت بذرات منه وأصبحت مشحونة فطارت نحو مجس جسيمات من النوع الغازي (تأين). قام شادويك بقياس التيار الناجم عن عملية التأين هذه وعليه استطاع حساب عدد الذرات وتوقع سرعتها. وبإعادة تجاربه على أهداف مختلفة استطاع الاقتناع والإقناع بأن إشعاعات غاما لا تستطيع تفسير سرعة الذرات وبالتالي فإن الاحتمال الأرجح والمعقول هو جسيمات متعادلة.
بعدها قام شادويك بقياس كتلة هذه الجسيمات ولكن بطريقة غير مباشرة حيث قاما بقياس جميع نواتج الاصطدام على البورون بدلا من البريليوم والذي انتج أيضا اشعاعات متعادلة فوضع هدفا حاجزا من الهيدروجين أمام الأشعة وعندما حدث التصادم وتطايرت بروتونات قام شادويك بقياس سرعة هذه البروتونات. بتطبيق قوانين بقاء الطاقة والزخم (كمية التحرك)، استطاع شادويك حساب كتلة جسيم النيوترون ليجد أنها 1.0067 من البروتون.[5]
انظر أيضاً
المصادر
- 1935 Nobel Prize in Physics نسخة محفوظة 03 أكتوبر 2017 على موقع واي باك مشين.
- Particle Data Group's Review of Particle Physics 2006 نسخة محفوظة 25 يناير 2017 على موقع واي باك مشين.
- Cottingham, W. & Greenwood, D: "An introduction to the standard model of particle physics", page 1. Cambridge University Press, 2007
- البروفسور الدكتور صلاح مصطفى (23 أبريل 2003)، الكيمياء العامة: GENERAL CHEMISTRY، العبيكان للنشر، ISBN 9789960402307، مؤرشف من الأصل في 26 يناير 2020.
- Nuclear Twins: The Discovery of the Proton and Neutron نسخة محفوظة 22 يناير 2018 على موقع واي باك مشين.
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة علم المواد
- بوابة ميكانيكا الكم