رصاص
الرصاص عنصر كيميائي رمزه Pb وعدده الذرّي 82؛ ويقع في الجدول الدوري ضمن مجموعة الكربون (المجموعة الرابعة عشرة؛ وهي أيضاً المجموعة الرابعة وفق ترقيم المجموعات الرئيسية). الرصاص فلزُّ ثقيل ذو كثافةٍ مرتفعة، ويوجد في الأحوال العادية بلونٍ فضّي مزرّق، والذي سرعان ما يفقد لمعانه إلى لونٍ رماديٍّ معتم عند التعرّض للهواء. يدخل الرصاص في تركيب عدد من السبائك، وهو أيضاً فلزٌّ طريٌّ مطواع وقابل للسحب والتطريق؛ كما أنّه فلز مستقرّ، وثلاثةٌ من نظائره تقع في نهاية سلسلة اضمحلال العناصر الثقيلة المشعّة.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزّي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | رصاص، 82، Pb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز بعد انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 14، 6، p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 207.2 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Xe]; 4f14 5d10 6s2 6p2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 32, 18, 4 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 11.34 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 10.66 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 600.61 ك، 327.46 °س، 621.43 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 2022 ك، 1749 °س، 3180 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 4.77 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 179.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 26.650 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 4, 2 (أكاسيده (مذبذبة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 2.33 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 715.6 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1450.5 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3081.5 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 175 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 5±146 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 202 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 208 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 35.3 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 28.9 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 16 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 5.6 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 46 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.44 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 38.3 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7439-92-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الرصاص | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
يصنّف الرصاص كيميائياً من الفلزّات بعد الانتقالية (الفلزّات الضعيفة)، وتتجلّى تلك الصفة في طبيعته المذبذبة؛ إذ يتفاعل الرصاص وأكسيده مع الأحماض والقواعد؛ كما أنّ هناك تفاوتٌ في صفة مركّباته الكيميائية حسب حالة الأكسدة، فمركّبات الرصاص الثنائي ذات صفة أيونية، في حين أنّ مركّبات الرصاص الرباعي تغلب عليها الصفة التساهمية مثلما هو الحال في مركّبات الرصاص العضوي.
يستخرج الرصاص من خاماته بسهولة؛ ومنذ قديم الزمان تمكّن الإنسان في العالم القديم من استحصاله، وخاصّة من معدن غالينا، الذي يعدّ المصدر الرئيسي لاستخراج الرصاص. بما أنّ الفضّة غالباً ما ترافق الرصاص في خاماته، لذلك كان السعي للحصول على الفضّة سبباً في معرفة الرصاص واستخدامه في مجالات الحياة اليومية في روما القديمة. بلغ الإنتاج العالمي من الرصاص سنة 2014 حوالي 10 ملايين طنّ، وكانت نسبة الحصول عليهِ من تدوير المخلّفات الحاوية على الرصاص أكثر من 50%.
ساعدت الخواص المميّزة للرصاص، من الكثافة المرتفعة والانخفاض النسبي لنقطة الانصهار وخموله الكيميائي تجاه الأكسدة، بالإضافة إلى وفرته النسبية المرتفعة وانخفاض ثمنه من استخدامهِ في العديد من التطبيقات التي شملت على سبيل المثال، الإنشاءات والوقاية من الإشعاع والسباكة وصناعة البطّاريات والطلقات والمقذوفات والأثقال والسبائك المختلفة مثل سبائك اللحام وسبيكة بيوتر والسبائك سهلة الانصهار (الصَهُورَة)؛ بالإضافة إلى استخدامه سابقاً في مجال الدهانات وإضافتهِ إلى وقود السيارات (على شكل مركّب رباعي إيثيل الرصاص).
الرصاص فلزّ سامّ، الأمر الذي أدّى إلى الحدّ من تطبيقاته في أغلب الدول بعد اكتشاف سمّيّته. يؤثّر الرصاص سلباً داخل الأجسام الحيوية، حيث يكون تأثيره مشابهاً للسموم العصبية من حيث القدرة على الإضرار بالجهاز العصبي وتعطيل الأداء الوظيفي لبعض الإنزيمات الحيوية مسبّباً اضطراباتٍ عصبية وحركية.
التاريخ
العصر القديم
يعدّ الرصاص من أقدم الفلزّات المستخدمة في تاريخ البشرية. وكان هو بالإضافة إلى الزرنيخ والإثمد أحدَ الفلزّات التي جرى تجريبها في العصر البرونزي الأول من أجل تحضير البرونز، إلى أن اكتشف القصدير. عُثر على قطعٍ من الرصاص الفلزّي يعود تاريخها إلى حوالي 7000 سنة قبل الميلاد في منطقة الأناضول بالقرب من جاتال هويوك، وهي تمثّل أقدم موجودات تاريخية جرى معالجتها بالصهر.[2] في ذلك الوقت لم يكن للرصاص أيَّ تطبيقٍ معروف بسبب طراوته ومظهره الكامد؛[2] وكان العامل الرئيسي في انتشار استخراجه هو مرافقته للفضة في الخامات في القشرة الأرضية.[3]
كان المصريون القدماء أوّل من استخدم الرصاص في التجميل، وهو تطبيق انتشر بعد ذلك إلى اليونان القديمة وغيرها من الحضارات؛[4] بالإضافة إلى ذلك فمن المحتمل أن يكون المصريون القدماء قد استخدموا الرصاص أيضاً في تثقيل شباك صيد السمك وفي صناعة الزجاج والمينا المزجج وكذلك في صناعة أغراض الزينة.[3] استعملت عدّة حضارات في منطقة الهلال الخصيب الرصاص في عددٍ من التطبيقات المختلفة مثل استخدامه في الكتابة وسكّ العملة وضمن مواد البناء.[3] أمّا في الشرق الأدنى فاستخدم الصينيون القدماء الرصاص من إحدى الوسائل لضبط النسل،[5] وكذلك في سكّ العملة؛[6] بالمقابل دخل الرصاص في صناعة التمائم في حضارتي وادي السند ووسط أمريكا؛[3] في حين أنّ شعوب أفريقيا الشرقية والجنوبية استخدمته في سحب الأسلاك.[7]
- عصر اليونان والرومان

بما أنّ الفضّة كانت مستخدمة بكثرة في التجارة وفي صناعة مواد الزينة منذ التاريخ القديم، وبسبب مرافقتها للرصاص في الخامات، لذلك انتشرت معالجة الرصاص في منطقة الأناضول منذ 3000 سنة قبل الميلاد، ولاحقاً في مناطق مختلفة في اليونان مثل الجزر الإيجية ومدينة لافريو؛ والتي بقيت مسيطرةً على إنتاج الرصاص حتّى 1200 سنة قبل الميلاد.[8] منذ حوالي 2000 سنة قبل الميلاد بدأت مناطق أخرى تُعرَف بإنتاج الرصاص بالظهور والازدهار؛ فمثلاً تمكّن الفينيقيون من معالجة الرصاص في مناطق مختلفة منها شبه الجزيرة الإيبيرية، وكذلك في اليونان وقبرص وسردينيا.[9]

أدّى توسّع الجمهورية الرومانية في منطقة حوض المتوسط إلى انتشار تعدين الرصاص، خاصّةً مع التطوّر النسبي لوسائل التعدين أثناء فترة العصر الكلاسيكي القديم؛ إذ قُدِّرَت سَعةُ الإنتاج العظمى من الرصاص حينئذٍ بحوالي 80 ألف طنّ سنوياً؛ وذلك من المعالجة الحرارية لخامات الفضّة الحاوية على الرصاص.[10][11] استُخدِم الرصاص في الكتابة على الألواح؛[12] وكذلك في صناعة النعوش.[13] كما شاع استخدام الرصاص في صناعة قنوات المجاري وفي الإنشاءات المدنية والصناعات العسكرية، خاصّةً مع سهولة سبكه والتعامل الحرفي معه، ومقاومته للتآكل؛[14][15][16][17] بالإضافة إلى سهولة الحصول عليه،[18] ورخص ثمنه.[19]
نصحَ عددٌ من الكتّاب الرومان، مثل كاتو الأكبر وكولوميلا وبلينيوس الأكبر، باستخدام أواني الرصاص لتحضير دبس العنب الذي كان يضاف إلى الخمر؛[20] وذلك لأن الرصاص كان يضفي في بعض الأحيان مذاقاً حلواً (بسبب تشكّل «سكّر الرصاص»، وهو مركب أسيتات الرصاص الثنائي)؛ في حين أنّ الأواني المصنوعة من النحاس أو البرونز كانت تعطي مذاقاً مرّاً بسبب تشكّل الزنجار.[21] من جهةٍ أخرى، وثَّقَ الكاتب الروماني فيتروفيو المخاطر الصحّية للرصاص،[22] وقد يكون للاستخدام المفرط للرصاص في مجالات الحياة اليومية دوراً في انحدار الإمبراطورية الرومانية، وذلك وفقاً لرأي بعض المحلّلين التاريخيين المتأخرّين؛[23][24][25] إلّا أنّ ذلك الرأي وجد معارضةً من بعض الباحثين الآخرين، الذين أشاروا على سبيل المثال بأنّ ليس كلَّ ألمٍ معويِّ سببه التسمّم بالرصاص،[26][27] وشكّكوا بدور أنابيب نقل المياه المصنوعة من الرصاص بحدوث حالات التسمّم.[28][29]
العصور الوسطى
_-_Portrait_of_Queen_Elizabeth_I_-_Google_Art_Project.jpg.webp)
مع سقوط الإمبراطورية الرومانية الغربية تراجع إنتاج الرصاص في أوروبا الغربية، خاصّةً مع صعود دولة الأمويّين في الأندلس، إذ كانت تلك المنطقة الوحيدة ذات الإنتاج المهمّ في أوروبا في ذلك الوقت؛[31][32] بالمقابل ازداد الإنتاج في مناطق أخرى من العالم مثل الصين والهند.[32]
كان الرصاص عنصراً حاضراً في تجارب الخيميائيين سواء في عصر الحضارة الإسلامية أو ما قبل عصر النهضة الأوروبي؛ وكان له الرمز الخيميائي ![]() في مدوّنات ذلك العصر،[33]، والذي كان مخصّصاً أيضاً لكوكب زحل. كان الرصاص عند الخيميائيين يعدّ من الفلزّات الوضيعة الشائبة، والذي يمكن لجوهرهِ أن يتحوّل إلى فلزّ نبيلٍ نقيٍّ مثل الذهب بالعمليات والتقنيات الخيميائية المناسبة. وقد ذكره البيروني في كتابهِ الجماهر في معرفة الجواهر وخصّص لهُ قِسماً.
في مدوّنات ذلك العصر،[33]، والذي كان مخصّصاً أيضاً لكوكب زحل. كان الرصاص عند الخيميائيين يعدّ من الفلزّات الوضيعة الشائبة، والذي يمكن لجوهرهِ أن يتحوّل إلى فلزّ نبيلٍ نقيٍّ مثل الذهب بالعمليات والتقنيات الخيميائية المناسبة. وقد ذكره البيروني في كتابهِ الجماهر في معرفة الجواهر وخصّص لهُ قِسماً.
بالإضافة إلى ذلك فقد استُخدِم الرصاص منذ بداية القرن الثالث عشر في صناعة الزجاج المعشّق؛[34] كما استخدِم في غشّ الخمر، الأمرِ الذي أدّى إلى حالات تسمّم كثيرة موثّقة حتى نهاية القرن الثامن عشر.[31][35] من جهة أخرى فقد كان الرصاص مادّةً أساسيةً في صناعة أجزاء من آلة الطباعة التي اختُرعت حوالي منتصف القرن الخامس عشر، الأمر الذي عرّض الكثير من العمّال لحالات التسمّم بالرصاص أيضاً.[36] دخل الرصاص في صناعة مقذوفات وطلقات الأسلحة النارية نظراً لرخص ثمنهِ وتوفّره ولارتفاع كثافتهِ وانخفاض نقطة انصهاره.[37]
شاع استخدام أبيض الرصاص في مستحضرات التجميل في ذلك العصر، لأجل تبييض الوجه، وكان يسمّى حينها إسبيداج (أو الإسفيداج)؛[38][39] كما كان يُستخدم للطلاء، إلّا أنّ تلك الاستخدامات تراجعت تدريجياً للسمّيّة. كان ذلك الاستخدام شائعاً ضمن الطبقات الأرستقراطية الأوروبية؛ وكذلك في اليابان أيضاً،[40] والتي شاع فيها تقليد غيشا في تبييض الوجوه حتّى القرن العشرين، إذ كانت الوجوه البيضاء للنساء في ذلك العصر دلالةً على أنوثة المرأة اليابانية.[41]
العصر الحديث
بعد اكتشاف العالم الجديد أنتج المستوطنون الأوروبيون عنصر الرصاص؛ وتعود أقدم السجلّات التي تشير إلى إنتاجهِ في تلك المرحلة إلى سنة 1621 في مستعمرة فرجينيا البريطانية، وذلك بعد أربع عشر سنةٍ من تأسيسها.[42] أمّا في أستراليا فقد كان أوّل منجم افتُتِح هناك للرصاص في سنة 1841.[43]

ساعدت الثورة الصناعية على زيادة إنتاج الرصاص في أوروبا والولايات المتّحدة،[10] إذ كان من أهمّ الفلزّات اللاحديدية المعروفة حينئذ. كانت بريطانيا رائدةً في ذلك المجال بادئ الأمر، ثمّ تراجعت مع نضوب مناجمها مع مرور الوقت؛[44] ومع بداية القرن العشرين أضحت الولايات المتّحدة الرائدة في الإنتاج العالمي للرصاص، كما بدأت دول أخرى غير أوروبية بالظهور على ساحة الإنتاج العالمي مثل كندا والمكسيك وأستراليا.[45] كان الرصاص مطلوباً في ذلك الوقت بشكلٍ أساسيٍ للسباكة ولصنع الدهان؛[46] كما استخدم في صناعة الغرف والحجرات لتحضير حمض الكبريتيك. بالمقابل ازداد تعرّض الطبقة العاملة للتسمم بالرصاص، ممّا أدّى إلى ظهور مخاطره للعلن، الأمر الذي استدعى إجراء أبحاثٍ لدراسة تأثير الرصاص على الإنسان؛ وكان الطبيب ألفريد بارينغ غارود ممّن قاموا بذلك، والذي ربط بين ضحايا التسمّم بالرصاص ومهنتهم، فوجد أنّ نسبة الثلث منهم من السبّاكين والدهّانين.
مع تقدّم العلم وفهم آليات الإصابة بتسمّم الرصاص انتقل موضوع التعامل مع هذا الفلز من ردهات المخابر إلى قاعات البرلمان، إذ بدأت التشريعات التي تحدّ من التعامل بهِ بالظهور. وقد صدر أوّل قانونٌ لفرض رقابة على إنتاج الرصاص في المصانع في المملكة المتّحدة أواخر القرن التاسع عشر؛[46] كما جرى تعيين هيئةٍ طبّية لفحص العمال؛ ممّا أدّى في النهاية إلى انخفاض حوادث التسمّم بالرصاص بحوالي 25 ضعفا ما بين سنتي 1900 و1944.[47] بالإضافة إلى ذلك فقد منعت معظم الدول الأوروبية دهانات الرصاص في الأماكن الداخلية المغلقة منذ سنة 1930.[48][49] كانت إضافة رباعي إيثيل الرصاص إلى وقود السيارات لمنع خبط المحرك آخر وسيلة تعرض فيها الإنسان للتماسٍ المباشر مع الرصاص؛ إلّا أنّها تراجعت تدريجياً مع مرور الزمن، خاصّةً مع جهود عدّة ناشطين بيئيين مثل كلير باترسون؛ إلى أن منعت نهائياً في أوروبا والولايات المتّحدة أواخر القرن العشرين؛[46] بصدور تشريعاتٍ لمنع استعماله منذ عقد السبعينات للحدّ من تلوّث الهواء بالرصاص؛[50][51] مثل توجيه الحد من المواد الخطرة في أوروبا. جرّاءَ ذلك انخفض مستوى الرصاص في الدم وفق دراسات أجرتها مراكز مكافحة الأمراض واتقائها في الولايات المتّحدة من 77.8% أواخر سبعينات القرن العشرين إلى 2.2% في أوائل تسعينات ذلك القرن.[52] وفي نهاية القرن العشرين كان المُنَتج الوحيد الحاوي على الرصاص والمستخدم بكثرة هو بطّارية الرصاص الحمضية؛[53] إلّا أنّها لا تمثّل خطراً مباشراً على صحّة الإنسان. وازداد إنتاج الرصاص في الصين بشكل مطّرد، إلى أن أصبحت في صدارة الإنتاج العالمي منذ بداية القرن الحادي والعشرين؛[54] إلّا أنّ الأمر لم يخلو من مشاكل صحّيّة هناك أيضاً.[55]
الأصل والوفرة
| العدد الذرّي |
العنصر | الكمّية النسبية |
|---|---|---|
| 42 | موليبدنوم | 0.798 |
| 46 | بالاديوم | 0.440 |
| 50 | قصدير | 1.146 |
| 78 | بلاتين | 0.417 |
| 80 | زئبق | 0.127 |
| 82 | رصاص | 1 |
| 90 | ثوريوم | 0.011 |
| 92 | يورانيوم | 0.003 |
في الكون
على الرغم من ارتفاع العدد الذرّي للرصاص إلّا أنّ وفرته في الكون تفوق أغلب العناصر ذات العدد الأكبر من 40؛[56] إذ تبلغ وفرته في النظام الشمسي نسبةً إلى عدد الجسيمات مقدار 0.121 جزء في البليون (ppb)،[56] وهو مقدار أكثر بمرّتين ونصف من وفرة البلاتين، وأكثر بثمانِ مرّات من وفرة الزئبق، وأكثر بحوالي 17 مرّة من وفرة الذهب في الكون.[56] على العموم فإنّ كمّيّة الرصاص في الكون بازديادٍ ضئيلٍ مستمرٍّ،[57] لأنّ أغلب العناصر الأثقل منهُ تضمحلّ إليه تدريجياً؛[58] وتُقدّر نسبة ازدياد الرصاص في الكون منذ نشأته بحوالي 0.75%.[59]
إنّ الرصاص الابتدائي، والمتكوّن من نظائر الرصاص 204 و206 و207 و208، كان قد تشكّل نتيجة عمليات التقاط نيوترون متكرّرة داخل النجوم؛ وهي تشمل كِلَا النوعين: العمليّات البطيئة والسريعة.[60]

تفصل بين عمليات التقاط النيوترون البطئية سنوات أو عقود، ممّا يسمح للنوى الأقلّ استقراراً بأن تخضع لاضمحلال بيتا.[61] يمكن أيضاً لعمليات التقاط النيوترون أن تحدث بشكلٍ بطيءٍ جدّاً، يستمرّ الالتقاط لملايين السنين، بحيث يستحصل بالنهاية من نواة ثاليوم مستقرّة على نظائر الرصاص المستقرّة.[62] بالمقابل، فإنّ عمليات التقاط النيوترون السريعة تحدث بشكلٍ أسرع من اضمحلال النواة نفسها؛[63] وتكون مفضّلةَ الحدوث في الأوساط ذات الكثافة النيوترونية المرتفعة مثل المستعرّات العظمى أو مناطق اندماج النجوم النيوترونية؛ والتي يمكن أن يقدّر معدّل تدفّق النيوترونات فيها بحوالي 2210 نيوترون لكلّ سم2 كل ثانية.[64] من جهةٍ أخرى، فإنّ كمّيّة الرصاص المتشكّلة عن طريق عمليّات التقاط النيوترون السريعة أقلّ من نظيرتها في العمليات البطيئة؛[65] إذ أنّها تميل لأن تتوقّف في الغالب عندما يصلُ عدد النيوترونات في النواة إلى 126؛[66] عند تلك النقطة تترتّب النيوترونات في أغلفة مكتملة في نواة الذرّة، ويصبح من الصعب طاقياً استيعاب كمّيّة أكبر.[67]
على الأرض
يصنّف الرصاص وفقاً لتصنيف غولدشميت عنصراً أليفاً لعناصر مجموعة الكالكوجين، بمعنى أنّه يُعثَر عليه بشكلٍ عامّ مع الكبريت.[68] ومن النادر العثور عليه بصورته المعدنية على هيئة فلز طبيعي.[69] تعدّ العديد من معادن الرصاص خفيفةً نسبياً، وعلى مدار تاريخ الأرض بقيت في طبقة القشرة الأرضية السطحية ولم تترسّب في باطن الأرض. لذا يعتبر الرصاص من العناصر المتقدّمة نسبياً من حيث وفرته الطبيعية في القشرة الأرضية بنسبة 14 جزء في المليون (ppm)؛ وهو العنصر الثامن والثلاثين من حيث غزارة وفرته في القشرة الأرضية.[70][71]
أهم المعادن التي تقترن بالرصاص هو معدن الغالينا (PbS) والذي يوجد غالباً مع خامات الزنك.[72] ترتبط معظم معادن الرصاص الأخرى بالغالينا بطريقةٍ ما؛ فمعدن البولانغيرايت Pb5Sb4S11، هو كبريتيدٌ مختلَطٌ مشتقٌّ من الغالينا؛ أمّا أنغلزيت، PbSO4، فهو ناتجٌ عن أكسدة الغالينا؛ وسيروسيت أو خام الرصاص الأبيض، PbCO3، فهو ناتج عن تحلّل الغالينا. تعدّ معادن الزرنيخ والقصدير والأنتيموان (الإثمد) والفضّة والذهب ونحاس والبزموت شوائبَ شائعة في معادن الرصاص.[72]
تتجاوز الموارد العالمية من الرصاص حوالي ملياري طنّ؛ وتوجد منه مخزونات كبيرة في أستراليا والصين وأيرلندا والمكسيك والبيرو والبرتغال وروسيا والولايات المتّحدة؛ وهذه الموارد الاحتياطية العالمية قابلة للاستخراج لأغراضٍ اقتصادية. بلغ مجموع الكمّيّات المستخرجة منه 88 مليون طن عام 2016 منها 35 مليون طن في أستراليا و17 مليون طن في الصين و6.4 مليون طن في روسيا.[73]
لا تتجاوز التركيزات النموذجية من الرصاص 0.1 ميكروغرام/م3 في الجوّ؛ و100 ملغم/كغ في التربة؛ في حين أن تركيزه في في المياه العذبة ومياه البحر حوال 5 ميكروغرام/لتر [74]
الاستخراج والإنتاج

إنّ الإنتاج العالمي من الرصاص (وفق بيانات سنة 2014) في ازدياد مستمرّ نتيجةً لاستخدامه بشكلٍ رئيسي في صناعة بطّاريات السيارات.[75] وفق تقدير مخزون الفلزّات في المجتمع الصادر سنة 2010 عن لجنة المصادر العالمية التابعة لبرنامج الأمم المتّحدة للبيئة فإنّ المجموع الكلي لكمّيّات الرصاص المستخدمة أو المخزّنة أو المطروحة أو المبدّدة هي 8 كغ لكلّ نسمة وسطياً على نطاق العالم؛ مع أخذ الفروقات بين الدول المتطوّرة (20–150 كغ لكلّ نسمة) والدول النامية (1–4 كغ لكلّ نسمة).[76]
عموماً يمكن تصنيف استخراج الرصاص حسب مصدر الحصول عليه إلى استخراج أوّلي من الخامات في القشرة الأرضية؛ وإلى استخراج ثانوي من تدوير الخردة. استُخرج سنة 2014 مقدار 4.58 مليون طنّ من الرصاص من مصادرَ أوّلية، مقابل 5.64 مليون طنّ من مصادر ثانوية؛ وكانت حينها الصين وأستراليا والولايات المتحدة هي الدول في صدارة الإنتاج العالمي بتعدين الرصاص،[73] في حين أنّ الصين والولايات المتّحدة والهند هي التي كانت في صدارة الدول بتدوير الرصاص.[77] إنّ عمليات إنتاج الرصاص الأوّلية والثانوية متشابهة؛ وتلجأ بعض منشآت تعدين الرصاص إلى مواءمة خطوط إنتاجها بحيث يمكن معالجة خردة الرصاص في عملياتها، خاصّةً أنّه في أغلب الأحيان وعند تطبيق تقنيات مناسبة يكون من الصعب التمييز بين الرصاص الناتج عن التعدين والرصاص الناتج عن التدوير. تحتاج بعض مصادر الرصاص الثانوية إلى عمليّات تنقية، وعندما لا تقتضي الحاجة لإعادة معالجة رصاص الخردة تنخفض التكاليف إلى أكثر من النصف، وخاصّةً عند المقارنة بالاحتياجات الطاقيّة اللازمة للعمليّات في أسلوب التعدين.[78]
عمليات التعدين

| البلد | الناتج (آلاف الأطنان) |
|---|---|
| 2,400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| دول أخرى | 170 |
من أكثر الخامات أهمّيّةً في تعدين الرصاص هو معدن غالينا، والذي غالباً ما يوجد على شكل معدن مرافق مع كبريتيدات الفلزّات الأخرى. إنّ معظم خامات الرصاص تحوي على نسبٍ قليلةٍ من الفلزّ، إذ أنّ أغناها به هي التي تحوي نمطياً على نسبة تتراوح بين 3–8%، ولذلك ينبغي إجراء عمليّات تركيز من أجل الاستخلاص. [79] في الخطوات الأولى من عمليّة التعدين تُسحَق الخامات وتُطحَن ثمّ تُفصَل وفق الكثافة وتُعوَّم ثمّ تُجفَّف. يحوي المركّز الناتج على نسبةٍ تصل في بعض الأحيان إلى 80% (نمطياً بين 50-60%) من الرصاص، [79] والذي يخضع إلى معالجة لاحقة للحصول على الرصاص (غير النقيّ)، وهناك أسلوبان رئيسيان لإجرائها؛ الأوّل منهما يعتمد على عملية ثنائية المرحلة تتضمّن عمليّة تحميص للمُركَّز الناتج في فرن صناعيّ، ثمّ استخراج للفلز في فرن لافح بعمليّة اختزال؛ أو بإجراء عمليّة مباشرة يتمّ فيها استخراج الرصاص من المُركَّز في فرن واحد؛ والعمليّة الأخيرة هي الأكثر شيوعاً.[80]
- العمليّة ثنائية المرحلة
تُجرَى أوّلاً عمليّة تحميص للمُرَكَّز الكبريتيدي لدرجات حرارة تفوق 1000 °س في الهواء وبوجود كمّيّة كافية من الأكسجين لأكسدة كبريتيد الرصاص الثنائي إلى أكسيد الرصاص الثنائي وثنائي أكسيد الكبريت:[81]
يمكن أن يُستخدَم غاز SO2 في تحضير حمض الكبريتيك؛ أمّا أكسيد الرصاص فيكون على شكل مصهور. بما أنّ المُرَكَّز الكبريتيدي ليس نقياً، لذلك تعطي عمليّة التحميص مزيجاً من أكاسيد وكبريتات وسيليكات لفلزّ الرصاص ولفلزّات أخرى موجودة في الخامة.[82] يلي ذلك إجراء عمليّة اختزال بفحم الكوك إلى الرصاص (غير النقيّ) بتفاعل من مرحلتين.[83]
في حال كانت الخامة الأوّلية غنيّة بالرصاص يمكن أن تُجرَى العمليّة السابقة بخطوة واحدة، وذلك بإجراء عمليّة تحميص غير كامل للخامة الكبريتيدية؛ ثمّ في مرحلةٍ لاحقة يُسخَّن مزيج أكسيد وكبريتيد الرصاص بوجود الهواء ممّا يسهم في اختزال القسم المتبقّي من PbS دون الحاجة إلى إضافة فحم الكوك:
- العمليّة المباشرة
في هذه العمليّة يُستحصَل على صَبّات الرصاص وعلى الخَبَث الناتج من العمليّات بشكلٍ مباشرٍ من مُرَكّز الرصاص. يُصهَر الرصاص في البداية في فرن ويُؤكسَد بواسطة تيّار من الأكسجين مشكّلاً أحادي أكسيد الرصاص؛ وبعد إضافة مسحوق فحم الكوك يُختزَل الأكسيد إلى فلزّ الرصاص وسط الخبث المتشكّل من الشوائب المرافقة.[80]
إذا كانت المادّة الأوّلية غنيّة المحتوى يمكن الحصول منها على مردود يصل إلى 80% على شكل صَبّات من فلزّ الرصاص، وتكون نسبة 20% المتبقيّة غنيّة بأكسيد الرصاص. أمّا إذا كانت المادّة الأوّلية فقيرة المحتوى، فيمكن أكسدة كلّ الرصاص إلى خبث مرتفع المحتوى، والذي يُختزَل لاحقاً إلى فلزّ الرصاص؛[80]
عمليّات التدوير
عادةً ما يتمّ تجاوز مرحلة الصهر في عمليّة تدوير الرصاص، ولا تُطبَّق إلّا عندما يكون الرصاص قد تأكسد بشكلٍ واضح.[78] بشكلٍ مشابه لعمليّات التعدين يُعالَج الرصاص في أفرانٍ مناسبة، والتي تعطي ناتجاً من الرصاص متفاوتاً في نسبة الشوائب وذلك حسب نوع الفرن؛ إذ أنّ الفرن اللافح يعطي رصاصاً قاسياً (يحوي على 10% إثمد)، في حين أنّ القَمينَ الدَوّار يعطي رصاصاً شبهَ طريٍّ (يحوي على 3-4% إثمد).[84]
يمكن أن يُستحصَل على الرصاص المُدوّر من بطّاريات السيارات كما هو الحال في عملية إساسميلت ISASMELT، والتي تعالِج عجينةَ الرصاص الحاوية على أكاسيد الرصاص حرارياً في قمين بعد إزالة الكبريتات بالقلوي للحصول على فلزّ الرصاص، والذي يكون غير نقيٍّ لاحتوائه على شوائب من الإثمد.[85] يمكن إجراء عمليّة تنقية لاحقة للرصاص، ولكن ذلك يعتمد على الكلفة وعلى درجة النقاوة المطلوبة وعلى نوع الشوائب الموجودة.[85] من المصادر الثانوية الأخرى للرصاص بالإضافة إلى البطاريات كلّ من الصفائح والأنابيب والكبلات المستخدمة في بعض الإنشاءات.[78]
التنقية
غالباً ما تكون الشوائب الموجودة هي من فلزّات الزرنيخ والإثمد والبزموت والزنك والنحاس والفضّة والذهب؛ والتي عادةً ما تزال بسلسلةٍ من المعالجات والعمليات الحرارية. يُعالَج المصهور في فرن عاكس مع الهواء والبخار والكبريت بوجود نترات الصوديوم/كربونات الصوديوم ممّا يؤكسد الشوائب عدا الذهب والفضة والبزموت. تزال تلك الشوائب المتأكسدة بقشطها على هيئة كدارة طافية على السطح؛[86][87] في حين أنّ شوائب النحاس والزنك تزال بالانفصال الحبيبي؛ أمّا الشوائب الثمينة من الفضّة والذهب فتزال وتستعاد وفق عملية باركس، التي تتضمّن إضافة الزنك إلى مصهور الرصاص لاستحصالهما، إذ أنّ الزنك لا يمتزج مع الرصاص، ممّا يُسهِّل من فصله على هيئة محلول جامد.[88][87] بعد ذلك، وللتخلّص من البزموت الموجود في الرصاص تُجرى عملية بترتون-كرول، التي تتضمّن المعالجة بالكالسيوم والمغنسيوم، ثمّ المعالجة الحرارية اللاحقة للتخلّص من خبث البزموت.[87]
يمكن أن تُجرى عملية التنقية بأسلوبٍ آخر مغاير للمعالجات الحرارية اعتماداً على أسلوب كهركيميائي لمصهور الرصاص بواسطة عملية بيتس. في تلك العمليّة يُغمَس مصعد من الرصاص المشوب ومهبط من الرصاص النقيّ في كهرل من سداسي فلوروسيليكات الرصاص PbSiF6؛ وعند تطبيق فرق الجهد الكهربائي المناسب ينحلّ الرصاص الموجود على المصعد، ويترسّب على المهبط تاركاً أغلب الشوائب في المحلول.[87][89] يَعيبُ تلك العمليّة كلفتها المرتفعة،[90] بسبب الحاجة إلى تطبيق جهد زائد في حوض التنقية؛ ولذلك لا تستخدم إلّا في تنقيّة صبّات الرصاص الحاوية على نسبٍ مرتفعة من الشوائب.[91]
النظائر
للرصاص الطبيعي أربعة نظائر مستقرّة لها الكتل الذرّية التالية: 204 و206 و207 و208؛[92] بالإضافة إلى آثار من خمس نظائر مشعّة قصيرة عمر النصف.[93] تتوزّع الوفرة الطبيعية لنظائر الرصاص المستقرّة بين 52.4% للنظير رصاص-208 208Pb وحوالي 22.1% للنظير رصاص-207 207Pb وحوالي 24.1% للنظير رصاص-206 206Pb، في حين يوجد النظير رصاص-204 204Pb بنسبة 1.4%.
يتوافق العدد الكبير من نظائر الرصاص مع حقيقة كون العدد الذرّي للرصاص زوجياً؛ إذ أنّ العدد الزوجي من الجسيمات دون الذرّية في النواة يرفع من استقرارها. يتميّز الرصاص بأنّ له عدد سحري من البروتونات (82)، ووفقاً لذلك فإنّ النواة تكون مستقرّة بشكل كبير حسب نظرية نموذج الغلاف النووي.[94] علاوةً على ذلك، فإنّ للرصاص-208 126 نيوتروناً، وهو عدد سحري آخر، وذلك يفسّر لِمَ لنظير الرصاص-208 استقرارية فوق العادة.[94] مع ارتفاع عدده الذرّي يكون الرصاص أثقل عنصر كيميائي تكون نظائره الطبيعية مستقرّة، إذ أنّ الرصاص-208 هو أثقل نظير مستقر (أصبح هذا الأمر حقيقةً بعد اكتشاف أنّ النظير الابتدائي البزموت-209 له نشاط إشعاعي.[95]).[96] يمكن لنظائر الرصاص الأربع المستقرّة أن تضمحّل نظرياً بنشاط إشعاعي عبر اضمحلال ألفا إلى نظائر الزئبق مع تَحرّر كمّيّة من الطاقة، إلّا أنّ ذلك لم يلاحظ على الإطلاق، وجرى تقدير عمر النصف لها بحوالي 1035 إلى 10189 سنة، [97] وهو ما يفوق العمر الحالي للكون.
توجد ثلاثة من نظائر الرصاص المستقرّة في ثلاث من سلاسل الاضمحلال الرئيسية؛ إذ أنّ الرصاص-206 والرصاص-207 والرصاص-208 هي المنتجات النهائية لاضمحلال اليورانيوم-238 (سلسلة اليروانيوم) واليورانيوم-235 (سلسلة الأكتينيوم) والثوريوم-232 (سلسلة الثوريوم) على الترتيب.[98][99] يعتمد تركيز نظائر الرصاص المذكورة في عيّنات الصخور الطبيعية بشكل كبير على وجود نظائر اليورانيوم والثوريوم؛ فعلى سبيل المثال يمكن أن تتراوح الوفرة النسبية لنظير الرصاص-208 من 52% في العيّنات العادية إلى 90% في خامات الثوريوم،[100] ولذلك السبب فإنّ الوزن الذرّي القياسي يعطى بدرجة عشريّة واحدة فقط.[101] مع مرور الزمن تزداد نسبة الرصاص-206 والرصاص-207 إلى الرصاص-204، وذلك لأنّ النظيرين الأوّلَين يوجدان في سلسلة اضمحلال العناصر المشعّة، في حين أنّ الأخيرَ ليس كذلك؛ ممّا يسمح في النهاية بتحديد العمر الجيولوجي للعيّنات باستخدام أسلوب تأريخ بنظائر رصاص-رصاص على سبيل المثال. من جهة أخرى، فإنّ اضمحلال اليورانيوم إلى الرصاص يمكّن من إجراء تأريخ بنظائر يورانيوم-رصاص.[102]

يتميّز النظير رصاص-207 بأنّ له رنين مغناطيسي نووي، وتلك خاصّية تساعد في دراسة مركّباته في المحاليل والحالة الصلبة،[103][104] وفي جسم الإنسان أيضاً.[105]
يوجد للرصاص نظائر نظائر مشعّة نادرة توجد بكمّيّات نزرة. من بين تلك النظائر هناك الرصاص-210، والذي يبلغ عمر النصف له 22.3 سنة؛[92] ولكن على الرغم من ذلك يوجد في الطبيعة إذ ينتج من سلسلة اضمحلال طويلة تبدأ من اليورانيوم-238. كما أنّ النظائر الرصاص-211 والرصاص-212 والرصاص-214 تنتج أيضاً في سلسلة اضمحلال اليورانيوم والثوريوم ولذلك توجد طبيعياً. يُحصَل على نسب ضئيلة من الرصاص-209 من الاضمحلال العنقودي نادر الحدوث للراديوم-223، وهو بدوره ناتج اضمحلال لليورانيوم-235؛ وكذلك أيضاً من سلسلة اضمحلال النبتونيوم-237، والذي يُستحصَل من عمليّة التقاط نيوترون في خامات اليورانيوم. تُستخدَم نظائر الرصاص المشعّة في عمليّات التأريخ، فيفيد قياس نسبة الرصاص-210 إلى الرصاص-206 مثلاً في معرفة عمر العيّنات.[106]
إجمالياً فهناك حوالي 43 نظير مشع مصطنع للرصاص تتراوح كتلها الذرية بين 178–220.[92] الرصاص-205 أكثر نظائر الرصاص المشعّة استقراراً، فعمر النصف له 1.5×107 سنة؛ يليه الرصاص-202 بعمر نصف مقداره 53 ألف سنة، وذلك بشكل أطول من أيّ نظير مشعّ طبيعي نزر للرصاص.[92]
الخواص الفيزيائية

يوجد الرصاص النقيّ في الحالة القياسية من الضغط ودرجة الحرارة على شكل فلزٍّ صلبٍ ذي لون فضّي برّاق مائل قليلاً إلى الزرقة؛[107] وهو من الفلزّات غير النبيلة، إذ عند التماس مع الهواء الرطب يفقد الرصاص بريقه ويصبح ذي مظهر باهت، وتعتمد صبغة اللون على الشروط المحيطة؛ وهو يترك خدشاً ذي لون رمادي مزرق على الورق؛ وكان يستعمل فيما مضى للكتابة ومن ذلك أتت تسمية قلم رصاص، والمستخدمة للآن رغم أنّ المادّة المستخدمة حالياً هي من الغرافيت. تبلغ قيمة كمون القطب الكهربائي للرصاص −0.13 فولت؛[108] وهو فلز ذي مغناطيسية معاكسة وهو قابل للسحب والطرق،[109] وله مقاومة للتآكل بسبب خاصّية التخميل.[110]
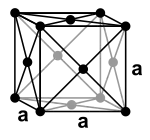
الرصاص من الفلزّات الثقيلة، إذ يتميّز بأنّه ذي كثافة مرتفعة، والتي تعود إلى البنية المتراصّة وفق النظام البلّوري المكعّب مركزيّ الوجوه، بالإضافة إلى الوزن الذرّي المرتفع.[111] تبلغ كثافة الرصاص مقدار 11.34 غ/سم3 وهي بذلك أكبر من كثافة الفلزّات الشائعة مثل الحديد (7.87 غ/سم3) والنحاس (8.93 غ/سم3) والزنك (7.14 غ/سم3).[112] هناك بعض الفلزّات النادرة ذات كثافة أعلى من الرصاص من ضمنها التنغستن والذهب (كلاهما ذي كثافة 19.3 غ/سم3) وكذلك الأوزميوم أكثر الفلزّات المعروفة كثافةً بمقدار (22.59 غ/سم3)، وهي قيمة تبلغ حوالي ضعف كثافة الرصاص.[113] تبلغ قيمة ثابت الشبكة في البنبة البلّورية المكعّبة للرصاص مقدار 0.4950 نانومتر (4.95 أنغستروم)؛[114] مع وجود 4 وحدات صيغة في كلّ وحدة خليّة.[115]
الرصاص النقيّ فلزّ طريّ، إذ تبلغ صلادته وفق مقياس موس 1.5، بحيث يمكن خدشه بظفر اليد.[116] تبلغ قيمة معامل الحجم للرصاص (وهي مقياس مدى قدرة المادّة على الانضغاط) 45.8 غيغاباسكال (GPa)؛ وللمقارنة فإنّ قيمتها بالنسبة للألومنيوم تبلغ 75.2 غيغاباسكال وللنحاس 137.8 غيغاباسكال، في حين أنّها للفولاذ الكربوني 160–169 غيغاباسكال.[117] تعدّ قيمة مقاومة الشدّ للرصاص منخفضة نسبياً (تتراوح بين 12–17 ميغاباسكال)، وهي أقلّ بستّ مرات من قيمتها للألومنيوم، وبعشر مرّات من النحاس، وبحوالي 15 مرّة من الفولاذ الكربوني. يمكن على العموم رفع قيمتها بالنسبة للرصاص عند إضافة كمّيّات صغيرة من النحاس أو الإثمد.
تبلغ نقطة انصهار الرصاص 327.5 °س،[118] وهي منخفضة نسبياً بالمقارنة مع باقي الفلزّات؛[111] أمّا نقطة الغليان فتبلغ 1749 °س [118] وقيمتها هي الأخفض من بين عناصر مجموعة الكربون. للرصاص مقاومية كهربائية 192 نانوأوم-متر، وهي بذلك أكبر بحوالي قيمة أسّيّة من قيمة مقاومية الفلزّات الصناعية المعروفة (النحاس: 15.43 والذهب 20.51 والألومنيوم 24.15).[119])؛ بالتالي فللرصاص موصلية كهربائية أقلّ من الفلزّات المذكورة، فقيمتها عند الرصاص 4.8 · 106 سيمنز/متر، في حين أنّها للفضّة 62 · 106 S/m على سبيل المثال.[120] الرصاص موصل فائق عند درجات حرارة أدنى من 7.19 كلفن،[121] وهي بذلك أعلى نقطة حرجة من بين الموصلات الفائقة من النمط الأول، وثالث أعلى قيمة من بين الموصلات الفائقة العنصرية.[122]
الخواص الكيميائية

تحوي ذرّة الرصاص على 82 إلكتروناً موزّعة على التشكيل التالي:Xe]4f145d106s26p2]. إنّ مجموع طاقتي التأيّن الأولى والثانية للرصاص مقارب في قيمته من القيمة المقابلة للقصدير، وهو العنصر الذي يعلو الرصاص في مجموعة الكربون، وهو أمرٌ غير اعتيادي، إذ أنّ طاقات التأيّن عادةً ما تتناقص نزولاً في مجموعات الجدول الدوري. يعود ذلك التقارب في قيم طاقات التأيّن بين عنصري القصدير والرصاص إلى ظاهرة الانكماش اللانثانيدي، وهو تناقص في قيمة نصف القطر الذرّي في دورة اللانثانيدات (من عنصر اللانثانوم ذي العدد الذري 57 إلى عنصر اللوتيشيوم ذي العدد الذري 71)، ومع وجود نصف قطر ذرّي صغير نسبياً من عنصر الهافنيوم (72) إلى نهاية الدورة)؛ وذلك بسبب الحجب الضعيف على نوى تلك العناصر من الإلكترونات 4f. تبدو تلك الظاهرة بشكل أوضح عند جمع طاقات التأيّن الأربع الأولى للعنصرين، حيث إنّ مجموعها أعلى في الرصاص من نظيره في القصدير.[123] يمكن تفسير تلك الظاهرة وفق مبادئ كيمياء الكم النسبية؛[124] مثل مبدأ تأثير الزوج الخامل، إذ أن الإلكترونات 6s في الرصاص صعبة التأيّن ولا تساهم في الترابط الكيميائي، وهذا السبب الذي يجعل المسافة بين ذرّات الرصاص في الشبكة البلورية كبيرة نسبياً.[125]
يكون لمجانسات الرصاص الخفيفة في مجموعة الكربون متآصلات مستقرّة أو شبه مستقرّة يكون لبعضها بنية الألماس المكعّبة ذات رابطة تساهمية رباعية السطوح، وذلك لأنّ مستويات الطاقة في المدارات الذرّية s وp متقاربة بشكل يسمح تهجينها إلى مدارات sp3؛ في حين أنّ تأثير الزوج الخامل في الرصاص يزيد المسافة بين المدارات s وp بحيث لا يمكن التغلّب على تلك الفجوة الطاقية.[126] بالمقابل فإنّ الرصاص فلزّ، وذلك يتوافق مع ازدياد الخواص الفلزّية للعناصر نزولاً في مجموعات الجدول الدوري؛[127] ولذلك فإنّ ذرّات الرصاص تترابط فيما بينها برابطة فلزّية تساهم فيها الإلكترونات p فقط غير المتمركزة والمتشارَكة بين أيونات الرصاص الثنائي 2+Pb؛ ووفقاً لذلك فإنّ البنية البلّورية للرصاص تكون حسب نظام مكعّب مركزيّ الوجوه،[128] وذلك بشكل مماثل للعناصر ثنائية التكافؤ القريبة في قياس الذرّة،[129] مثل الكالسيوم والسترونشيوم.[130]
يتأكسد الرصاص عند تعرّضه للهواء الرطب ويشكّل طبقة واقية ذات تركيب متفاوت تجمع بين أكاسيد الرصاص ومركّبات أخرى، من بينها كربونات الرصاص الثنائي (الإسفيداج)، والذي يعدّ أحد المكوّنات الشائعة لها؛[131][132][133] كما يمكن لكبريتات أو كلوريد الرصاص الثنائي أن تكون داخلةً في تركيب تلك الطبقة، وخاصّةً في التجهيزات المدنية أو البحرية.[134] تجعل تلك الطبقة من الرصاص خاملاً في الهواء؛[134] وبالمقابل فإنّ مسحوق الرصاص الناعم يشتعل تلقائياً،[135] وذلك بلهب أزرق باهت.[136]
يتفاعل الفلور مع الرصاص عند درجة حرارة الغرفة مشكّلاً فلوريد الرصاص الثنائي؛ في حين أنّ التفاعل مع الكلور يتطلّب تسخيناً، إذ أنّ دخول الكلوريد في تركيب الطبقة على الرصاص يقلّل من تفاعليته.[134] يتفاعل مصهور الرصاص مع الكالكوجينات (عناصر مجموعة الأكسجين) ليعطي كالكوجينيدات الرصاص الثنائي.[137]
يستطيع الرصاص الفلزّي مقاومة أثرَ حَمضَي الكبريتيك والفوسفوريك، ولكن ليس في حالة حمض النتريك، لأنّ ملح نترات الرصاص قابل للانحلال؛ إذ تعتمد نتيجة مقاومة الرصاص للانحلال في الحموض على عدم الانحلالية وعلى التخميل اللاحق للملح الناتج.[138] بالمقابل، تستطيع المحاليل القلويّة المركّزة أن تذيب الرصاص مشكّلةً بذلك أملاح الرصاصيت.[139]
المركّبات الكيميائية
للرصاص حالَتا أكسدة رئيسيتان، وهما +2 و+4؛[134] ويعود ذلك إلى تأثير الزوج الخامل؛ والذي يبرز بشكل واضح عند وجود فرق كبير في الكهرسلبية بين الرصاص وبين أنيونات الأكسيد أو الهاليد أو النتريد مسبّباً وجودَ شحنةٍ كهربائية جزئية موجبة ظاهرة على الرصاص. هناك فرق كبير نسبياً بين كهرسلبية الرصاص الثنائي (قيمتها 1.87) والرصاص الرباعي (قيمتها 2.33).[140] في حالة الفرق الكبير في الكهرسلبية يؤدّي تأثير الزوج الخامل إلى حدوث انكماش أكبر لمدار 6s في الرصاص أكثر ممّا هو الحال في مدار 6p؛ ممّا يجعل مساهمة الإلكترونات في المدار 6s غير مفضّلاً، ولذلك تكون السمة السائدة في مركّبات الرصاص الأيونية أنّها ثنائية التكافؤ. بالمقابل، فإنّ تأثير الزوج الخامل أقلّ تطبيقاً في مركّبات الرصاص التساهمية، حيث يتشارك الرصاص بالرابطة مع عناصر مقاربة في الكهرسلبية مثل الكربون في مركّبات الرصاص العضوية، والتي تكون فيها المدارات 6s و6p متقاربة، ممّا يتيح حدوث تهجين مداري على النمط sp3؛ إذ أنّ الرصاص كما الكربون يكون رباعي التكافؤ في تلك المركّبات.[141] يمكن للرصاص أن يشكّل سلسلة من ذرّات الرصاص المترابطة مع بعضها تساهمياً، وتلك خاصّيّة يتشارك بها مع مجانساته الأخفّ في مجموعة الكربون؛ إلّا أنّ مدى طول السلسلة أقصر بكثير مما تفعله باقي تلك العناصر، وذلك لأنّ طاقة الرابطة Pb–Pb أصغر بأكثر بثلاث مرّات من طاقة الرابطة C–C.[137] يمكن أن يصل طول سلسلة الرصاص إلى ثلاث ذرّات كحدّ أقصى.[142]
اللاعضوية
- الرصاص الثنائي
إنّ مركّبات الرصاص الثنائي هي السائدة في الكيمياء اللاعضوية لهذا العنصر؛ إذ أنّه حتى المؤكسدات القويّة مثل الفلور أو الكلور تتفاعل مع الرصاص لتعطي فقط هاليدات الرصاص الثنائي الموافقة PbF2 وPbCl2.[134] عادةً ما تكون أيونات الرصاص الثنائي عديمة اللون في محاليلها، [143] وهي ليست ذات صفة اختزالية مثلما هو الحال مع أيونات القصدير الثنائي؛ وهي تتحلمه جزئياً لتشكّل (+Pb(OH، ثمّ لاحقاً لتعطي في النهاية 4+[Pb4(OH)4] (والذي تشكّل فيه أيونات الهيدروكسيل ربيطات جسرية.[144][145])
يوجد أكسيد الرصاص الثنائي (أو أحادي أكسيد الرصاص) في الحالة الطبيعية على شكلين مختلفين؛ الأوّل يدعى «مرتك» (أو المرداسنج) وهو الشكل ألفا α-PbO من الأكسيد وهو ذو لون أحمر؛ أمّا الثاني فهو الشكل بيتّا β-PbO ويدعى «ماسيكوت» (أو الإسفيداج المكلس) وهو ذو لون أصفر. يعدّ الشكل ألفا (مرتك) الأكثر شيوعاً، إذ أنّ الشكل بيتّا (الماسيكوت) مستقرّ عند درجات حرارة تفوق 488 °س.[146]
لا يمكن عمليّاً الحصول على ملح هيدروكسيد الرصاص الثنائي Pb(OH)2؛ إذ يؤدّي رفع pH محاليل أملاح الرصاص الثنائي إلى حدوث تفاعل حلمهة؛[147] ويترسّب جرّاءَ ذلك ملح كربونات الرصاص القاعدية 2PbCO3·Pb(OH)2،[148] والمعروف باسم «أبيض الرصاص». أمّا كربونات الرصاص الثنائي (الإسفيداج) PbCO3 فهو مركّب معروف، ويدخل في تركيب الطبقة الواقية على الرصاص.
يشكّل الرصاص الثنائي مختلف أملاح الكالكوجينيد حتى الثقيلة منها؛ فمركّب كبريتيد الرصاص الثنائي PbS معروف، وهو من أشباه الموصلات وله ناقلية ضوئية، ويستخدم في تركيب مكاشيف الأشعّة تحت الحمراء الحسّاسة، ويوجد طبيعياً على شكل معدن غالينا؛ أمّا سيلينيد الرصاص PbSe وتيلوريد الرصاص PbTe فلها ناقلية ضوئية أيضاً، وتتميّز أنّها ذات درجات لونية فاتحة بخلاف العادة.[149]

إنّ هاليدات الرصاص الثنائي هي مركّبات معروفة ومدروسة الخواص، وهي تشمل أملاح الفلوريد PbF2 (والذي كان من أوّل المركّبات الأيونية التي اكتشفت فيها خواص الناقلية الأيونية من مايكل فاراداي سنة 1834.[150]) والكلوريد PbCl2 والبروميد PbBr2 واليوديد PbI2؛ وحتّى ملح الأستاتيد،[151] بالإضافة إلى المركّبات بين الهالوجينية مثل مركّب PbFCl الذي يستخدم في إحدى طرق التحليل الوزني للفلور. تتفكّك هاليدات الرصاص الثنائي عند التعرّض للأشعّة فوق البنفسجية، وخاصّةً ثنائي يوديد الرصاص.[152] للرصاص الثنائي قدرة جيّدة على تشكيل العديد من المعقّدات التناسقية مع أملاح الهاليدات مثل PbCl4]−2] و PbCl6]−4].[152] كذلك فإنّ مركّبات الهاليدات الزائفة للرصاص الثنائي معروفة، ومنها ملح الثيوسيانات Pb(SCN)2 على سبيل المثال.[149][153]
إنّ كبريتات الرصاص الثنائي PbSO4 غير منحلّة في الماء، مثلما هو الحال مع كبريتات كاتيونات الفلزّات الثقيلة ثنائية التكافؤ؛ بالمقابل فإنّ أملاح النترات Pb(NO3)2 ذات انحلالية جيّدة في الماء، ولذلك فإنّها تستخدم مخبرياً في تحضير مركّبات الرصاص الأخرى.[154]
من بين المركّبات الأخرى المعروفة للرصاص الثنائي كلّ من أملاح الفوسفات Pb3(PO4)2 والزرنيخات Pb3(AsO4)2 والزرنيخات الهيدروجينية PbHAsO4 والكرومات PbCrO4 والسيليكات PbSiO3 وسداسي فلورو السيليكات [Pb[SiF6 والبيركلورات Pb(ClO4)2 والسيلينات PbSeO4 والتيتانات PbTiO3 والتنغستات PbWO4 وكذلك الأزيد Pb(N3)2 بالإضافة إلى الأملاح المزدوجة مثل تيتانات زركونات الرصاص وغيرها.
- الرصاص الرباعي
من النادر وجود مركّبات لاعضوية للرصاص الرباعي، وهي تتشكّل فقط في أوساط المحاليل المؤكسدة القويّة، ولا توجد على شكل مركّبات صلبة في الشروط القياسية.[155] يمكن لأكسيد الرصاص الثنائي أن يتأكسد بشكل أكبر ممّا هو عليه، ولكن إلى أكسيد الرصاص الثنائي والرباعي 2PbO·PbO2 والذي يمكن كتابة صيغته على الشكل Pb3O4؛ وله لون أحمر فاقع، ويسمّى أحمر الرصاص. أمّا أكسيد الرصاص الرباعي PbO2 فهو ذو لون أسود؛ وهو مؤكسد قويّ، إذ بإمكانه أن يؤكسد الكلوريد في حمض الهيدروكلوريك إلى غاز الكلور،[156] وذلك لأنّ رباعي كلوريد الرصاص المفترض تشكّله غير مستقرّ، ويتفكّك تلقائياً إلى ثنائي كلوريد الرصاص PbCl2 وغاز الكلورCl2.[157] بشكلٍ مشابه لأكسيد الرصاص الثنائي الذي يشكّل أملاح الرصاصيت فإنّ أكسيد الرصاص الرباعي يشكّل أملاح الرصاصات، وذلك عند المعالجة بالقلويات.
من مركّبات الرصاص الرباعي اللاعضوية المستحصلة كلّ من كبريتيد الرصاص الرباعي (ثنائي كبريتيد الرصاص) PbS2، [158] وسيلينيد الرصاص الرباعي (ثنائي سيلينيد الرصاص)PbSe2،[159] المستقرّان عند ضغوط مرتفعة فقط. وهناك أيضاً فلوريد الرصاص الرباعي (رباعي فلوريد الرصاص) PbF4، وهو الهاليد الوحيد المستقرّ للرصاص الرباعي، رغم أنّه أقلّ استقراراً من ثنائي الفلوريد؛ أمّا باقي الهاليدات مثل كلوريد الرصاص الرباعي (رباعي كلوريد الرصاص) PbCl4 فهي غير مستقرّة وتتفكّك تلقائياً.[160]
- حالات أكسدة أخرى
يمكن الحصول على الرصاص الثلاثي (III) في بعض الحالات، وذلك في بعض معقّدات الرصاص العضوية التناسقية الضخمة، ولكنّها حالة غير مستقرّة، إذ توجد في العادة على شكل جذري وسرعان ما تتحوّل إلى إحدى حالتي الرصاص المستقرّة.[161][162][163] ينطبق الأمر ذاته على حالة أكسدة الرصاص الأحادية (I) والتي توجد فقط في المعقّدات الجذرية.[164]
يمكن الحصول على حالة أكسدة كسرية للرصاص في مزائجه الأكسدية فقط، فمثلاً يُستحصَل على الأكسيد الأحادي النصفي Pb2O3 عند ضغوط مرتفعة مع مزائج أكسيدية أخرى. كما يمكن في بعض الحالات الحصول على حالة أكسدة سالبة القيمة للرصاص، وذلك في مركّبات طور زنتل بين الفلزّية، مثل مركّب Ba2Pb الذي يكون فيه الرصاص نظرياً بحالة أكسدة -4؛[165] أو في بعض المعقّدات الأيونية العنقودية مثل 2−Pb5 التي لها بنية جزيئية هرمية مزدوجة ثلاثية، تكون فيها ذرّتا رصاص في حالة الأكسدة -1 والذرّات الثلاث المتبقية في حالة الأكسدة الصفرية الحرّة (0).[166] في أمثال تلك الأنيونات تكون كلّ ذرّة متموضعة على رأس المضلّع وتساهم بإلكترونين لكل رابطة تساهمية على الضلعين المجاورين من مدارات sp3، أمّا الإلكترونين الآخرَين فيبقيان على شكل زوج غير رابط.[144] يمكن الحصول على أمثال حالات الأكسدة السالبة للرصاص بالاختزال بواسطة الصوديوم في وسط من الأمونيا.[167]
العضوية
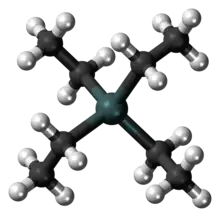
يشكّل الرصاص مع الكربون مركّبات عضوية فلزّية، وهي ذات استقرار أقلّ من المركّبات العضوية الشائعة،[168] وذلك بسبب ضعف الرابطة رصاص-كربون Pb–C؛[144] ممّا يجعل الكيمياء العضوية الفلزية للرصاص أقلّ أهمّيّة من نظيرتها في القصدير على سبيل المثال.[169] في مركّباته العضوية يكون الرصاص غالباً بحالة الأكسدة العليا +4، رغم وجود بعض مركّبات الرصاص الثنائي العضوية؛ ومن أمثلتها: أسيتات الرصاص الثنائي Pb(C2H3O2)2 (الذي كان يعرف سابقاً باسم سكّر الرصاص) وبلمبوسين Pb(η5-C5H5)2.[169] تمتلك مركّبات الرصاص العضوية لذلك صفة مؤكسدة، كما هو الحال مع أسيتات الرصاص الرباعي وهو كاشف مهمّ للأكسدة في تفاعلات الاصطناع العضوي.[170]
يستطيع الرصاص أن يناظر الكربون في تشكيله للميثان وذلك بمركّب البلومبان (رصاصان)، وهو رباعي هيدريد الرصاص PbH4، وهو غير مستقرّ ويمكن الحصول عليه نظرياً من مفاعلة الرصاص مع الهيدروجين بوجود حفّاز مناسب.[171] بالمقابل، فإنّ من أشهر مركّبات الرصاص العضوية المستقرّة كلّ من رباعي ميثيل الرصاص Pb(CH3)4 ورباعي إيثيل الرصاص Pb(C2H5)4، والتي لا تتفكّك إلا عند تعريضها للحرارة،[172] أو بتعريضها للأشعّة فوق البنفسجية؛[173] وكذلك مركّب رباعي فينيل الرصاص، الذي يتفكّك عند الدرجة 270 °س.[169] يمكن تشكيل مركّبات الرصاص العضوية من مفاعلة الرصاص أولاً مع الصوديوم، ثم بالمفاعلة مع هاليدات الألكيل في وسط مناسب.[174] وكان أكثرها تحضيراً مركّب رباعي إيثيل الرصاص،[169] إذ كان يستخدم ضمن الإضافات لوقود السيارات قبل منعه لسمّيّته. أمّا باقي مركّبات الرصاص العضوية فهي غير مستقرّة؛[168] والكثير منها لا يمكن تحضيره بالمقارنة مع العناصر الأخرى.[171]
التحليل الكيميائي
يمكن الكشف عن الرصاص إمّا باستخدام الأساليب التقليدية أو بوسائل التحليل الآلي الحديثة.
- الكشف عن الرصاص بالترسيب
يمكن الكشف عن أيونات الرصاص في المحاليل المائية بإجراء تفاعل ترسيب لأملاح الرصاص، ومن بين تفاعلات الكشف تلك تفاعل ترسيب الرصاص على شكل ملح يوديد الرصاص الثنائي أصفر اللون:
يمكن أن يُجرَى التفاعل مع أملاح أخرى للرصاص، مثل ملح كبريتيد الرصاص الثنائي أسود اللون،[175] أو ملح كرومات الرصاص أصفر اللون.[176]
- مطيافية الامتصاص الذري
تعدّ تقنية مطيافية الامتصاص الذري، إمّا عبر أنبوب الغرافيت أو الكوارتز، من أفضل الأساليب للكشف عن الكمّيّات النزرة القليلة من الرصاص؛ حيث يمكن أن يصل الحد الأدنى للكشف إلى 4.5 نانوغرام/مل. عادةً ما يُعالَج الرصاص مع بورهيدريد الصوديوم للحصول على هيدريد الرصاص الثنائي المتطاير، والذي يجمع في كويب مخبري ثم يُسخَّن كهربائياً إلى درجات حرارة تتجاوز 900 °س؛ وعندئذٍ تَتَذَرَّر العيّنة، ويمكن الكشف عن الرصاص حينها باستخدام مصباح المهبط المجوف، حيث يبدي الرصاص امتصاصية عند 283.3 نم. يمكن أن تُجرَى عمليّة التذرير باستخدام مزيج من شعلة مزيج من الهواء والأسيتيلين أو بلازما أشعّة الميكرويف.[177]
- مطيافية الانبعاث الذري
لإجراء التحاليل على عيّنات الرصاص باستخدام تقنية مطيافية الانبعاث الذري (AES) يتمّ في العادة استخدام البلازما، إمّا من بلازما أشعّة الميكروييف (MIP-AES) أو بلازما الآرغون المقترنة بالتحريض (ICP-AES). عادةً ما يتمّ الكشف عن الرصاص عند أطوال موجة 283.32 نم و405.78 نم. تكون مستويات حدّ الكشف في هذه التقنية منخفضة أيضاً؛ فعلى سبيل المثال جرى الكشف باستخدام MIP-AES عن أيونات ثلاثي ميثيل الرصاص +CH3)3Pb) بتراكيز دنيا وصلت إلى 0.19 بيكوغرام/غ؛[178] في حين أنّ استخدام أسلوب ICP-AES مكّن من تحليل آثار من الرصاص في مياه الشرب ذات تركيز مُتَدَنٍّ وصل إلى 15.3 نانوغرام/مل.[179][180]
- مطيافية الكتلة
يمكن استخدام التقنيات المختلفة في مطيافية الكتلة لتحليل آثار من الفلزّات باستخدام البلازما المقترنة بالتحريض مصدراً للأيونات، فعلى سبيل المثال يصل حدّ الكشف عن الرصاص في عيّنة بول إلى 4.2 بيكوغرام/غرام.[181]
- القياس الضوئي
تعدّ طريقة الديثيزون أكثر طرق الكشف عن الرصاص بواسطة القياس الضوئي شيوعاً. ديثيزون هو مركب عضوي عطري يستخدم ربيطةً ثنائية السن، ويشكّل مع أيونات الرصاص عند مجال pH يتراوح بين 9–11.5 معقّداً تناسقياً أحمر اللون له امتصاصية عند 520 نانومتر. من مشكلات هذا الأسلوب تداخل أيونات البزموت والثاليوم في التحليل، لذلك ينبغي ترسيبها أو استخلاصها أولاً.[182][183][184]
- القياس الفولتي
تستخدم تقنيات القياس الفولتي المختلفة في تحليل آثار الرصاص، وذلك بتراكيز دنيا من حدّ الكشف تصل إلى 50 بيكومول في اللتر.[185][186]
الأثر البيئي

إنّ استخراج وإنتاج واستخدام الرصاص والتخلّص منه ومن منتجاته عملياتٌ تسبّبت بتلوّث التربة والمياه. وقد بلغت انبعاثات الرصاص إلى الجوّ ذروتَها أثناء الثورة الصناعية، وفترة استخدام البنزين المحتوي على الرصاص في النصف الثاني من القرن العشرين. تنتج انبعاثات الرصاص من مصادر طبيعية (أي تركيز الرصاص الطبيعي) والإنتاج الصناعي والحرق وإعادة التدوير وإعادة استخراج الرصاص المدفون سابقاً.[187] ولا يزال تركيز الرصاص مرتفعاً في التربة والرواسب في المناطق الصناعية والحضرية؛ تتضمّن الانبعاثات الناتجة عن الصناعة حرق الفحم الحجري [188]، الذي لا يزال متّبعاً في العديد من مناطق العالم، تحديداً في الدول النامية.[189] يمكن أن يتراكم الرصاص في التربة، خاصّةً تلك ذات المحتوى العضوي المرتفع، حيث يتبقّى فيها لمئات بل آلاف السنين. ينافس الرصاص البيئي غيره من المعادن التي وجدت في أو على سطح النباتات، ما قد يمنع عملية التركيب الضوئي ويؤثّر سلباً على نموّ النبات وبقائه إن وجد بتركيزات عالية بما فيه الكفاية. يؤدّي تلوّث التربة والنباتات بالرصاص إلى دخوله السلسلة الغذائية، مما يؤثّر على الكائنات الحيّة الدقيقة والحيوانات.
إذا ابتُلع الرصاص من الحيوانات أو استُنشق أو امتصه الجلد، فإنه يسبّب سمّية في العديد من الأجهزة الحيوية، فيضرّ بالجهاز العصبي والكلى والتكاثر وتكوّن الدم وأنظمة القلب والأوعية الدموية [190] يتأثّر السمك بالرصاص من المياه والرواسب [191]، وبالتالي فإنّ التراكم الحيوي في السلسلة الغذائية يشكّل خطراً على الأسماك والطيور والثدييات البحرية.[192] يشمل الرصاص الاصطناعي ذلك المستخدم في طلقات الأسلحة وغطّاسات الصيد. وهذان من بين أقوى مصادر التلوّث بالرصاص إلى جانب مواقع إنتاج الرصاص .[193] تمّ حظر استخدام الرصاص في طلقات الأسلحة وغطّاسات الصيد في الولايات المتحدة عام [194]2017، [195] على الرغم من أنّ هذا الحظر استمرّ لمدّة شهر واحد فقط، كما يُدرس مثل هذا الحظر حالياً في الاتّحاد الأوروبي.[196] تتضمّن الطرق التحليلية المتّبعة لتقدير نسب الرصاص في البيئة استخدام قياس الضوء الطيفي وفلورية الأشعة السينية والمطيافية الذرية والكيمياء الكهربائية. ومن المقايسات الحيوية المهمّة للتسمّم بالرصاص فحص مستويات حمض أمينوليفولينيك في بلازما الدمّ والمصل والبول.[197]
القيود والمعالجة
حدث تحوّلٌ كبير في استخدام الرصاص بحلول منتصف ثمانينيات القرن الماضي. ففي الولايات المتحدة خفَّضَت اللوائح البيئية أو ألغت استخدام الرصاص في المنتجات غير المتعلّقة بالبطارية، بما في ذلك البنزين والدهانات وشبكات المياه. وأمكن استخدام أجهزة تحكّم الجسيمات في محطّات توليد الطاقة التي تعمل بالفحم من أجل التقاط انبعاثات الرصاص.[188]
الاستخدامات

الشكل الأوّلي العنصري
لمعدن الرصاص العديد من الخصائص الميكانيكية المفيدة، بما في ذلك الكثافة العالية، ونقطة الانصهار المنخفضة، والليونة، والخمول النسبي. تتفوّق العديد من المعادن على الرصاص في بعض هذه الخصائص، لكنّها أقلّ شيوعاً واستخراجها من خاماتها أكثر صعوبةً. ونظراً لسمّيّة الرصاص، فقد استبعد من بعض الصناعات والاستخدامات.[199]
استخدم معدن الرصاص في تصنيع طلقات الأسلحة منذ اختراعها في العصور الوسطى. نظراً لكونه غير مكلف ونقطة انصهاره منخفضة، فقد كان من المفضّل استخدامه لصنع ذخائر الأسلحة الصغيرة وقذائف الطلقات النارية الصغيرة بطريقة الصبّ وبمعدّات تقنية بسيطة؛ وذلك نظراً لكون كثافته أعلى من كثافة بعض المعادن الأخرى الشائعة، الأمر الذي ساعد في الحفاظ على تسارع المقذوفات. أمّا اليوم، فلا يزال الرصاص المادّة الأساسية لصناعة طلقات الأسلحة، ويستخدم لخلطه مع معادن أخرى لتصليبها.[37] أثيرت مخاوف من استخدام طلقات الرصاص في الصيد لمضارّها البيئية. لذا بدأت ولاية كاليفورنيا حظر استخدام طلقات الرصاص للصيد في تمّوز (يوليو) 2015.[200] يستخدم الرصاص في العديد من التطبيقات بفضل كثافته العالية ومقاومته للتآكل. فهو يستخدم في صناعة صابورة توازن القوارب الشراعية؛ إذ تتيح كثافته بالحدّ من مقاومة الماء، وبالتالي موازنة تأثير الرياح على الأشرعة. [201] كما يستخدم في التثقيل المتّبع في عمليات الغوص بجهاز التنفس المكتفي ذاتيا لمقاومة طفو الغطّاس.[202] عام 1993، تمّ تدعيم قاعدة برج بيزا المائل بحوالي 600 طنّ من الرصاص.[203] وبسبب مقاومته للتآكل، يُستخدم الرصاص كغمدٍ وقائي للكابلات تحت الماء.[204]
_07.jpg.webp)
للرصاص استخدامات عديدة في صناعات البناء والتشييد؛ تستخدم صفائح الرصاص في الإنشاءات، وذلك في مواد تدعيم الأسقف، والتصفيح والحشوات المعدنية المانعة للتسرّب وفي صناعة المزاريب ووصلاتها وفي حواجز الأسقف.[205][206] تستخدم قوالب الرصاص المفصّلة في قطع الزخرفة المستخدمة لإصلاح صفائح الرصاص. كما لا يزال مستخدماً لصناعة التماثيل والمنحوتات.[207] بما في ذلك دعامات التماثيل.[208] في الماضي، كان الرصاص يستخدم عادةً في موازنة الإطارات؛ لكن توقّف استخدامه لهذا الغرض لأسباب بيئية.[73]
يضاف الرصاص إلى سبائك النحاس، كالنحاس الأصفر والبرونز، لتحسين إمكانية استخدامها في صناعة المياكن. ولكونه غير قابل للذوبان في النحاس عملياً، يشكّل الرصاص كريّات صلبة في السبيكة على هيئة حدٍّ حُبَيبيّ وهذا من عيوبه. في التركيزات المنخفضة وعند استخدامه مادةَ تشحيم، تعوق الكريّات تشكيل الرايش أثناء عمل السبائك، وبالتالي تستخدم سبائك الرصاص ذي التركيزات الأكبر في صناعة المحامل. يوفّر الرصاص خاصّية التشحيم، ودعم المحامل.[209]
كثافة الرصاص العالية وعدده الذرّي وقابليته على التشكيل جعلت منه مادة أساسية لتصنيع الحواجز التي تمتصّ الصوت والاهتزازات والإشعاع.[210] ليس للرصاص تردّدات صدى طبيعية؛[210] نتيجةً لذلك، تستخدم صفائح الرصاص في تركيب طبقات لتخفيت الأصوات في الجدران والأرضيات والأسقف في الاستديوهات الصوتية.[211][211] تصنع أنابيب الأرغن من سبائك الرصاص عادةً وذلك بمزجها بكمّيّات مختلفة من القصدير للتحكّم في نغمة كلّ أنبوب.[212][213]الرصاص مادّة مهمّة في صناعة الدروع الواقية من الإشعاعات المؤيّنة في الفيزياء النووية وغرف التصوير بالأشعّة السينية[214] وذلك بسبب كثافته ومعامل امتصاصه المرتفع. [215] يستخدم الرصاصُ المصهور مادّةَ تبريد في المفاعلات السريعة بتبريد الرصاص.[216]
أكبر استخدامات الرصاص في أوائل القرن 21 هو "بطاريات الرصاص الحمضية". حيث توفّر التفاعلات في البطّارية بين الرصاص وثاني أكسيد الرصاص وحمض الكبريتيك مصدراً جيّداً للجهد الكهربائي.[217] تمّ تركيب المكثّفات الفائقة التي تتضمّن بطاريات الرصاص الحمضية في تطبيقات تعتمد مقاييس الكيلووات والميغاوايت في أستراليا واليابان والولايات المتحدة لتنظيم التردّدات وتحويل الطاقة الشمسية وتطويع الرياح وتطبيقات أخرى.[218] تتميّز هذه البطاريات بكثافة طاقة أقلّ وكفاءة أكبر في تفريغ الشحنات من بطاريات أيونات الليثيوم، لكنّها أرخص بكثير[219]
يستخدم الرصاص في كوابل الطاقة ذات الجهد العالي كمادّة تغليف لمنع انتشار المياه إلى العازل الكهربائي؛ إلّا أنّ استخدام الرصاص لهذا الغرض أصبح يتراجع تدريجياً.[220] كمّا أنّ استخدامه في سبائك لحام القصدير المستخدمة في الإلكترونيات تراجع في بعض الدول، وذلك بهدف تقليل كمّيّة النفايات الضارّة بالبيئة.[221] يعتبر الرصاص أحد ثلاثة معادن تستخدم في «اختبار أودي» المتّبع لفحص مواد المتاحف، التي تستخدم للكشف عن الأحماض العضوية والألدهيدات والغازات الحمضية.[222][223]
مركّباته
إضافةً لتطبيقات معدن الرصاص الرئيسية، تعتبر بطّاريات الرصاص الحمضي أكبر مستهلك لمركّبات الرصاص. إذ تستخدم تفاعلات التخزين وإلإطلاق مركّبات كبريتات الرصاص الثنائي وأكسيد الرصاص الرباعي:
(Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l
أمّا التطبيقات الأخرى لمركّبات الرصاص فمتخصّصة جدّاً وفي في طريقها للتلاشي. تستخدم عوامل التلوين التي يدخل الرصاص في تكوينها في تزجيج الخزف والزجاج، خاصّةً ظلال اللونين الأحمر والأصفر. [224] تمّ التخلّص من الألوان التي يدخل الرصاص في تكوينها في أوروبا وأمريكا الشمالية، لكنّها لا تزال مستخدمةً في الدول الأقلّ تقدّماً مثل الصين [225] والهند [226] وإندونيسيا. [227] تستخدم مركّبات رباعي أسيتيات الرصاص وثاني أكسيد الرصاص من العوامل المؤكسدة في الكيمياء العضوية. كما يستخدم الرصاص في طلاء الأسلاك الكهربائية مع كلوريد متعدد الفاينيل.[228][229] ويمكن استخدامه لمعالجة فتائل الشموع لضمان فترة احتراق أطول وأقوى. لكن وبسبب سمّيّته، يستخدم المصنّعون الأوروبيون والأمريكيون الشماليون الآن بدائل مثل الزنك. [230][231] يحتوي الزجاج الرصاصي على 12-28% أكسيد الرصاص الثنائي، الذي يعمل على تغيير خصائصه البصرية ويقلّل من انتقال الإشعاع المؤيّن.[232] تستخدم أشباه الموصلات القائمة على الرصاص مثل تيلوريد وسيلينيد الرصاص المستخدمان في خلايا الألواح الضوئية وأجهزة استكشاف الأشعة تحت الحمراء.[233]
المخاطر
لا يوجد للرصاص دورٌ حيوي مؤكّد، ولا يوجد مستوى أمان مؤكّد للتعرّض للرصاص.[234][235][236] خَلُصت دراسةٌ أجريت عام 2009 إلى أنّ "التعرّض لمستويات تعتبر آمنة بشكلٍ عام من الرصاص قد يؤدّي إلى نتائج سلبية على الصحّة العقلية".[237] متوسّط مستوى وجود الرصاص في جسم الإنسان البالغ حوالي 120 ميليغراماً،[238] ومن المعادن الثقيلة التي توجد بنسب أكبر في جسم الإنسان الزنك (2500 ميليغراماً) والحديد (4000 ميليغراماً) .[239] كما يتمّ امتصاص أملاح الرصاص بكفاءة عالية في جسم الإنسان .[240] تُخزَّن نسبة قليلة من الرصاص (أي 1% في العظام)؛ أمّا الكمّيّة الباقية فتفرَز مع البول والبراز في غضون أسابيع قليلة من دخولها للجسم. يؤدّي التعرّض المستمرّ إلى التراكم الحيوي للرصاص.[241]
السمّيّة
الرصاص معدنٌ سامّ للغاية (سواء أكان ذلك باستنشاقه أم بابتلاعه)، ما يؤثّر على كلّ أجهزة جسم الإنسان وأعضائه تقريباً.[242] في حال وصول التراكيز منه في الجوّ إلى مستويات تصل إلى 100 ملغم\م 3 فإنّها تعدّ ذات خطورة فورية للحياة أو الصحة.[243] معظم الرصاص الذي يتمّ ابتلاعه يُمتصّ إلى مجرى الدمّ.[244] السبب الرئيسي للسمّية هو ميله لتغيير أداء الإنزيمات. حيث يقوم بالارتباط بالثيولات الموجودة في العديد من الإنزيمات،[245] أو تقليد المعادن الأخرى التي تدخل عاملاً مرافقاً في العديد من التفاعلات الإنزيمية.[246] من بين المعادن الأساسية التي يتفاعل الرصاص معها الحديد والكالسيوم والزنك.[247] تميل المستويات العالية من الكالسيوم والحديد إلى توفير بعض الحماية ضد التسمّم بالرصاص؛ لكنّ المستويات المنخفضة منهما تسبّب زيادة في التعرّض لسمّيّة الرصاص.[240]
التأثيرات
يمكن أن يسبّب الرصاص أضرار بالغة للدماغ والكلى، الأمر الذي يؤدّي للموت في نهاية المطاف. يمكن أن يَعبُر الرصاص الحاجز الدموي الدماغي بتقليده عمل الكالسيوم. يعمل الرصاص على إتلاف أغمدة الميالين في العصبونات، ويقلّل عددها، كما يتداخل مع مسارات النواقل العصبية ويحدّ من نموّ الخلايا العصبية [245] في جسم الإنسان، يثبّط الرصاص إنزيم بورفوبيلينوجين سينثاز وإنزيم فيروكيلاتيز فيمنع تكوّن البورفوبيلينوجين ويمنع اندماج الحديد مع بروتوبورفيرين 9، وهي آخر خطوة في عمليّة تركيب الهيم. يسبّب هذا كلّه تخليقاً غيرَ فعّال للهيم وحدوثَ فقر الدم الجزئي.[248]
-ar.png.webp)
تتضمّن أعراض التسمّم بالرصاص اعتلال الكلى ومغص شبيه بآلام البطن وضعف في الأصابع والرسغين والكاحلين، وتحدث زيادة قليلة في ضغط الدم، لا سيّما لدى الأشخاص في منتصف العمر وكبار السن، لكن قد تكون الزيادة واضحة فتسبّب فقر الدم. وجدت العديد من الدراسات صلة وصلٍ بين زيادة التعرّض للرصاص وانخفاض معدّل ضربات القلب. أمّا في النساء الحوامل، فقد يؤدّي التعرّض للرصاص بمستوياتٍ مرتفعة إلى الإجهاض. أمّا التعرّض المزمن للرصاص بمستويات مرتفعة فيقلّل الخصوبة عند الذكور.[250] بالنسبة لدماغ الطفل في طور النمو، يتداخل الرصاص مع تكوين التشابك العصبي في القشرة المخّية وتطوّر الجهاز العصبي (بما في ذلك النواقل العصبية)، وتنظيم القنوات الأيونية.[251] يتسبّب التعرّض للرصاص في الطفولة المبكرة بزيادة مخاطر اضطرابات النوم، أمّا في مراحل الطفولة المتأخّرة فيسبّب النعاس المفرط في النهار.[252] كما ترتبط مستويات الدم المرتفعة بتأخّر سنّ البلوغ عند الفتيات.[253] في القرن العشرين، تمّ الربط بين تباين التعرّض للرصاص (ارتفاعاً وانخفاضاً) الموجود في الجوّ الناتج عن احتراق رباعي إيثيل الرصاص في البنزين وبين تباين معدّلات الجريمة ارتفاعاً وانخفاضاً، ويعرف ذلك باسم «فرضية الرصاص-الجريمة» التي لم تكن مقبولة عالمياً.[254]
مصادر التعرّض
أصبح التعرّض للرصاص مشكلةً عالمية منذ أن أصبح التعدين وصهر المعادن عمليّاتٍ صناعيةٍ رئيسيةٍ، بالإضافة إلى شيوع صناعة البطّاريات والتخلّص منها وإعادة تدويرها في العديد من دول العالم. يدخل الرصاص إلى الجسم عن طريق الاستنشاق أو الابتلاع أو امتصاص الجلد. الطريقة الأكثر شيوعاً هي استنشاق الرصاص إلى الجسم، أمّا بالنسبة للابتلاع فتتراوح نسبة حدوثه بين 20 - 70%، حيث يكون الأطفال أكثر عرضةً لابتلاع الرصاص من البالغين.[255][256]
ينتج التسمّم عادةً عند ابتلاع الطعام أو الماء الملوّث بالرصاص، أو ابتلاع تربة ملوّثة أو غبار أو طلاء يستخدم فيه الرصاص، وهي الحالات الأقلّ شيوعاً.[257] قد تحتوي منتجات مياه البحر على الرصاص إذا تعرّضت لتلوّث بالمياه الصناعية الناتجة عن المنشآت القريبة. [258] يمكن أن تتلوّث الفواكة والخضراوات أيضاً بمستويات عالية من الرصاص الموجود في التربة التي تزرع فيها. وتتلوّث التربة من تراكم الجزيئات التي مصدرها الأنابيب والطلاء والانبعاثات المتبقية من البنزين المحتوي على الرصاص.[259]
يعتبر استخدام الرصاص لتصنيع أنابيب المياه أمراً جدلياً، خاصّةَ في الدول التي فيها ماء يسر أو مياه حمضية. [260] يشكّل الماء العسر طبقةً غير قابلة للذوبان داخل الأنابيب؛ في حين يذيب الماء اليسر والماء الحمضي أنابيب الرصاص.[261] يؤدّي ثاني أكسيد الكربون الذائب في الماء المنقول بواسطة أنابيب مصنوعة من الرصاص إلى تكوين بيكربونات الرصاص القابلة للذوبان؛ قد يؤدّي الماء المشبَّع بالأكسجين إلى تذويب الرصاص على شكل هيدروكسيد الرصاص الثنائي. يمكن أن يسبب شرب هذه المياه، ومع مرور الوقت، مشاكل صحّيّة بسبب سمّيّة الرصاص المذاب. كلّما زاد محتوى الماء العسر من بيكربونات الكالسيوم وكبريتات الكالسيوم، كلّما زادت طبقة كربونات الرصاص وكبريتات الرصاص الواقية التي تتشكّل داخل الأنابيب.[262]
يعتبر دخول الدهانات المحتوية على الرصاص إلى الجسم المصدر الرئيسي للتعرّض بالنسبة للأطفال: من مصادر دخول الدهان إلى الجسم مضغ عتبات النوافذ القديمة المدهونة. أيضاً، عندما يبلى الدهان الجاف، فإنه يتقشّر ويتفتّت ويصبح بعضه غباراً، ثم يدخل إلى الجسم من خلال اليدين أو الطعام أو المشروبات الملوّثة. كما يؤدّي تناول بعض المواد التي تقدّم في الطب التقليدي إلى التعرّض لبعض مركّبات الرصاص.[263]
أمّا طريقة التعرّض الرئيسية الثانية فهي "الاستنشاق، حيث يتأثّر بهذه الطريقة العمّال الذين يعملون بمهنٍ ترتبط بالرصاص ومركّباته،[244] والمدخّنون، حيث يحتوي دخان السجائر على نظائر الرصاص الإشعاعية، بالإضافة للعديد من المواد السامّة الأخرى.[264]
قد يكون تعرّض الجلد للرصاص خطيراً بالنسبة للأشخاص الذين يعملون بمركّبات الرصاص العضوية، حيث أنّ معدّل امتصاص الجلد للرصاص غير العضوي يكون أقلّ.[265]
العلاج
يتضمّن علاج التسمّم بالرصاص عادةً استخدام ديمركابرول وسوكيمير[266] قد تتطلّب الحالات الحادّة استخدام إيديتات كالسيوم ثنائي الصوديوم والكالسيوم بطريقة الاستخلاب، وأملاح ثنائي أمين الإيثيلين رباعي حمض الأسيتيك EDTA. إذ تكوّن تآلفاً أكبر مع الرصاص من الكالسيوم، فينتج عن ذلك خُلابة الرصاص التي تُفرَز خارج الجسم مع البول تاركةً خلفها الكالسيوم غير المؤذي.[267]
في الحياة والثقافة العامة
في اللغة
- في اللغة العربية
يسمّى الرصاص في اللغة العربية أيضاً باسم الصَرَفان.[268] وأمّا الآنك هو: الأُسْرُبُّ. وهو: الرصاص القلعيُّ، أو القزدير، أو الرصاص الأبيض، وقيل: الأسود، وقيل هو: الخالص منه.[269]
- في اللغات الأجنبية
لكلمة «lead» في اللغة الإنجليزية أصلٌ يعود إلى الإنجليزية الوسطى من كلمة «leed»، والتي بدورها مشتقّة من الإنجليزية القديمة «lēad» (مع وجود علامة مكرون فوق حرف "e" للإشارة إلى مدّ الحرف).[270] أمّا الكلمة الإنجليزية القديمة فيفترض أنّها مشتقّة من اللغة الجرمانية البدائية «-lauda*»؛[271] والتي لا يوجد اتفاقٌ على أصلها اللغوي بين علماء اللسانيات. تقول إحدى الفرضيات أنّها مشتقّة من الهندية الأوروبية البدائية «-lAudh*»؛[272] في حين أنّ فرضية أخرى تقول أنّها مستعارة من الكلتية البدائية «-ɸloud-io*»، وهذه الكلمة لها صلة قرابة مع الكلمة اللاتينية «plumbum» التي أعطت العنصر رمزه الكيميائي Pb، كما أنّ كلمة «-ɸloud-io*» يعتقد أنها أصلُ كلمة «-bliwa*» الجرمانية البدائية، والتي هي أصل كلمة «Blei» في اللغة الألمانية (التي تعني رصاص).[273]
منذ العصر الكلاسيكي القديم ولفترات لاحقة (وصلت حتى إلى القرن السابع عشر) كان هناك خلطٌ بين عنصري القصدير والرصاص، ولذلك أصلٌ لغوي، فالرومان أسْمَوا الرصاص «plumbum nigrum» (رصاص أسود أو داكن)، في حين أنّهم أسموا القصدير «plumbum candidum» (رصاص ناصع). يمكن ملاحظة ذلك الترافق في لغات أخرى؛ فعلى سبيل المثال فإنّ كلمة «olovo» في اللغة التشيكية تعني «رصاص»، ولكن بالمقابل فإنّ اللفظ القريب «олово» (أولوفو) في اللغة الروسية يعني «قصدير».[274] وفي تداخل آخر يتمّ أحياناً الخلط بين الرصاص والإثمد؛ خاصّةً أنّ كلاً منهما يوجد على شكل معدن كبريتيدي (الغالينا والإستبنيت على الترتيب) وغالباً سويةً؛ ولذلك فقد أورد بلينيوس الأكبر وبشكلٍ خاطئ أنّ تسخين الاستيبنيت يعطي الرصاص بدل الإثمد.[275] ويمكن ملاحظة ذلك التداخل في بعض الدول مثل تركيا أو الهند حيث كلمة «surma» ذات الأصل الفارسي تشير إلى كبريتيد الإثمد أو كبريتيد الرصاص.[276] وفي بعض اللغات مثل الروسية فإنّ كلمة «сурьма» (سورما) تشير إلى عنصر الإثمد.[277]
في الثقافة العامة
- ينتشر تقليد صبّ الرصاص في عددٍ من الثقافات؛ ففي بعض المجتمعات العربية يشيع صب الرصاص لصدّ عين الحسد أو إبطال السحر.[278] بالمقابل يستخدم صبّ الرصاص في الماء البارد في بعض المجتمعات الغربية مثل ألمانيا لمعرفة الطالع، خاصّةً يوم عيد رأس السنة الميلادية.[279]
- خلافاً للاعتقاد الشائع، لا توجد مادّة الرصاص بتاتاً في أقلام الرصاص الخشبية. عندما صُنعَت أقلام الرصاص أداةً للكتابة من مادّة الغرافيت الملفوفة، كان نوع الغرافيت المستخدم آنذاك يعرف باسم "الرصاص الأسود plumbago" (ويعني الاسم حرفياً "تصرّف كالرصاص" أو "نموذج الرصاص").[280] كان الرصاص المعدني يترك أثراً على الألواح، ولذلك كان يستخدم في الكتابة؛ وعند اكتشاف الغرافيت واستخدامه لاحقاً في الكتابة وفي صناعة لب الأقلام بقيت النسبة للرصاص خطأً؛ رغم عدم احتواء قلم الرصاص على عنصر الرصاص، وهذا الخلط في التسمية موجود أيضاً في اللغة الألمانية (Bleistift) وفي اللغة الأيرلندية (peann luaidhe).
مراجع
- Lead sling bullet.
- Rich 1994، صفحة 4.
- Winder 1993b.
- History of Cosmetics.
- Toronto museum explores 2003.
- Yu & Yu 2004، صفحة 26.
- Bisson & Vogel 2000، صفحة 105.
- Rich 1994، صفحة 5.
- United States Geological Survey 1973.
- Hong et al. 1994، صفحات 1841–43.
- de Callataÿ 2005، صفحات 361–72.
- Ceccarelli 2013، صفحة 35.
- Ossuaries and Sarcophagi.
- Rich 1994، صفحة 6.
- Thornton, Rautiu & Brush 2001، صفحات 179–84.
- Bisel & Bisel 2002، صفحات 459–60.
- Retief & Cilliers 2006، صفحات 149–51.
- Lewis 1985، صفحة 15.
- Thornton, Rautiu & Brush 2001، صفحة 183.
- Eschnauer & Stoeppler 1992، صفحات 58.
- Grout 2017.
- Hodge 1981، صفحات 486–91.
- Gilfillan 1965، صفحات 53–60.
- Nriagu 1983، صفحات 660–63.
- Frankenburg 2014، صفحة 16.
- Scarborough 1984.
- Waldron 1985، صفحات 107–08.
- Reddy & Braun 2010، صفحة 1052.
- Delile et al. 2014، صفحات 6594–99.
- Kellett 2012، صفحات 106–07.
- Winder 1993a.
- Rich 1994، صفحة 7.
- Ede & Cormack 2016، صفحة 54.
- Rich 1994، صفحة 8.
- Samson 1885، صفحة 388.
- Sinha et al. 1993.
- Ramage 1980، صفحة 8.
- Tungate 2011، صفحة 14.
- Donnelly 2014، صفحات 171–172.
- Nakashima et al. 1998، صفحة 59.
- Ashikari 2003، صفحة 65.
- Rabinowitz 1995، صفحة 66.
- Gill & Libraries Board of South Australia 1974، صفحة 69.
- Lead mining.
- Rich 1994، صفحة 11.
- Riva et al. 2012، صفحات 11–16.
- Hernberg 2000، صفحات 246.
- Crow 2007.
- Markowitz & Rosner 2000، صفحة 37.
- More et al. 2017.
- American Geophysical Union 2017.
- Centers for Disease Control and Prevention 1997.
- Rich 1994، صفحة 117.
- United States Geological Survey 2005.
- Zhang et al. 2012، صفحات 2261–73.
- Lodders 2003، صفحات 1222–23.
- Roederer et al. 2009، صفحات 1963–80.
- Lochner, Rohrbach & Cochrane 2005، صفحة 12.
- Lodders 2003، صفحة 1224.
- Burbidge et al. 1957، صفحات 608–615.
- Burbidge et al. 1957، صفحة 551.
- Burbidge et al. 1957، صفحات 608–609.
- Burbidge et al. 1957، صفحة 553.
- Frebel 2015، صفحات 114–15.
- Burbidge et al. 1957، صفحات 608–610.
- Burbidge et al. 1957، صفحة 595.
- Burbidge et al. 1957، صفحة 596.
- Langmuir & Broecker 2012، صفحات 183–184.
- Davidson et al. 2014، صفحات 4–5.
- Emsley 2011، صفحات 286, passim.
- Cox 1997، صفحة 182.
- Davidson et al. 2014، صفحة 4.
- United States Geological Survey 2017، صفحة 97.
- Rieuwerts 2015، صفحة 225.
- Tolliday 2014.
- Graedel 2010.
- Guberman 2016، صفحات 42.14–15.
- Thornton, Rautiu & Brush 2001، صفحة 56.
- Davidson et al. 2014، صفحة 6.
- Davidson et al. 2014، صفحة 17.
- Thornton, Rautiu & Brush 2001، صفحة 51.
- Davidson et al. 2014، صفحات 11–12.
- Thornton, Rautiu & Brush 2001، صفحات 51–52.
- United States Environmental Protection Agency 2010، صفحة 1.
- Thornton, Rautiu & Brush 2001، صفحة 57.
- Davidson et al. 2014، صفحة 25.
- Primary Lead Refining.
- Pauling 1947.
- Davidson et al. 2014، صفحة 34.
- Thornton, Rautiu & Brush 2001، صفحات 52–53.
- Davidson et al. 2014، صفحة 23.
- IAEA - Nuclear Data Section 2017.
- University of California Nuclear Forensic Search Project.
- Stone 1997.
- Marcillac et al. 2003، صفحات 876–78.
- P. de Marcillac, N. Coron, G. Dambier, J. Leblanc, J.-P. Moalic: Experimental detection of α-particles from the radioactive decay of natural bismuth. In: Nature. 422, 2003, S. 876–878; doi:10.1038/nature01541.
- Beeman et al. 2013.
- Radioactive Decay Series 2012.
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials et al. 1999.
- Smirnov, Borisevich & Sulaberidze 2012.
- Greenwood & Earnshaw 1998، صفحة 368.
- Levin 2009، صفحات 40–41.
- Webb 2000، صفحة 115.
- Wrackmeyer & Horchler 1990.
- Cangelosi & Pecoraro 2015.
- Fiorini 2010، صفحات 7–8.
- Greenwood & Earnshaw 1998، صفحة 372.
- Michael Binnewies: Allgemeine und anorganische Chemie. Spektrum, Heidelberg 2004, ISBN 3-8274-0208-5.
- Anderson 1869، صفحات 341–43.
- Greenwood & Earnshaw 1998، صفحات 372–73.
- Thornton, Rautiu & Brush 2001، صفحة 6.
- Lide 2005، صفحات 12-35, 12-40.
- Lide 2005، صفحات 4-13, 4-21, 4-33.
- Ralph W. G. Wyckoff (1963)، Crystal Structures, Band 1 (PDF) (ط. 2.)، New York, London, Sydney: John Wiley & Sons، ص. 3، مؤرشف من الأصل (PDF) في 12 يوليو 2018
- Hugo Strunz, Ernest H. Nickel (2001)، Strunz Mineralogical Tables. Chemical-structural Mineral Classification System (ط. 9.)، Stuttgart: E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller)، ص. 35، ISBN 3-510-65188-X
- Vogel & Achilles 2013، صفحة 8.
- Gale & Totemeier 2003، صفحات 15–2–15–3.
- Lide 2005، صفحة 12-219.
- Lide 2005، صفحة 12-45.
-
A. F. Holleman, E. Wiberg, N. Wiberg (1995)، Lehrbuch der Anorganischen Chemie (ط. 101)، Berlin: de Gruyter، ISBN 3-11-012641-9
{{استشهاد}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Blakemore 1985، صفحة 272.
- Webb, Marsiglio & Hirsch 2015.
- Lide 2005، صفحة 10-179.
- Pyykkö 1988، صفحات 563–94.
- Norman 1996، صفحة 36.
- Greenwood & Earnshaw 1998، صفحات 226–27, 374.
- Parthé 1964، صفحة 13.
- Christensen 2002، صفحة 867.
- Slater 1964.
- Considine & Considine 2013، صفحات 501, 2970.
- Thürmer, Williams & Reutt-Robey 2002، صفحات 2033–35.
- Tétreault, Sirois & Stamatopoulou 1998، صفحات 17–32.
- Thornton, Rautiu & Brush 2001، صفحات 10–11.
- Greenwood & Earnshaw 1998، صفحة 373.
- Bretherick 2016، صفحة 1442.
- Harbison, Bourgeois & Johnson 2015، صفحة 132.
- Greenwood & Earnshaw 1998، صفحة 374.
- Thornton, Rautiu & Brush 2001، صفحات 11–12.
- Polyanskiy 1986، صفحة 20.
- Dieter & Watson 2009، صفحة 509.
- Kaupp 2014، صفحات 9–10.
- Stabenow, Saak & Weidenbruch 2003.
- Hunt 2014، صفحة 215.
- King 1995، صفحات 43–63.
- Bunker & Casey 2016، صفحة 89.
- Greenwood & Earnshaw 1998، صفحة 384.
- Greenwood & Earnshaw 1998، صفحة 387.
- Inorganic Chemistry,Egon Wiberg, Arnold Frederick Holleman Elsevier 2001 (ردمك 0-12-352651-5)
- Greenwood & Earnshaw 1998، صفحة 389.
- Funke 2013.
- Zuckerman & Hagen 1989، صفحة 426.
- Greenwood & Earnshaw 1998، صفحة 382.
- Bharara & Atwood 2006، صفحة 4.
- Greenwood & Earnshaw 1998، صفحة 388.
- Toxicological Profile for Lead 2007، صفحة 277.
- Downs & Adams 2017، صفحة 1128.
- Brescia 2012، صفحة 234.
- Macintyre 1992، صفحة 3775.
- Silverman 1966، صفحات 2067–69.
- Greenwood & Earnshaw 1998، صفحة 381.
- Becker et al. 2008، صفحات 9965–78.
- Mosseri, Henglein & Janata 1990، صفحات 2722–26.
- Konu & Chivers 2011، صفحة 391–92.
- Hadlington 2017، صفحة 59.
- Röhr 2017.
- Alsfasser 2007، صفحات 261–63.
- Greenwood & Earnshaw 1998، صفحة 393.
- Polyanskiy 1986، صفحة 43.
- Greenwood & Earnshaw 1998، صفحة 404.
- Zýka 1966، صفحة 569.
- Wiberg, Wiberg & Holleman 2001، صفحة 918.
- Toxicological Profile for Lead 2007، صفحة 287.
- Polyanskiy 1986، صفحة 44.
- Windholz 1976.
- Whitten, Gailey & David 1996، صفحات 904–5.
- G. Jander, E. Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 16. Auflage. S. Hirzel-Verlag, Stuttgart 2005, ISBN 3-7776-1388-6, S. 533, 472, 540–541.
- N. Maleki, A. Safavi, Z. Ramezani: Determination of lead by hydride generation atomic absorption spectrometry (HGAAS) using a solid medium for generating hydride. In: J Anal At Spectrom. 14, 1999, S. 1227–1230; doi:10.1039/A808429G.
- M. Heisterkamp, F. Adams: In situ propylation using sodium tetrapropylborate as a fast and simplified sample preparation for the speciation analysis of organolead compounds using GC-MIP-AES. In: J. Anal. At. Spectrom. 14, 1999, S. 1307–1311; doi:10.1039/A901340G.
- M. Zougagh, A. Garcia de Torres, E. Alonso, J. Pavon: Automatic on line preconcentration and determination of lead in water by ICP-AES using a TS-microcolumn. In: Talanta. 62, 2004, S. 503–510; doi:10.1016/j.talanta.2003.08.033.
- Z. Chen, N. Zhang, L. Zhuo, B. Tang: Catalytic kinetic methods for photometric or fluorometric determination of heavy metal ions. In: Microchim Acta. 164, 2009, S. 311–336; doi:10.1007/s00604-008-0048-8.
- A. Townsend, K. Miller, St. McLean, St. Aldous: The determination of copper, zinc, cadmium and lead in urine by high resolution ICP-MS. In: J. Anal. At. Spectrom. 13, 1998, S. 1213–1219; doi:10.1039/A805021J.
- R. Lobinski, Z. Marczenko: Spectrochemical Trace Analysis for Metals and Metalloids. Elsevier 1997, ISBN 0-444-82879-6.
- I. Oehme, O. S. Wolfbeis: Optical Sensors for Determination of Heavy Metal Ions. In: Microchim. Acta. 126, 1997, S. 177–192; doi:10.1007/BF01242319.
- B. Lange, Z. J. Vejdelek: Photometrische Analyse. Verlag Chemie, Weinheim 1980.
- Y. Bonfil, E. Kirowas-Eisner: Determination of nanomolar concentrations of lead and cadmium by anodic-stripping voltammetry at a silver electrode. In: Anal. Chim. Acta. 457, 2002, S. 285–296;
- J. Wang: Stripping Analysis at Bismuth Electrodes: A Review. In: Electroanalysis. 17, 2005, S. 1341–1346; doi:10.1002/elan.200403270.
- United Nations Environment Programme 2010، صفحة 4.
- Trace element emission 2012.
- United Nations Environment Programme 2010، صفحة 6.
- Assi et al. 2016.
- World Health Organization 1995.
- UK Marine SACs Project 1999.
- United Nations Environment Programme 2010، صفحة 9.
- McCoy 2017.
- Cama 2017.
- Layton 2017.
- Lauwerys & Hoet 2001، صفحات 115, 116–117.
- Street & Alexander 1998، صفحة 181.
- Baird & Cann 2012، صفحات 537–38, 543–47.
- California Department of Fish and Wildlife.
- Parker 2005، صفحات 194–95.
- Krestovnikoff & Halls 2006، صفحة 70.
- Street & Alexander 1998، صفحة 182.
- Jensen 2013، صفحة 136.
- Think Lead research.
- Weatherings to Parapets.
- Lead garden ornaments 2016.
- Putnam 2003، صفحة 216.
- Copper Development Association.
- Rich 1994، صفحة 101.
- Guruswamy 2000، صفحة 31.
- Audsley 1965، صفحات 250–51.
- Palmieri 2006، صفحات 412–13.
- National Council on Radiation Protection and Measurements 2004، صفحات 16.
- Thornton, Rautiu & Brush 2001، صفحة 7.
- Tuček, Carlsson & Wider 2006، صفحة 1590.
- Progressive Dynamics, Inc.
- Olinsky-Paul 2013.
- Gulbinska 2014.
- Rich 1994، صفحات 133–34.
- Zhao 2008، صفحة 440.
- Beiner et al. 2015.
- Szczepanowska 2013، صفحات 84–85.
- Burleson 2001، صفحات 23.
- Insight Explorer & IPEN 2016.
- Singh 2017.
- Ismawati et al. 2013، صفحة 2.
- Zweifel 2009، صفحة 438.
- Wilkes et al. 2005، صفحة 106.
- Randerson 2002.
- Nriagu & Kim 2000، صفحات 37–41.
- Amstock 1997، صفحات 116–19.
- Rogalski 2010، صفحات 485–541.
- Emsley 2011، صفحة 280.
- Lead poisoning and health نسخة محفوظة 07 يناير 2019 على موقع واي باك مشين.
- (PDF) https://web.archive.org/web/20181021145244/http://www.who.int/ipcs/lead_campaign/WHO-Lead-Exposure_Adapted-Map-Proof_English.pdf، مؤرشف من الأصل (PDF) في 21 أكتوبر 2018.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - Bouchard؛ Bellinger؛ Weuve؛ Matthews-Bellinger؛ Gilman؛ Wright؛ Schwartz؛ Weisskopf (1 ديسمبر 2009)، "Blood lead levels and major depressive disorder, panic disorder, and generalized anxiety disorder in U.S. young adults"، Archives of general psychiatry، 66 (12): 1313–1319، doi:10.1001/archgenpsychiatry.2009.164، PMC 2917196، PMID 19996036، مؤرشف من الأصل في 27 أبريل 2019.
{{استشهاد بدورية محكمة}}: صيانة CS1: تنسيق PMC (link) - World Health Organization 2000، صفحات 149–53.
- Emsley 2011، صفحة 280, 621, 255.
- Luckey & Venugopal 1979، صفحات 177–78.
- Toxic Substances Portal.
- United States Food and Drug Administration 2015، صفحة 42.
- National Institute for Occupational Safety and Health.
- Occupational Safety and Health Administration.
- Rudolph et al. 2003، صفحة 369.
- Dart, Hurlbut & Boyer-Hassen 2004، صفحة 1426.
- Kosnett 2006، صفحة 238.
- Cohen, Trotzky & Pincus 1981، صفحات 904–06.
- Sokol 2005، صفحة 133, passim.
- Mycyk, Hryhorczuk & Amitai 2005، صفحة 462.
- Liu et al. 2015، صفحات 1869–74.
- Schoeters et al. 2008، صفحات 168–75.
- Casciani 2014.
- Tarragó 2012، صفحة 16.
- «الرصاص» خطر يهدد صحة الأطفال بأمراض خطيرة نسخة محفوظة 12 فبراير 2019 على موقع واي باك مشين. [وصلة مكسورة]
- Toxicological Profile for Lead 2007، صفحة 4.
- Bremner 2002، صفحة 101.
- Agency for Toxic Substances and Disease Registry.
- Thornton, Rautiu & Brush 2001، صفحة 17.
- Moore 1977، صفحات 109–15.
- Wiberg, Wiberg & Holleman 2001، صفحة 914.
- Tarragó 2012، صفحة 11.
- Centers for Disease Control and Prevention 2015.
- Wani, Ara & Usman 2015، صفحات 57, 58.
- Prasad 2010، صفحات 651–52.
- Masters, Trevor & Katzung 2008، صفحات 481–83.
- لسان العرب، باب صرف
- إسلام ويب نسخة محفوظة 24 مارس 2018 على موقع واي باك مشين.
- Merriam-Webster.
- Kroonen 2013، *lauda-.
- Nikolayev 2012.
- Kroonen 2013، *bliwa- 2.
- Polyanskiy 1986، صفحة 8.
- Thomson 1830، صفحة 74.
- Oxford English Dictionary، surma.
- Vasmer 1950، сурьма.
- فاديا عازار (13 مارس 2010)، "عين الحسود لها علاجها.... الاعتقاد بـ"صيبة العين" ظاهرة لا تزال موجودة في المجتمع اللبناني"، موقع الهدهد، مؤرشف من الأصل في 4 يوليو 2019، اطلع عليه بتاريخ فبراير 2019.
{{استشهاد بخبر}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - البيان الإلكتروني (21 ديسمبر 2018)، "كيف تحتفل الدول الأوروبية بحلول السنة الجديدة؟"، جريدة البيان، مؤرشف من الأصل في 6 أغسطس 2019، اطلع عليه بتاريخ فبراير 2019.
{{استشهاد بخبر}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Evans 1908، صفحات 133–79.
المصادر مرتبة أبجدياً
- Acton, Q. A., المحرر (2013)، Issues in Global Environment—Pollution and Waste Management: 2012 Edition، ScholarlyEditions، ISBN 978-1-4816-4665-9، مؤرشف من الأصل في 08 يوليو 2019.
- Agency for Toxic Substances and Disease Registry، "Information for the Community: Lead Toxicity" (MP4 webcast, 82 MB)، مؤرشف من الأصل في 06 أغسطس 2019، اطلع عليه بتاريخ 11 فبراير 2017.
{{استشهاد ويب}}: صيانة CS1: ref duplicates default (link) - Agency for Toxic Substances and Disease Registry (2017)، "Lead Toxicity. What Are U.S. Standards for Lead Levels?"، مؤرشف من الأصل في 12 مارس 2020، اطلع عليه بتاريخ 12 يونيو 2018.
- Alsfasser, R. (2007)، Moderne anorganische Chemie [Modern inorganic chemistry] (باللغة الألمانية)، Walter de Gruyter، ISBN 978-3-11-019060-1، مؤرشف من الأصل في 12 مارس 2020.
- American Geophysical Union (2017)، "Human Activity Has Polluted European Air for 2000 Years"، Eos Science News، مؤرشف من الأصل في 14 سبتمبر 2019.
- Amstock, J. S. (1997)، Handbook of Glass in Construction، McGraw-Hill Professional، ISBN 978-0-07-001619-4، مؤرشف من الأصل في 27 مارس 2020.
- Anderson, J. (1869)، "Malleability and ductility of metals"، Scientific American، 21 (22): 341–43، doi:10.1038/scientificamerican11271869-341، مؤرشف من الأصل في 28 سبتمبر 2018.
- Ashikari (2003)، "The memory of the women's white faces: Japaneseness and the ideal image of women"، Japan Forum، 15 (1): 55–79، doi:10.1080/0955580032000077739.
- Assi؛ Hezmee؛ Haron؛ وآخرون (2016)، "The detrimental effects of lead on human and animal health"، Veterinary World، 9 (6): 660–671، doi:10.14202/vetworld.2016.660-671، ISSN 0972-8988، PMC 4937060، PMID 27397992.
- Auer؛ Kover؛ Aidala؛ Greenwood (1 مارس 2016)، Toxic Substances: A Half Century of Progress (PDF) (Report)، EPA Alumni Association، مؤرشف من الأصل (PDF) في 04 نوفمبر 2019، اطلع عليه بتاريخ 1 يناير 2019.
- Audsley, G. A. (1965)، The Art of Organ Building، Courier، ج. 2، ISBN 978-0-486-21315-6، مؤرشف من الأصل في 12 مارس 2020.
- Baird؛ Cann (2012)، Environmental Chemistry (ط. 5th)، W. H. Freeman and Company، ISBN 978-1-4292-7704-4.
- Becker؛ Förster؛ Franzen؛ وآخرون (2008)، "Persistent radicals of trivalent tin and lead"، Inorganic Chemistry، 47 (21): 9965–78، doi:10.1021/ic801198p، PMID 18823115.
- Beeman؛ Bellini؛ Cardani؛ وآخرون (2013)، "New experimental limits on the α decays of lead isotopes"، European Physical Journal A، 49 (50): 50، arXiv:1212.2422، Bibcode:2013EPJA...49...50B، doi:10.1140/epja/i2013-13050-7.
- Beiner؛ Lavi؛ Seri؛ وآخرون (2015)، "Oddy Tests: Adding the Analytical Dimension"، Collection Forum، 29 (1–2): 22–36، doi:10.14351/0831-4985-29.1.22، ISSN 0831-4985.
- Bharara؛ Atwood (2006)، "Lead: Inorganic ChemistryBased in part on the article Lead: Inorganic Chemistry by Philip G. Harrison which appeared in theEncyclopedia of Inorganic Chemistry, First Edition"، Lead: Inorganic Chemistry، doi:10.1002/0470862106.ia118، ISBN 978-0470860786.
- Bisel؛ Bisel (2002)، "Health and nutrition at Herculaneum"، في Jashemski, W. F.؛ Meyer, F. G. (المحررون)، The Natural History of Pompeii، Cambridge University Press، ص. 451–75، ISBN 978-0-521-80054-9.
- Bisson؛ Vogel (2000)، Ancient African Metallurgy: The Sociocultural Context، Rowman & Littlefield، ISBN 978-0-7425-0261-1، مؤرشف من الأصل في 12 مارس 2020.
- Blakemore, J. S. (1985)، Solid State Physics، Cambridge University Press، ISBN 978-0-521-31391-9، مؤرشف من الأصل في 07 يوليو 2019.
- Burleson, M. (2001)، The Ceramic Glaze Handbook: Materials, Techniques, Formulas، New York, NY: Sterling Publishing، ISBN 9781579904395، مؤرشف من الأصل في 12 مارس 2020.
- Bremner, H. A. (2002)، Safety and Quality Issues in Fish Processing، Elsevier، ISBN 978-1-85573-678-8، مؤرشف من الأصل في 10 مارس 2020.
- Brenner (2003)، Webster's New World American Idioms Handbook، John Wiley & Sons، ISBN 978-0-7645-2477-6.
- Brescia, F. (2012)، Fundamentals of Chemistry: A Modern Introduction، Elsevier، ISBN 978-0-323-14231-1، مؤرشف من الأصل في 12 مارس 2020.
- Bretherick, L. (2016)، Bretherick's Handbook of Reactive Chemical Hazards، Elsevier، ISBN 978-1-4831-6250-8، مؤرشف من الأصل في 08 يوليو 2019.
- Bunker؛ Casey (2016)، The Aqueous Chemistry of Oxides، Oxford University Press، ISBN 978-0-19-938425-9، مؤرشف من الأصل في 12 مارس 2020.
- Burbidge؛ Burbidge؛ Fowler؛ وآخرون (1957)، "Synthesis of the Elements in Stars" (PDF)، Reviews of Modern Physics، 29 (4): 547–654، Bibcode:1957RvMP...29..547B، doi:10.1103/RevModPhys.29.547، مؤرشف من الأصل (PDF) في 24 يونيو 2016.
- California Department of Fish and Wildlife، "Nonlead Ammunition in California"، www.wildlife.ca.gov، مؤرشف من الأصل في 08 مارس 2020، اطلع عليه بتاريخ 17 مايو 2017.
- de Callataÿ, F. (2005)، "The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks"، Journal of Roman Archaeology، 18: 361–72، doi:10.1017/S104775940000742X.
- Cama, T. (2017)، "Interior secretary repeals ban on lead bullets"، The Hill، مؤرشف من الأصل في 09 مارس 2020، اطلع عليه بتاريخ 30 مايو 2018.
- Cangelosi؛ Pecoraro (2015)، "Lead"، في Roduner, E. (المحرر)، Nanoscopic Materials: Size-Dependent Phenomena and Growth Principles، Royal Society of Chemistry، ص. 843–875، ISBN 978-1-78262-494-3.
- Casciani, D. (2014)، "Did removing lead from petrol spark a decline in crime?"، BBC News، مؤرشف من الأصل في 03 مارس 2020، اطلع عليه بتاريخ 30 يناير 2017.
- Ceccarelli, P. (2013)، Ancient Greek Letter Writing: A Cultural History (600 BC- 150 BC)، OUP Oxford، ISBN 978-0-19-967559-3، مؤرشف من الأصل في 12 مارس 2020.
- Centers for Disease Control and Prevention (1997)، "Update: blood lead levels--United States, 1991-1994"، Morbidity and Mortality Weekly Report، 46 (7): 141–146، ISSN 0149-2195، PMID 9072671.
{{استشهاد بدورية محكمة}}: صيانة CS1: ref duplicates default (link) - Centers for Disease Control and Prevention (2015)، "Radiation and Your Health"، مؤرشف من الأصل في 10 مارس 2020، اطلع عليه بتاريخ 28 فبراير 2017.
{{استشهاد ويب}}: صيانة CS1: ref duplicates default (link) - Christensen, N. E. (2002)، "Relativistic Solid State Theory"، في Schwerdtfeger, P. (المحرر)، Relativistic Electronic Structure Theory — Fundamentals، Theoretical and Computational Chemistry، Elsevier، ج. 11، ص. 867–68، doi:10.1016/s1380-7323(02)80041-3، ISBN 978-0-08-054046-7.
- Cohen؛ Trotzky؛ Pincus (1981)، "Reassessment of the Microcytic Anemia of Lead Poisoning"، Pediatrics، 67 (6): 904–906، PMID 7232054، مؤرشف من الأصل في 25 يوليو 2013.
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials؛ Commission on Life Sciences؛ Division on Earth and Life Studies؛ National Research Council (1999)، Evaluation of Guidelines for Exposures to Technologically Enhanced Naturally Occurring Radioactive Materials، National Academies Press، ص. 26, 30–32، ISBN 978-0-309-58070-0، مؤرشف من الأصل في 12 مارس 2020.
- Considine؛ Considine (2013)، Van Nostrand's Scientific Encyclopedia، Springer Science & Business Media، ISBN 978-1-4757-6918-0، مؤرشف من الأصل في 12 مارس 2020.
- Copper Development Association، "Leaded Coppers"، copper.org، مؤرشف من الأصل في 20 يوليو 2019، اطلع عليه بتاريخ 10 يوليو 2016.
- Cotnoir (2006)، The Weiser Concise Guide to Alchemy، Weiser Books، ISBN 978-1-57863-379-1، مؤرشف من الأصل في 12 مارس 2020.
- Cox, P. A. (1997)، The Elements: Their Origin, Abundance and Distribution، Oxford University Press، ISBN 978-0-19-855298-7.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - Crow, J. M. (2007)، "Why use lead in paint?"، Chemistry World، Royal Society of Chemistry، مؤرشف من الأصل في 22 فبراير 2017، اطلع عليه بتاريخ 22 فبراير 2017.
- Dart؛ Hurlbut؛ Boyer-Hassen (2004)، "Lead"، في Dart, R. C. (المحرر)، Medical Toxicology (ط. الثالثة)، Lippincott Williams & Wilkins، ص. 1426، ISBN 978-0-7817-2845-4.
- Davidson؛ Ryman؛ Sutherland؛ وآخرون (2014)، "Lead"، Ullmann's Encyclopedia of Industrial Chemistry، doi:10.1002/14356007.a15_193.pub3، ISBN 978-3-527-30673-2.
- Delile, H.؛ Blichert-Toft؛ Goiran؛ وآخرون (2014)، "Lead in ancient Rome's city waters"، Proceedings of the National Academy of Sciences، 111 (18): 6594–99، Bibcode:2014PNAS..111.6594D، doi:10.1073/pnas.1400097111، ISSN 0027-8424، PMC 4020092، PMID 24753588، مؤرشف من الأصل في 08 مارس 2020.
- Deltares؛ Netherlands Organisation for Applied Scientific Research (2016)، Lood en zinkemissies door jacht [Lead and zinc emissions from hunting] (PDF) (Report) (باللغة الهولندية)، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 18 فبراير 2017.
- Dieter؛ Watson (2009)، "Transmetalation reactions producing organocopper compounds"، في Rappoport, Z.؛ Marek, I. (المحررون)، The Chemistry of Organocopper Compounds، John Wiley & Sons، ج. 1، ص. 443–526، ISBN 978-0-470-77296-6.
- Donnelly, J. (2014)، Deep Blue، Hachette Children's Group، ISBN 978-1-4449-2119-9، مؤرشف من الأصل في 07 مارس 2020.
- Downs؛ Adams (2017)، The Chemistry of Chlorine, Bromine, Iodine and Astatine: Pergamon Texts in Inorganic Chemistry، Elsevier، ISBN 978-1-4831-5832-7، مؤرشف من الأصل في 12 مارس 2020.
- Duda (1996)، Traditional Chinese Toggles: Counterweights and Charms، Editions Didier Millet، ISBN 978-981-4260-61-9.
- Ede؛ Cormack (2016)، A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition، University of Toronto Press، ISBN 978-1-4426-3503-6، مؤرشف من الأصل في 01 يوليو 2019.
- Emsley, J. (2011)، Nature's Building Blocks: An A-Z Guide to the Elements، Oxford University Press، ISBN 978-0-19-960563-7.
- "Encyclopedia Judaica: Ossuaries and Sarcophagi"، www.jewishvirtuallibrary.org، مؤرشف من الأصل في 05 سبتمبر 2019، اطلع عليه بتاريخ 14 يوليو 2018.
- Eschnauer؛ Stoeppler (1992)، "Wine—An enological specimen bank"، في Stoeppler, M. (المحرر)، Hazardous Materials in the Environment، Elsevier Science، ص. 49–72 (58)، doi:10.1016/s0167-9244(08)70103-3، ISBN 978-0-444-89078-8.
- Evans (1908)، "V.— The meanings and synonyms of plumbago"، Transactions of the Philological Society، 26 (2): 133–79، doi:10.1111/j.1467-968X.1908.tb00513.x.
- Finger, S. (2006)، Doctor Franklin's Medicine، University of Pennsylvania Press، ISBN 978-0-8122-3913-3، مؤرشف من الأصل في 08 يوليو 2019.
- Fiorini, E. (2010)، "2.000 years-old Roman Lead for physics" (PDF)، Aspera European Astroparticle network، : 7–8، مؤرشف من الأصل (PDF) في 26 أبريل 2018، اطلع عليه بتاريخ 29 أكتوبر 2016.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - Frankenburg, F. R. (2014)، Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History، ABC-CLIO، ISBN 978-1-4408-2932-1، مؤرشف من الأصل في 07 يوليو 2019.
- Frebel, A. (2015)، Searching for the Oldest Stars: Ancient Relics from the Early Universe، Princeton University، ISBN 978-0-691-16506-6.
- Freeman, K. S. (2012)، "Remediating soil lead with fishbones"، Environmental Health Perspectives، 120 (1): a20–a21، doi:10.1289/ehp.120-a20a، PMC 3261960، PMID 22214821.
- Funke (2013)، "Solid State Ionics: from Michael Faraday to green energy—the European dimension"، Science and Technology of Advanced Materials، 14 (4): 1–50، Bibcode:2013STAdM..14d3502F، doi:10.1088/1468-6996/14/4/043502، PMC 5090311، PMID 27877585.
- Gale, W. F.؛ Totemeier (2003)، Smithells Metals Reference Book، Butterworth-Heinemann، ISBN 978-0-08-048096-1، مؤرشف من الأصل في 05 يوليو 2019.
- Gilfillan, S. C. (1965)، "Lead poisoning and the fall of Rome"، Journal of Occupational Medicine، 7 (2): 53–60، ISSN 0096-1736، PMID 14261844.
- Gill؛ Libraries Board of South Australia (1974)، The history and topography of Glen Osmond, with map and illustrations، Libraries Board of South Australia، مؤرشف من الأصل في 07 يوليو 2019.
- Graedel (2010)، Metal stocks in Society – Scientific Synthesis (PDF) (Report)، International Resource Panel، ص. 17، ISBN 978-92-807-3082-1، مؤرشف من الأصل (PDF) في 13 يوليو 2019، اطلع عليه بتاريخ 18 أبريل 2017.
{{استشهاد بتقرير}}: الوسيط|إظهار المؤلفين=1غير صالح (مساعدة) - Grandjean (1978)، "Widening perspectives of lead toxicity"، Environmental Research، 17 (2): 303–21، Bibcode:1978ER.....17..303G، doi:10.1016/0013-9351(78)90033-6، PMID 400972.
- Greenwood؛ Earnshaw (1998)، Chemistry of the Elements (ط. 2nd)، Butterworth-Heinemann، ISBN 978-0-7506-3365-9، مؤرشف من الأصل في 12 مارس 2020.
- Grout, J. (2017)، "Lead poisoning and Rome"، Encyclopaedia Romana، اطلع عليه بتاريخ 15 فبراير 2017.
- Guberman, D. E. (2016)، "Lead"، 2014 Minerals Yearbook (PDF) (Report)، United States Geological Survey، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 8 مايو 2017.
- Gulbinska, M. K. (2014)، Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective، Springer Science+Business Media، ص. 96، ISBN 978-1-4471-6548-4، مؤرشف من الأصل في 09 مارس 2020.
- Guruswamy, S. (2000)، Engineering properties and applications of lead alloys، Marcel Dekker، ISBN 978-0-8247-8247-4، مؤرشف من الأصل في 12 مارس 2020.
- Hadlington, T. J. (2017)، On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes، Springer، ISBN 978-3-319-51807-7، مؤرشف من الأصل في 10 مارس 2020.
- Harbison؛ Bourgeois؛ Johnson (2015)، Hamilton and Hardy's Industrial Toxicology، John Wiley & Sons، ISBN 978-0-470-92973-5.
- Hauser (2017)، "Analytical Methods for the Determination of Lead in the Environment"، في Astrid, S.؛ Helmut, S.؛ Sigel, R. K. O. (المحررون)، Lead: Its Effects on Environment and Health، Metal Ions in Life Sciences، de Gruyter، ج. 17، doi:10.1515/9783110434330-003، ISBN 9783110434330، PMID 28731296.
- Hernberg, S. (2000)، "Lead Poisoning in a Historical Perspective" (PDF)، American Journal of Industrial Medicine، 38 (3): 244–54، doi:10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F، PMID 10940962، مؤرشف من الأصل (PDF) في 19 أغسطس 2019، اطلع عليه بتاريخ 1 مارس 2017.
- "A History of Cosmetics from Ancient Times"، Cosmetics Info، مؤرشف من الأصل في 12 أغسطس 2019، اطلع عليه بتاريخ 18 يوليو 2016.
- Hodge, T. A. (1981)، "Vitruvius, lead pipes and lead poisoning"، American Journal of Archaeology، 85 (4): 486–91، doi:10.2307/504874، JSTOR 504874.
- Hong؛ Candelone؛ Patterson؛ وآخرون (1994)، "Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations" (PDF)، Science، 265 (5180): 1841–43، Bibcode:1994Sci...265.1841H، doi:10.1126/science.265.5180.1841، PMID 17797222، مؤرشف من الأصل (PDF) في 29 أبريل 2019.
- Hunt, A. (2014)، Dictionary of Chemistry، Routledge، ISBN 978-1-135-94178-9، مؤرشف من الأصل في 07 يوليو 2019.
- IAEA - Nuclear Data Section (2017)، "Livechart - Table of Nuclides - Nuclear structure and decay data"، www-nds.iaea.org، International Atomic Energy Agency، مؤرشف من الأصل في 08 مارس 2020، اطلع عليه بتاريخ 31 مارس 2017.
- Insight Explorer؛ IPEN (2016)، New Study Finds Lead Levels in a Majority of Paints Exceed Chinese Regulation and Should Not be on Store Shelves (PDF) (Report)، مؤرشف من الأصل (PDF) في 24 يوليو 2019، اطلع عليه بتاريخ 3 مايو 2018.
- Ismawati؛ Primanti؛ Brosché؛ Clark؛ Weinberg؛ Denney (2013)، Timbal dalam Cat Enamel Rumah Tangga di Indonesia (PDF) (Report) (باللغة الإندونيسية)، BaliFokus & IPEN، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 26 ديسمبر 2018.
- Jensen, C. F. (2013)، Online Location of Faults on AC Cables in Underground Transmission، Springer، ISBN 978-3-319-05397-4.
- Jones (2014)، Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions، Constable & Robinson، ISBN 978-1-47211-389-4، مؤرشف من الأصل في 09 مارس 2020.
- Kaupp, M. (2014)، "Chemical bonding of main-group elements" (PDF)، في Frenking, G.؛ Shaik, S. (المحررون)، The Chemical Bond: Chemical Bonding Across the Periodic Table، John Wiley & Sons، ص. 1–24، doi:10.1002/9783527664658.ch1، ISBN 9783527664658.
- Kellett, C. (2012)، Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes، Accent Press، ISBN 978-1-909335-05-9، مؤرشف من الأصل في 08 يوليو 2019.
- King, R. B. (1995)، Inorganic Chemistry of Main Group Elements، VCH Publishers، ISBN 978-1-56081-679-9.
- Konu؛ Chivers (2011)، "Stable Radicals of the Heavy p-Block Elements"، في Hicks, R. G. (المحرر)، Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds، John Wiley & Sons، doi:10.1002/9780470666975.ch10، ISBN 978-0-470-77083-2.
- Kosnett, M. J. (2006)، "Lead"، في Olson, K. R. (المحرر)، Poisoning and Drug Overdose (ط. 5th)، McGraw-Hill Professional، ص. 238، ISBN 978-0-07-144333-3.
- Krestovnikoff, M.؛ Halls (2006)، Scuba Diving، Dorling Kindersley، ISBN 978-0-7566-4063-7، مؤرشف من الأصل في 08 يوليو 2019.
- Kroonen, G. (2013)، Etymological Dictionary of Proto-Germanic، Leiden Indo-European Etymological Dictionary Series، Brill Publishers، ج. 11، ISBN 978-90-04-18340-7.
- Langmuir؛ Broecker (2012)، How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind، Princeton University Press، ISBN 978-0-691-14006-3، مؤرشف من الأصل في 08 مارس 2020.
- Lauwerys؛ Hoet (2001)، Industrial Chemical Exposure: Guidelines for Biological Monitoring, Third Edition، CRC Press، ISBN 978-1-4822-9383-8، مؤرشف من الأصل في 12 مارس 2020.
- Layton, M. (2017)، "Lead faces threat of new Euro ban"، shootinguk.co.uk، مؤرشف من الأصل في 09 يونيو 2019، اطلع عليه بتاريخ 30 مايو 2018.
- "Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI "Catch!""، The British Museum، مؤرشف من الأصل في 12 مارس 2020، اطلع عليه بتاريخ 30 أبريل 2012.
- "Lead garden ornaments"، H. Crowther Ltd، 2016، مؤرشف من الأصل في 06 سبتمبر 2019، اطلع عليه بتاريخ 20 فبراير 2017.
- "Lead in Waste Disposal"، United States Environmental Protection Agency، 2016، مؤرشف من الأصل في 11 مارس 2020، اطلع عليه بتاريخ 28 فبراير 2017.
- "Lead mining"، The Northern Echo، مؤرشف من الأصل في 15 أغسطس 2019، اطلع عليه بتاريخ 16 فبراير 2016.
- Levin, H. L. (2009)، The Earth Through Time، John Wiley & Sons، ISBN 978-0-470-38774-0، مؤرشف من الأصل في 08 يوليو 2019.
- Levin؛ Brown؛ Kashtock؛ وآخرون (2008)، "Lead exposures in U.S. children, 2008: Implications for prevention"، Environmental Health Perspectives، 116 (10): 1285–93، doi:10.1289/ehp.11241، PMC 2569084، PMID 18941567.
- Lewis (1985)، "Lead Poisoning: A Historical Perspective"، EPA Journal، 11 (4): 15–18، مؤرشف من الأصل في 16 أغسطس 2019، اطلع عليه بتاريخ 31 يناير 2017.
- Lide, D. R., المحرر (2005)، CRC Handbook of Chemistry and Physics (ط. 85th)، CRC Press، ISBN 978-0-8493-0484-2.
- Liu؛ Liu؛ Pak؛ وآخرون (2015)، "Early blood lead levels and sleep disturbance in preadolescence"، Sleep، 38 (12): 1869–74، doi:10.5665/sleep.5230، PMC 4667382، PMID 26194570.
- Lochner؛ Rohrbach؛ Cochrane (2005)، "What is Your Cosmic Connection to the Elements?" (PDF)، Goddard Space Flight Center، مؤرشف من الأصل (PDF) في 29 ديسمبر 2016، اطلع عليه بتاريخ 2 يوليو 2017.
- Lodders (2003)، "Solar System abundances and condensation temperatures of the elements" (PDF)، The Astrophysical Journal، 591 (2): 1220–47، Bibcode:2003ApJ...591.1220L، doi:10.1086/375492، ISSN 0004-637X، مؤرشف من الأصل (PDF) في 12 أبريل 2019.
- Luckey؛ Venugopal (1979)، Physiologic and Chemical Basis for Metal Toxicity، Plenum Press، ISBN 978-1-4684-2952-7، مؤرشف من الأصل في 08 مارس 2020.
- Macintyre, J. E. (1992)، Dictionary of Inorganic Compounds، CRC Press، ISBN 978-0-412-30120-9، مؤرشف من الأصل في 01 يوليو 2019.
- Marcillac, P. de؛ Coron؛ Dambier؛ وآخرون (2003)، "Experimental detection of ?-particles from the radioactive decay of natural bismuth"، Nature، 422 (6934): 876–78، Bibcode:2003Natur.422..876D، doi:10.1038/nature01541، PMID 12712201.
- Marino؛ Landrigan؛ Graef؛ وآخرون (1990)، "A case report of lead paint poisoning during renovation of a Victorian farmhouse"، American Journal of Public Health، 80 (10): 1183–85، doi:10.2105/AJPH.80.10.1183، PMC 1404824، PMID 2119148.
- Markowitz؛ Rosner (2000)، ""Cater to the children": the role of the lead industry in a public health tragedy, 1900–55"، American Journal of Public Health، 90 (1): 36–46، doi:10.2105/ajph.90.1.36، PMC 1446124، PMID 10630135.
- Masters؛ Trevor؛ Katzung (2008)، Katzung & Trevor's Pharmacology: Examination & Board Review (ط. 8th)، McGraw-Hill Medical، ISBN 978-0-07-148869-3.
- McCoy, S. (2017)، "The End of Lead? Federal Gov't Order Bans Sinkers, Ammo"، GearJunkie، مؤرشف من الأصل في 08 مارس 2020، اطلع عليه بتاريخ 30 مايو 2018.
- Meija؛ Coplen؛ Berglund؛ وآخرون (2016)، "Atomic weights of the elements 2013 (IUPAC Technical Report)"، Pure and Applied Chemistry، 88 (3): 265–291، doi:10.1515/pac-2015-0305، مؤرشف من الأصل في 09 فبراير 2020.
- Merriam-Webster، "Definition of LEAD"، www.merriam-webster.com، مؤرشف من الأصل في 04 نوفمبر 2019، اطلع عليه بتاريخ 12 أغسطس 2016.
- Moore (1977)، "Lead in drinking water in soft water areas—health hazards"، Science of the Total Environment، 7 (2): 109–15، Bibcode:1977ScTEn...7..109M، doi:10.1016/0048-9697(77)90002-X، PMID 841299.
- More؛ Spaulding؛ Bohleber؛ وآخرون (2017)، "Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death"، GeoHealth، 1 (4): 211–219، doi:10.1002/2017GH000064، ISSN 2471-1403.
- Mosseri؛ Henglein؛ Janata (1990)، "Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species"، Journal of Physical Chemistry، 94 (6): 2722–26، doi:10.1021/j100369a089.
- Mycyk؛ Hryhorczuk؛ Amitai (2005)، "Lead"، في Erickson, T. B.؛ Ahrens, W. R.؛ Aks, S. (المحررون)، Pediatric Toxicology: Diagnosis and Management of the Poisoned Child، McGraw-Hill Professional، ISBN 978-0-07-141736-5.
{{استشهاد بكتاب}}: الوسيط|إظهار المؤلفين=3غير صالح (مساعدة) - Nakashima؛ Hayashi؛ Tashiro؛ وآخرون (1998)، "Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period"، Journal of Occupational Health، 40 (1): 55–60، doi:10.1539/joh.40.55.
- National Council on Radiation Protection and Measurements (2004)، Structural Shielding Design for Medical X-ray Imaging Facilities، ISBN 978-0-929600-83-3، مؤرشف من الأصل في 12 مارس 2020.
- National Institute for Occupational Safety and Health، "NIOSH Pocket Guide to Chemical Hazards — Lead"، www.cdc.gov، مؤرشف من الأصل في 15 ديسمبر 2019، اطلع عليه بتاريخ 18 نوفمبر 2016.
- Navas-Acien (2007)، "Lead Exposure and Cardiovascular Disease—A Systematic Review"، Environmental Health Perspectives، 115 (3): 472–482، doi:10.1289/ehp.9785، PMC 1849948، PMID 17431501.
- Nikolayev, S., المحرر (2012)، "*lAudh-"، Indo-European Etymology، starling.rinet.ru، مؤرشف من الأصل في 12 مارس 2020، اطلع عليه بتاريخ 21 أغسطس 2016.
{{استشهاد بكتاب}}: صيانة CS1: ref duplicates default (link) - Norman, N. C. (1996)، Periodicity and the s- and p-Block Elements، Oxford University Press، ISBN 978-0-19-855961-0.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - Nriagu, J. O. (1983)، "Saturnine gout among Roman aristocrats — Did lead poisoning contribute to the fall of the Empire?"، The New England Journal of Medicine، 308 (11): 660–63، doi:10.1056/NEJM198303173081123، PMID 6338384.
- Nriagu, J. O.؛ Kim (2000)، "Emissions of lead and zinc from candles with metal-core wicks"، Science of the Total Environment، 250 (1–3): 37–41، Bibcode:2000ScTEn.250...37N، doi:10.1016/S0048-9697(00)00359-4، PMID 10811249.
- Occupational Safety and Health Administration، "Substance data sheet for occupational exposure to lead"، www.osha.gov، مؤرشف من الأصل في 16 مارس 2018، اطلع عليه بتاريخ 1 يوليو 2017.
- Olinsky-Paul, T. (2013)، "East Penn and Ecoult battery installation case study webinar" (PDF)، Clean Energy States Alliance، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 28 فبراير 2017.
- Palmieri, R., المحرر (2006)، The Organ، Psychology Press، ISBN 978-0-415-94174-7، مؤرشف من الأصل في 12 مارس 2020.
{{استشهاد بكتاب}}: صيانة CS1: ref duplicates default (link) - "surma"، Oxford English Dictionary (ط. 2nd)، Oxford University Press، 2009.
- Park؛ Bolan؛ Meghara؛ وآخرون (2011)، "Bacterial-assisted immobilization of lead in soils: Implications for remediation" (PDF)، Pedologist: 162–74، مؤرشف من الأصل (PDF) في 26 نوفمبر 2015.
- Parker, R. B. (2005)، The New Cold-Molded Boatbuilding: From Lofting to Launching، WoodenBoat Books، ISBN 978-0-937822-89-0، مؤرشف من الأصل في 02 يوليو 2019.
- Parthé, E. (1964)، Crystal Chemistry of Tetrahedral Structures، CRC Press، ISBN 978-0-677-00700-7، مؤرشف من الأصل في 03 يوليو 2019.
- Pauling, L. (1947)، General Chemistry، W. H. Freeman and Company، ISBN 978-0-486-65622-9.
- Peneva؛ Djuneva؛ Tsukeva (1981)، "RHEED study of the initial stages of crystallization and oxidation of lead and tin"، Journal of Crystal Growth، 53 (2): 382–396، Bibcode:1981JCrGr..53..382P، doi:10.1016/0022-0248(81)90088-9، ISSN 0022-0248.
- Petzel, S.؛ Juuti؛ Sugimoto (2004)، "Environmental Stewardship with Regional Perspectives and Drivers of the Lead-free Issue"، في Puttlitz, K. J.؛ Stalter, K. A. (المحررون)، Handbook of Lead-Free Solder Technology for Microelectronic Assemblies، CRC Press، ISBN 978-0-8247-5249-1.
- Polyanskiy, N. G. (1986)، Fillipova, N. A (المحرر)، [ru:Аналитическая химия элементов: Свинец] (باللغة الروسية)، Nauka.
{{استشهاد بكتاب}}:|trans-title=بحاجة لـ|title=أو|script-title=(مساعدة)، الوسيط|عنوان مترجم=و|عنوان أجنبي=تكرر أكثر من مرة (مساعدة) - Prasad, P. J. (2010)، Conceptual Pharmacology، Universities Press، ISBN 978-81-7371-679-9، مؤرشف من الأصل في 01 يوليو 2019، اطلع عليه بتاريخ 21 يونيو 2012.
- "Primary Lead Refining Technical Notes"، LDA International، مؤرشف من الأصل في 22 مارس 2007، اطلع عليه بتاريخ 7 أبريل 2007.
- Progressive Dynamics, Inc.، "How Lead Acid Batteries Work: Battery Basics"، progressivedyn.com، مؤرشف من الأصل في 19 نوفمبر 2018، اطلع عليه بتاريخ 3 يوليو 2016.
- Putnam (2003)، The Sculptor's Way: A Guide to Modelling and Sculpture، Dover Publications، ISBN 978-0-486-42313-5، مؤرشف من الأصل في 07 مارس 2020.
- Pyykkö, P. (1988)، "Relativistic effects in structural chemistry"، Chemical Reviews، 88 (3): 563–94، doi:10.1021/cr00085a006.
- Rabinowitz, M. B. (1995)، "Imputing lead sources from blood lead isotope ratios"، في Beard, M. E.؛ Allen Iske, S. D. (المحررون)، Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance، ASTM، ص. 63–75، doi:10.1520/stp12967s، ISBN 978-0-8031-1884-3.
- "Radioactive Decay Series" (PDF)، Nuclear Systematics، MIT OpenCourseWare، 2012، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 28 أبريل 2018.
- Ramage, C. K., المحرر (1980)، Lyman Cast Bullet Handbook (ط. الثالثة)، Lyman Products Corporation.
- Randerson, J. (2002)، "Candle pollution"، New Scientist (2348)، مؤرشف من الأصل في 05 مايو 2015، اطلع عليه بتاريخ 7 أبريل 2007.
- Reddy, A.؛ Braun (2010)، "Lead and the Romans"، Journal of Chemical Education، 87 (10): 1052–55، Bibcode:2010JChEd..87.1052R، doi:10.1021/ed100631y.
- Retief؛ Cilliers (2006)، "Lead poisoning in ancient Rome"، Acta Theologica، 26 (2): 147–64 (149–51)، doi:10.4314/actat.v26i2.52570.
- Rich, V. (1994)، The International Lead Trade، Woodhead Publishing، ISBN 978-0-85709-994-5، مؤرشف من الأصل في 04 يوليو 2019.
- Rieuwerts (2015)، The Elements of Environmental Pollution، Routledge، ISBN 978-0-415-85919-6.
- Riva؛ Lafranconi؛ d'Orso؛ وآخرون (2012)، "Lead poisoning: Historical aspects of a paradigmatic "occupational and environmental disease""، Safety and Health at Work، 3 (1): 11–16، doi:10.5491/SHAW.2012.3.1.11، PMC 3430923، PMID 22953225.
- Roederer, I. U.؛ Kratz؛ Frebel؛ وآخرون (2009)، "The end of nucleosynthesis: Production of lead and thorium in the early galaxy"، The Astrophysical Journal، 698 (2): 1963–80، arXiv:0904.3105، Bibcode:2009ApJ...698.1963R، doi:10.1088/0004-637X/698/2/1963.
- Rogalski, A. (2010)، Infrared Detectors (ط. 2nd)، CRC Press، ISBN 978-1-4200-7671-4، مؤرشف من الأصل في 07 مارس 2020، اطلع عليه بتاريخ 19 نوفمبر 2016.
- Röhr, C. (2017)، "Binare Zintl-Phasen" [Binary Zintl Phases]، Intermetallische Phasen [Intermettallic Phases] (باللغة الألمانية)، Universität Freiburg، اطلع عليه بتاريخ 18 فبراير 2017.
- Rudolph؛ Rudolph؛ Hostetter؛ وآخرون (2003)، "Lead"، Rudolph's Pediatrics (ط. 21st)، McGraw-Hill Professional، ص. 369، ISBN 978-0-8385-8285-5.
- Samson, G. W. (1885)، The divine law as to wines، J. B. Lippincott & Co..
{{استشهاد بكتاب}}: صيانة CS1: التاريخ والسنة (link) - Scarborough, J. (1984)، "The myth of lead poisoning among the Romans: An essay review"، Journal of the History of Medicine and Allied Sciences، 39 (4): 469–475، doi:10.1093/jhmas/39.4.469، PMID 6389691.
- Schoch, R. M. (1996)، Case Studies in Environmental Science، West Publishing، ISBN 978-0-314-20397-7.
{{استشهاد بكتاب}}: صيانة CS1: التاريخ والسنة (link) - Schoeters؛ Den Hond؛ Dhooge؛ وآخرون (2008)، "Endocrine disruptors and abnormalities of pubertal development"، Basic & Clinical Pharmacology & Toxicology، 102 (2): 168–175، doi:10.1111/j.1742-7843.2007.00180.x، hdl:1854/LU-391408، PMID 18226071.
- Sharma؛ Nozawa؛ Smerdon؛ وآخرون (2013)، "Templated three-dimensional growth of quasicrystalline lead"، Nature Communications، 4: 2715، Bibcode:2013NatCo...4E2715S، doi:10.1038/ncomms3715، PMID 24185350.
- Sharma؛ Smerdon؛ Nugent؛ وآخرون (2014)، "Crystalline and quasicrystalline allotropes of Pb formed on the fivefold surface of icosahedral Ag-In-Yb"، The Journal of Chemical Physics، 140 (17): 174710، Bibcode:2014JChPh.140q4710S، doi:10.1063/1.4873596، PMID 24811658.
- Silverman, M. S. (1966)، "High-pressure (70-k) synthesis of new crystalline lead dichalcogenides"، Inorganic Chemistry، 5 (11): 2067–69، doi:10.1021/ic50045a056.
- Singh, P. (2017)، "Over 73% of paints found to have excessive lead: Study"، Times of India، مؤرشف من الأصل في 01 ديسمبر 2018، اطلع عليه بتاريخ 3 مايو 2018.
- Sinha؛ Shelly؛ Sharma؛ وآخرون (1993)، "Neurotoxic effects of lead exposure among printing press workers"، Bulletin of Environmental Contamination and Toxicology، 51 (4): 490–93، doi:10.1007/BF00192162.
- Slater (1964)، "Atomic Radii in Crystals"، The Journal of Chemical Physics، 41 (10): 3199–3204، Bibcode:1964JChPh..41.3199S، doi:10.1063/1.1725697، ISSN 0021-9606.
- Smirnov؛ Borisevich؛ Sulaberidze (2012)، "Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials"، Theoretical Foundations of Chemical Engineering، 46 (4): 373–78، doi:10.1134/s0040579512040161، مؤرشف من الأصل في 23 أغسطس 2019.
- Sokol, R. C. (2005)، "Lead exposure and its effects on the reproductive system"، في Golub, M. S. (المحرر)، Metals, Fertility, and Reproductive Toxicity، CRC Press، ص. 117–53، doi:10.1201/9781420023282.ch6، ISBN 978-0-415-70040-5.
- Stabenow؛ Saak؛ Weidenbruch (2003)، "Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds"، Chemical Communications (18): 2342–2343، doi:10.1039/B305217F.
- Stone, R. (1997)، "An Element of Stability"، Science، 278 (5338): 571–572، Bibcode:1997Sci...278..571S، doi:10.1126/science.278.5338.571.
- Street؛ Alexander (1998)، Metals in the Service of Man (ط. الحادية عشر)، Penguin Books، ISBN 978-0-14-025776-2، مؤرشف من الأصل في 02 يوليو 2019.
- Szczepanowska, H. M. (2013)، Conservation of Cultural Heritage: Key Principles and Approaches، Routledge، ISBN 978-0-415-67474-4، مؤرشف من الأصل في 01 يوليو 2019.
- Takahashi؛ Boyd؛ Mathews؛ وآخرون (1987)، "Bound-state beta decay of highly ionized atoms" (PDF)، Physical Review C، 36 (4): 1522، Bibcode:1987PhRvC..36.1522T، doi:10.1103/physrevc.36.1522، OCLC 1639677، مؤرشف من الأصل (PDF) في 21 أكتوبر 2014، اطلع عليه بتاريخ 27 أغسطس 2013.
- Tarragó, A. (2012)، "Case Studies in Environmental Medicine (CSEM) Lead Toxicity" (PDF)، Agency for Toxic Substances and Disease Registry، مؤرشف من الأصل (PDF) في 06 أغسطس 2019.
- Tétreault؛ Sirois؛ Stamatopoulou (1998)، "Studies of lead corrosion in acetic acid environments"، Studies in Conservation، 43 (1): 17–32، doi:10.2307/1506633، JSTOR 1506633.
- "Think Lead research summary" (PDF)، The Lead Sheet Association، مؤرشف من الأصل (PDF) في 20 فبراير 2017، اطلع عليه بتاريخ 20 فبراير 2017.
- Thomson, T. (1830)، The History of Chemistry، Henry Colburn and Richard Bentley (publishers)، مؤرشف من الأصل في 03 يوليو 2019.
- Thornton؛ Rautiu؛ Brush (2001)، Lead: The Facts (PDF)، International Lead Association، ISBN 978-0-9542496-0-1، مؤرشف من الأصل (PDF) في 26 يوليو 2019، اطلع عليه بتاريخ 5 فبراير 2017.
- Thürmer؛ Williams؛ Reutt-Robey (2002)، "Autocatalytic oxidation of lead crystallite surfaces"، Science، 297 (5589): 2033–35، Bibcode:2002Sci...297.2033T، doi:10.1126/science.297.5589.2033، PMID 12242437.
- Tolliday, B. (2014)، "Significant growth in lead usage underlines its importance to the global economy"، International Lead Association، مؤرشف من الأصل في 08 مارس 2020، اطلع عليه بتاريخ 28 فبراير 2017،
Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead-acid batteries
- "Toronto museum explores history of contraceptives"، ABC News، 2003، مؤرشف من الأصل في 16 مارس 2018، اطلع عليه بتاريخ 13 فبراير 2016.
- "Toxic Substances Portal – Lead"، Agency for Toxic Substances and Disease Registry، مؤرشف من الأصل في 6 يونيو 2011.
- "Toxicological Profile for Lead" (PDF)، Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine، 2007، مؤرشف من الأصل (PDF) في 2 يوليو 2017.
- "Trace element emission from coal"، IEA Clean Coal Centre، 2012، مؤرشف من الأصل في 11 مارس 2020، اطلع عليه بتاريخ 1 مارس 2017.
- Tuček, K.؛ Carlsson؛ Wider (2006)، "Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues" (PDF)، Nuclear Engineering and Design، 236 (14–16): 1589–98، doi:10.1016/j.nucengdes.2006.04.019، مؤرشف من الأصل (PDF) في 19 أغسطس 2019.
- Tungate, M. (2011)، Branded Beauty: How Marketing Changed the Way We Look، Kogan Page Publishers، ISBN 978-0-7494-6182-9، مؤرشف من الأصل في 12 مارس 2020.
- UK Marine SACs Project (1999)، "Lead"، Water Quality (Report)، مؤرشف من الأصل في 29 أغسطس 2019، اطلع عليه بتاريخ 10 يونيو 2018.
- United Nations Environment Programme (2010)، Final review of scientific information on lead (PDF)، Chemicals Branch, Division of Technology, Industry and Economics، مؤرشف من الأصل (PDF) في 10 مارس 2020، اطلع عليه بتاريخ 31 يناير 2017.
- United States Environmental Protection Agency (2010)، "Metallurgical Industry:Secondary Lead Processing"، AP 42 Compilation of Air Pollutant Emission Factors (ط. 5th)، اطلع عليه بتاريخ 20 مايو 2018.
- United States Environmental Protection Agency (2000)، "Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (August 2000)"، مؤرشف من الأصل في 09 مارس 2020، اطلع عليه بتاريخ 28 فبراير 2017.
- United States Environmental Protection Agency (2005)، "Best Management Practices for Lead at Outdoor Shooting Ranges" (PDF)، مؤرشف من الأصل (PDF) في 30 سبتمبر 2019، اطلع عليه بتاريخ 12 يونيو 2018.
- United States Food and Drug Administration (2015)، Q3D Elemental Impurities Guidance for Industry (PDF) (Report)، United States Department of Health and Human Services، ص. 41، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 15 فبراير 2017.
- United States Geological Survey (1973)، Geological Survey Professional Paper، United States Government Publishing Office، ص. 314، مؤرشف من الأصل في 30 يونيو 2019.
- United States Geological Survey (2005)، Lead (PDF) (Report)، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 20 فبراير 2016.
- United States Geological Survey (2017)، "Lead" (PDF)، Mineral Commodities Summaries، مؤرشف من الأصل (PDF) في 12 أبريل 2019، اطلع عليه بتاريخ 8 مايو 2017.
- University of California, Berkeley، "Decay Chains"، Nuclear Forensics: A Scientific Search Problem، مؤرشف من الأصل في 25 أغسطس 2019، اطلع عليه بتاريخ 23 نوفمبر 2015.
{{استشهاد ويب}}: النص "University of California Nuclear Forensic Search Project" تم تجاهله (مساعدة) - Vasmer (1986–1987) [1950–1958]، Trubachyov, O. N.؛ Larin, B. O. (المحررون)، Этимологический словарь русского языка [Russisches etymologisches Worterbuch] (باللغة الروسية) (ط. 2nd)، Progress، مؤرشف من الأصل في 12 مارس 2020، اطلع عليه بتاريخ 4 مارس 2017.
- Vogel؛ Achilles (2013)، The Preservation and Repair of Historic Stained and Leaded Glass (PDF) (Report)، United States Department of the Interior، مؤرشف من الأصل (PDF) في 13 يوليو 2019، اطلع عليه بتاريخ 30 أكتوبر 2016.
- Waldron, H. A. (1985)، "Lead and lead poisoning in antiquity"، Medical History، 29 (1): 107–08، doi:10.1017/S0025727300043878، PMC 1139494.
- Wani؛ Ara؛ Usman (2015)، "Lead toxicity: A review" (PDF)، Interdisciplinary Toxicology، 8 (2): 55–64، doi:10.1515/intox-2015-0009، PMC 4961898، PMID 27486361، مؤرشف من الأصل (PDF) في 12 مارس 2020.
- Weast؛ Astle؛ Beyer (1983)، CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data، CRC Press، ISBN 978-0-8493-0464-4، مؤرشف من الأصل في 07 يوليو 2019.
- "Weatherings to Parapets and Cornices"، The Lead Sheet Association، مؤرشف من الأصل في 31 مارس 2018، اطلع عليه بتاريخ 20 فبراير 2017.
- Webb, G. A. (2000)، Nuclear Magnetic Resonance، Royal Society of Chemistry، ISBN 978-0-85404-327-9، مؤرشف من الأصل في 12 مارس 2020.
- Webb؛ Marsiglio؛ Hirsch (2015)، "Superconductivity in the elements, alloys and simple compounds"، Physica C: Superconductivity and its Applications، 514: 17–27، arXiv:1502.04724، Bibcode:2015PhyC..514...17W، doi:10.1016/j.physc.2015.02.037.
- Whitten؛ Gailey؛ David (1996)، General chemistry with qualitative analysis (ط. الثالثة)، Saunders College، ISBN 978-0-03-012864-6.
- Wiberg؛ Wiberg؛ Holleman (2001)، Inorganic Chemistry، Academic Press، ISBN 978-0-12-352651-9.
- Wilkes؛ Summers؛ Daniels؛ وآخرون (2005)، PVC Handbook، Hanser، ISBN 978-1-56990-379-7، مؤرشف من الأصل في 12 مارس 2020.
- Willey, D. G. (1999)، "The physics behind four amazing demonstrations — CSI"، Skeptical Inquirer، 23 (6)، مؤرشف من الأصل في 27 مارس 2019، اطلع عليه بتاريخ 6 سبتمبر 2016.
- Winder, C. (1993a)، "The history of lead — Part 1"، LEAD Action News، 2 (1)، ISSN 1324-6011، مؤرشف من الأصل في 31 أغسطس 2007، اطلع عليه بتاريخ 5 فبراير 2016.
- Winder, C. (1993b)، "The history of lead — Part 3"، LEAD Action News، 2 (3)، ISSN 1324-6011، مؤرشف من الأصل في 31 أغسطس 2007، اطلع عليه بتاريخ 12 فبراير 2016.
- Windholz, M. (1976)، Merck Index of Chemicals and Drugs (ط. 9th)، Merck & Co.، ISBN 978-0-911910-26-1، Monograph 8393.
- World Health Organization (1995)، Environmental Health Criteria 165: Inorganic Lead (Report)، مؤرشف من الأصل في 13 أغسطس 2019، اطلع عليه بتاريخ 10 يونيو 2018.
- World Health Organization (2000)، "Lead" (PDF)، Air quality guidelines for Europe، Regional Office for Europe، ص. 149–53، ISBN 978-92-890-1358-1، OCLC 475274390.
- World Nuclear Association (2015)، "Nuclear Radiation and Health Effects"، مؤرشف من الأصل في 28 يناير 2016، اطلع عليه بتاريخ 12 نوفمبر 2015.
- Wrackmeyer؛ Horchler (1990)، 207Pb-NMR Parameters، Annual Reports on NMR Spectroscopy، Academic Press، ج. 22، ص. 249–303، ISBN 978-0-08-058405-8، مؤرشف من الأصل في 12 مارس 2020.
- Yong, L.؛ Hoffmann؛ Fässler (2006)، "A low-dimensional arrangement of [Pb9]4? clusters in [K(18-crown-6)]2K2Pb9·(en)1.5"، Inorganica Chimica Acta، 359 (15): 4774–78، doi:10.1016/j.ica.2006.04.017.
- Young, S. (2012)، "Battling lead contamination, one fish bone at a time"، Compass، United States Coast Guard، مؤرشف من الأصل في 09 مارس 2020، اطلع عليه بتاريخ 11 فبراير 2017.
- Yu؛ Yu (2004)، Chinese Coins: Money in History and Society، Long River Press، ISBN 978-1-59265-017-0، مؤرشف من الأصل في 02 يوليو 2019.
- Zhang, X.؛ Yang؛ Li؛ وآخرون (2012)، "Impacts of lead/zinc mining and smelting on the environment and human health in China"، Environmental Monitoring and Assessment، 184 (4): 2261–73، doi:10.1007/s10661-011-2115-6، PMID 21573711.
- Zhao, F. (2008)، Information Technology Entrepreneurship and Innovation، IGI Global، ص. 440، ISBN 978-1-59904-902-1، مؤرشف من الأصل في 05 يوليو 2019.
- Zuckerman؛ Hagen (1989)، Inorganic Reactions and Methods, the Formation of Bonds to Halogens، John Wiley & Sons، ISBN 978-0-471-18656-4.
- Zweifel, H. (2009)، Plastics Additives Handbook، Hanser، ISBN 978-3-446-40801-2، مؤرشف من الأصل في 12 مارس 2020.
- Zýka, J. (1966)، "Analytical study of the basic properties of lead tetraacetate as oxidizing agent"، Pure and Applied Chemistry، 13 (4): 569–81، doi:10.1351/pac196613040569، مؤرشف من الأصل في 25 فبراير 2021، اطلع عليه بتاريخ 2 مارس 2017.
وصلات خارجية
- بوابة الكيمياء
- بوابة العناصر الكيميائية
- بوابة تعدين
- بوابة علم المواد


