حمض الكبريتيك
حمض الكبريتيك[3] أو حمض الكبريت أو زيت الزاج أو الحمض الكبريتي أو حمض السلفوريك[4] صيغته الكيميائية H2SO4 هو حمض معدني قوي، يذوب في الماء بجميع التراكيز، وهو من أوائل الأحماض التي عرفت في التاريخ القديم. حيث عرفه العرب منذ القرن الثامن الميلادي، وعرفته أوروبا في القرنين الرابع والخامس عشر. وأطلق عليه اسم زيت الزاج من قبل الكيميائي العربي جابر بن حيان، الذي حضره وينسب إليه في اكتشافه بالقرن الثامن الميلادي. [5] [6]
| حمض الكبريتيك | |
|---|---|
 حمض الكبريتيك |
 حمض الكبريتيك |
| الاسم النظامي (IUPAC) | |
حمض الكبريتيك | |
| أسماء أخرى | |
حمض الكبريت | |
| المعرفات | |
| رقم CAS | 7664-93-9 |
| بوب كيم | 1118 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
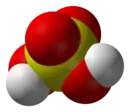
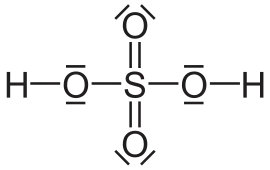
| الصيغة الجزيئية | H2SO4 |
| الكتلة المولية | 98.08 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.84 غ/سم3 |
| نقطة الانصهار | 10.38 °س |
| نقطة الغليان | 279.6 °س |
| الذوبانية في الماء | يمتزج مع الماء بكافة النسب |
| حموضة (pKa) | −3 |
| المخاطر | |
| ترميز المخاطر |  C C |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يعد تفاعل السلفنة أشهر التفاعلات التي تتم معه.
الخواص الفيزيائية
أشكال حمض الكبريتيك
بالرغم من إمكانية تحضير حمض الكبريتيك بتركيز 100% إلا أنه يفقد SO3 عند درجة الغليان ويعطي حمض تركيزه 98.3% ينحل في الماء ناشرا كمية كبيرة من الحرارة، ونتيجة لذلك ينصح بالحذر عند تمديد الحمض، وذلك بصب الحمض فوق الماء وليس العكس لأنه شره جدا للماء لهذا يستعمل في تجفيف الغازات الرطبة كما يخرب المواد العضوية والخلايا الحية لسحبه الماء منها.
أطلق جابر بن حيان على هذا الحمض قديماً زيت الزاج (Oil of Vitroil) بسبب تحضيره من تسخين وتقطير الزاج الأخضر (كبريتات الحديدوز المائية)، والكبريتات الأخرى المشابهة له. وحمض الكبريتيك هو سائل عديم اللون. أما حمض الكبريت المركز فهو يعتبر موصل للتيار الكهربائي.
الخواص الكيميائية
تختلف الخواص الكيميائية لحمض الكبريت حسب التركيز. فحمض الكبريت الممدد يتفاعل مباشرة مع المعادن الواقعة قبل الهيدروجين في (السلسلة الكهروكيميائية) معطيا كبريتات المعدن ومحررا الهيدروجين أما المعادن التي تقع بعد الهيدروجين مثل النحاس والفضة فلا يتفاعل معها إلا بوجود مؤكسد قوي مثل حمض الآزوت ولا يتفاعل أبدا مع الذهب والبلاتين. أما حمض الكبريت المركز فيتفاعل مع جميع المعادن الواقعة قبل وبعد الهيدروجين في الجدول الدوري معطيا كبريتات المعدن وثنائي أكسيد الكبريت والماء. كما يتفاعل أيضا مع اللامعادن معطيا ثنائي أكسيد الكبريت وأكسيد اللامعدن والماء. يعود السبب في ذلك أن حمض الكبريت المركز والساخن له خواص مؤكسدة حيث يتلقى الإلكترونات من العنصر المختزل (المرجع) في تفاعل أكسدة-إرجاع على الشكل:[7]
- 2H2SO4 + 2e− → SO42− + 2 H2 O + SO2
التفاعلات
- التأين
H2SO4 → 2H+ + SO42-
- التفاعل مع القواعد والقلويات
- H2SO4 +2NaOH → Na2SO4 + 2H2O
- H2SO4 + NaOH → NaHSO4 + H2O
- التفاعل مع الأملاح
- H2SO4 +2NaCl → Na2SO4 + 2HCl
- H2SO4 +2NaNO3 → Na2SO4 + 2HNO3
- H2SO4 + CaF2 → 2 HF + CaSO4
- H2SO4 + 2 NaI → 2 HI + Na2SO4
- كعامل مؤكسد
Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O
ويؤكسد الحمض أيضاً كثيراً من اللافلزات كالكربون والكبريت.
- C + 2H2SO4 → CO2 + 2SO2 + 2H2O
- S + 2H2SO4 → 3SO2 + 2H2O
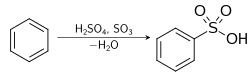
- التفاعل مع المركبات العضوية العطرية
يتفاعل حمض الكبريتيك المركز مع الكثير من المركبات العضوية العطرية حيث تستبدل ذرة من ذرات الهيدروجين بها بمجموعة حمض السلفونيك، ولهذا التفاعل أهمية كبيرة في تحضير الكثير من المركبات كالفينول والسكارين، فيتفاعل مثلاً مع البنزين مكوناً حمض البنزين سلفونيك.
التحضير
تعتمد عملية تحضير حمض الكبريت على الكبريت وعلى الكبريتات التي توضع كمواد أولية. كما تحتاج أيضا إلى النقاوة العالية نتيجة النشاط الكميائي الشديد للحامض. يمكن أن يحضر حمض الكبريت إما مخبرياً أو على النطاق الصناعي.
يحضر حمض الكبرتيك صناعياً بأسلوبين وهما عملية غرف الرصاص وعملية التلامس.
عملية غرف الرصاص
وهي عملية سهلة قليلة التكلفة طورت في إنجلترا في القرن الثامن عشر من الصناعي جون روبوك.
تعتمد العملية على تفاعل ثاني أكسيد الكبريت مع الماء في وجود ثاني أكسيد النتروجين ليعطي حمض الكبريتيك وأحادي أكسيد النتروجين ثم أكسدة هذا الأخير ليعطي ثاني أكسيد النتروجين ويعاد أيضا لبرج التفاعل مرة أخرى ليتفاعل مع الماء وثاني أكسيد الكبريت للحصول على حمض الكبريتيك.
- SO2 + H2O + NO2 → H2SO4 + NO
- 2NO + O2 → 2NO2
عملية التلامس
طورت هذه العملية عام 1831 وهي الأكثر انتشارا حاليا وبتكلفة قليلة. و هي الأحسن مقارنة مع الأولى لأن حمض الكبريت المتحصل عليه يكون نقيا. تشمل هذه العملية عدة مراحل هي كالتالي : 1) يصهر الكبريت ويرشح وذلك من أجل فصل الأجزاء غير المنصهرة ثم يضخ إلى وحدة خاصة بحرق الكبريت للحصول على SO2 (ثاني أكسيد الكبريت) ليمرر على سخان ثم إلى مرشح الغاز لتنقيته من الشوائب ثم ينقل إلى برج التحويل لأكسدته مع معدن مثل البلاتين للحصول على ثالث أكسيد الكبريت ثم يمتص هذا الغاز بواسطة الماء وفق المعادلة التالية :
SO3 + H2O ⇌ H2SO4
والعامل الحفاز لهذه العملية هو خماسي أكسيد الفانديوم.
2) يؤخذ هذا المحلول إلى وسط برج الأوليوم ويؤخذ الجزء من الناتج من أسفل البرج إلى مبرد الأوليوم ليصعد جزء منه مرة أخرى إلى أعلى البرج وبالتالي نتحصل على حمض الكبريت الذي يتجه مباشرة إلى الخزانات. بالنسبة إلى الحامض الناتج فيختلف تركيزها وذلك حسب درجة تبخرها.
استخدامات حمض الكبريتيك
حمض الكبريتيك شديد الأهمية، لدرجة أنه يقاس تقدم الأمم بحجم إنتاجها لحمض الكبريتيك ويعطي مؤشراً جيداً.[8] الاستخدام الرئيسي (60% من العالم كله) لحمض الكبريتيك يكون في «العملية الرطبة» لإنتاج حمض الفوسفوريك، الذي يستخدم في صناعة الأسمدة الفوسفاتية، وكذلك فوسفات ثلاثي الصوديوم المستخدم في صناعة المنظفات. لحمض الكبريتيك استخدامات عديدة فهو يدخل بشكل ما في معظم المواد المصنوعة تقريباً ويعتبر مستوى إنتاجه دليلاً على القدرة الصناعية لأي بلد وتعود وفرة استخدامه إلى رخصه وتنوع تأثيره الكيميائي.
يمكن تلخيص استخدامات حمض الكبريت كما يلي:
- كمادة مؤكسدة ونازعة للماء.
- إنتاج الاسمدة الكيمائية.
- صناعة الصابون والمطاط.
- إنتاج الأصباغ والكحولات والبلاستيك.
- صناعة الحديد والنحاس والمنظفات.
- صناعة بطاريات السيارة.
الجوانب البيئية
يعتبر حمض الكبريتيك من مكونات الأمطار الحمضية، حيث يتكون من أكسدة غاز الأكسجين الجوي لثاني أكسيد الكبريت في وجود الماء (أكسدة حمض الكبريتوز). إن ثاني أكسيد الكبريت هو الناتج الأساسي لعمليات حرق الكبريت أو أحد أنواع الوقود الحاوي على الكبريت مثل الفحم والزيت.
الأمطار الحمضية التي تنجم من حمض الكبريت تؤدي إلى تلف المحاصيل الزراعية أما بالنسبة للإنسان فإن الجرعة القاتلة من حمض الكبريت تبلغ من 4-5 سنتمتر مكعب وهي تؤدي إلى الوفاة بعد 12-48 ساعة من التعاطي بسبب الصدمة العصبية والدموية الناجمة عن الألم المحرق أو الجفاف نتيجة القيء المتكرر وقد يؤدي ذلك إلى التشوّه في جسم الإنسان.
مراجع
- العنوان : sulfuric acid — الناشر: معهد المعلوماتية الحيوية الأوروبي — مُعرِّف الكيانات الكيميائيَّة ذات الأهمية الحيوية (ChEBI): https://www.ebi.ac.uk/chebi/searchId.do?chebiId=CHEBI:26836 — تاريخ الاطلاع: 5 أكتوبر 2016 — الرخصة: رخصة المشاع الإبداعي الملزمة بالنسب لمؤلف العمل غير القابلة للإلغاء 3.0
- المحرر: إدارة الأغذية والأدوية — العنوان : Unique Ingredient Identifier — مُعرِّف المُكوِّن الفريد (UNII): https://fdasis.nlm.nih.gov/srs/unii/O40UQP6WCF — تاريخ الاطلاع: 14 فبراير 2018
- قاموس المورد، البعلبكي، بيروت، لبنان.
- المعجم الطبي الموحد نسخة محفوظة 31 ديسمبر 2017 على موقع واي باك مشين.
- حمـض الكبريتيـك Sulfuric Acid - بيوتات الكيمياء التعليمية نسخة محفوظة 16 ديسمبر 2017 على موقع واي باك مشين.
- حامض الكبريتيك نسخة محفوظة 17 يونيو 2015 على موقع واي باك مشين.
- Sulfuric Acid - MOTM May 2008 - Chime version نسخة محفوظة 17 ديسمبر 2017 على موقع واي باك مشين.
- Chenier, Philip J. Survey of Industrial Chemistry, pp 45-57. John Wiley & Sons, New York, 1987. ISBN 0-471-01077-4.
- بوابة الفيزياء
- بوابة كيمياء فيزيائية
- بوابة الكيمياء