تحليل دورة الخلية
تحليل دورة الخلية من خلال قياس محتوى الحمض النووي هي طريقة تستخدم التدفق الخلوي لتمييز الخلايا في المراحل المختلفة من دورة حياة الخلايا. قبل عملية التحليل، يتم جعل الخلايا قابلة للنفاذ ويتم معالجتها بصبغة فلورية مضيئة والتي تقوم بصباغة الحمض النووي (دي ان ايه DNA)، ومن الامثلة على هذه الصبغات يوديد البوربيديوم (بي آي PI). كثافة الإضاءة في الخلايا المصبوغة تتناسب مع كمية الحمض النووي DNA التي تحتويه طرديا، محتوى الحمض النووي في الخلية يحدد المرحلة اللتي تمر بها الخلية (G0 ,G1, S, G2, M). تنقسم المراحل السابقة إلى جزأين الأول يشمل (G0, G1, S) والثاني يشمل (G2, M) ويتضاعف محتوى الحمض النووي (DNA)في مرحلة S..و يمثل محتوى الحمض النووي (DNA)غالبا على رسم بياني ليقدم معلومات من خلال الترددات التي رسمت لكل مرحلة من مراحل دورة الخلية.
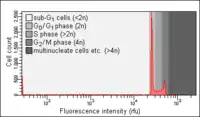
بعض الترددات غير الطبيعية يمكن ان تظهر في حال حصل تلف للخلية مهما كان نوعه، مثلا التلف في الحمض النووي (DNA) يمكن ان يقاطع تقدم دورة الخلية عند مراحل معينة، مثل هذا التهديد على تقدم دورة الخلية يمكن ان يؤدي اما إلى اصلاح الحمض النووي (DNA)أو إلى موت الخلية، اصلاح الحمض النووي (DNA)يمكن ان يؤدي إلى تحول الخلية الطبيعية إلى خلية سرطانية، اما موت الخلية فيحصل غالبا من خلال ما يسمى بالاستماتة أو موت الخلية المبرمج (طراز مورفولوجي لموت الخلايا المفردة المتميز بانكماش الخلية وتكثف الكروماتين وتشكل فقاعات هيولية ثم تتجزأ الخلية إلى شدف مرتبطة بالغشاء، ثم تبتلعها البلاعم حتى تختفي).المشاكل التي تواجه الخلية في مراحل (G0 و G1)غالبا ما تكون بسبب قلة المواد الغذائية (مثل الحرمان من الامصال). بدا التعبير عن (تحليل دورة حياة الخلية) في عام 1969 في مختبرات لوس امالوس العلمية من قبل مجموعة من جامعة كاليفورنبا مستخدمين طريقة صبغة فيولجين، أول ببروتوكول لاستخدام صبغة يوديد البوربيديوم في تحليل دورة الخلية كان عام 1975 من خلال اوتار كريشان من كلية هارفرد الطبية وما زالت هذه الطريقة مستخدمة حتى وقتنا هذا.
تحليل دورة الخلية متعدد الوسائط يشمل، بالإضافة إلى قياس محتوى الحمض النووي، خصائص أخرى متعلقة بدورة الخلية، مثل القياس المتزامن لمحتوى الحمض النووي (DNA) والحمض الريبي النووي (RNA), أو قياس قابلية الحمض النووي (DNA) للتحطم عند رقم هيدروجيني (PH)منخفض من خلال استخدام صبغة الاكريدين البرتقالية، فتحدد مكونات مرحلة (G1Q, G1A, G1B) وتجعل من الممكن التمييز بين الخلايا في مرحلتي Sو Mو الخلايا المنقسمة. الخلايا في مرحلة (G1Q) تكون خاملة وموجودة بشكل مؤقت في دورة الخلية ويمكن ملاحظتها أيضا في (G0), الخلايا في مرحلة G1A تكون في طور النمو، اما في مرحلة G1B فتكون عبارة عن الخلايا تماما قبل دخولها مرحلة S ويكون نموها (سواء بكمية الحمض النووي الريبي RNA أو البروتين أو حجمها) مشابه للخلايا التي تبدا عملية تضاعف الحمض النووي. يمكن اكتشاف مكونات مشابهة في دورة الخلية من خلال التحليل متعدد الوسائط الذي يشمل قياس التعبير الذي يحدثه السايكلين دي 1 (CYCLIN D1) والسايكلين أي (CYCLIN E) والسايكلين ايه (CYCLIN A) والسايكلين بي 1 (CYCLIN B1). القياس المتزامن لمكونات الحمض النووي ووجود المركب الاولي 5-بروميد-2-دي اوكسي يوريدين من خلال التدفق الخلوي يعتبر طريقة مفيدة بشكل خاص والتي يتم استخدامها بشكل واسع مؤخرا في تحليل الخلية في المختبر أو بالجسم الحي. مع ذلك تحليل وجود 5-ايثينيل-2-دي اوكسي ريودين أصبح الآن الطريقة المفضلة لتحديد وجود الخلايا المضاعفة للحمض النووي في مرحلة S.
خطوات عملية تحليل دورة الخلية
في حالة تم الصببغ باستخدام صبغة غير هوشست33342 (Hoechst 33342) فيجب اولا جعل الغشاء البلازمي للخلايا قابل للنفاذ ويتم ذلك من خلال وضعها في محلول يحافظ على درجة الرقم الهيدروجيني ويحتوي على منظف مخفف مثل تريتون اكس 100 (TRITON-X100)أو ان بي 40 (NP 40), أو من خلال تثبيت الخلايا في الايثانول، اغلب الصبغات باستثناء هوشست333422 (Hoechst 33342)غير قابلة للنفاذ من خلال الغشاء البلازمي بالتالي تعتبر الخطوة السابقة ضرورية للنجاح الخطوة التي تليها، وهي صبغ الخلايا.
قبل أو خلال عملية الصبغ يتم معالجة الخلية بمحطمات للحمض النووي الريبي (RNase) للتخلص منه لان الصبغات ستصبغه كما ستصبغ الحمض النووي وبالتالي ستؤثر على النتيجة، الا في حالة استخدام صبغة الاكريدين البرتقالية لانها ستعطي الحمض النووي الريبي (RNA) اضاءة حمراء والحمض النووي (DNA) اضاءة خضراء، وفي حالة تم ازالة الحمض النووي الريبي (RNA) وتحطمت بعض اجزاء الحمض النووي (DNA) فانه سيصبغ الحمض النووي ثنائي الشريط (الغير محطم) بصبغة مختلفة عن الحمض النووي احادي الشريط (المحطم).و لان الخلايا تميل إلى الالتصاق ببعضها البعض يجب التخلص من الخلايا المتجمعة واستثناءها من عملية التحليل، لان الخلايا من مرحلة G0 و G1 لهما نفس كمية الحمض النووي والتي ستكون مجتمعة مساوية لكمية الحمض النووي الموجودة في خلية من مرحلة S أو M باتالي تعطي قراءة خاطئة.
اختبار نيوكليتي
اختبار نيوكليتي (Nicoletty Assay), والذي سمي باسم مخترعه الإيطالي الفيزيائي الدو نيوكليتي (Ildo Nicoletty), هو صورة معدلة عن عملية تحليل دورة حياة الخلية، والذي يقيس عدد الخلايا المستميتة (في عملية الموت المبرمج أو الاستماتة) ويتم ذلك من خلال قياس ما يسمى ب (خلايا G0/G1 الثانوية) والتي تحتوي على كمية اقل من الكروموسومات التي من المفترض تواجدها داخل الخلية في مرحلتي G0 و G1 (يجب ان تكون الكروموسومات في هذه المراحل مضاعفة 2N), مثل هذه الخلايا يمكن ان تنتج من خلال تحطيم الحمض النووي (DNA) بواسطة محطمات الحمض النووي (DNase) خلال عملية الاستماتة بالتالي تكون نواة الخلية تحتوي على اقل من الكمية المفترض تواجدها من الكوروموسومات، مما سسيؤدي إلى حدوث قفزة في الرسم البياني الخاص بالخلايا المصبوغة المضيئة بالتالي يحدد عدد الخلايا المستميتة. تم تطوير هذه الطريقة من خلال نيكوليتي ومساعديه في كلية الطب بجامعة بيروجيا. من الجدير بالذكر ان الجزيئات التي يتم قياسها من ضمن القفزة التي سبق ذكرها والتي تحتوي على اقل من 5% من كمية الحمض النووي المفروض تواجدها في خلايا G1 و G0 الثانوية تعتبر اجسام مسستميتة وليست خلايا مستميتة.
مراجع
- Van Dilla MA, Trujillo TT, Mullaney PF, Coulter JR (14 March 1969). "Cell Microfluorometry: A Method for Rapid Fluorescence Measurement". Science. 163 (3872): 1213–1214. doi:10.1126/science.163.3872.1213. PMID 5812751
- Krishan A. (July 1975). "Rapid flow cytofluorometric analysis of mammalian cell cycle by propidium iodide staining". The Journal of Cell Biology. 66 (1): 188–193. doi:10.1083/jcb.66.1.188. PMC 2109516. PMID 49354.
- Darzynkiewicz Z, Traganos F, Melamed MR. (1980) New cell cycle compartments identified by multiparameter flow cytometry. Cytometry 1:98-108. PMID 6161370
- Darzynkiewicz Z, Gong JP, Juan G, Ardelt B, Traganos, F. (1996) Cytometry of cyclin proteins. Cytometry 25:1-13, PMID 8875049 doi:10.1002/(SICI)1097-0320(19960901)25:1<1::AID-CYTO1>3.0.CO;2-N
- Gray JW, Dolbeare F, Pallavicini MG, Beisker W, Waldman F. (1986) Cell cycle analysis using flow cytometry. Int J Radiat Biol Relat Stud Phys Chem Med. Feb;49(2):237-55. PMID 3510993.
- Buck SB, Bradford J, Gee KR, Agnew BJ, Clarke ST, Salic A. (2008) Detection of S-phase cell cycle progression using 5-ethynyl-2'-deoxyuridine incorporation with click chemistry, an alternative to using 5-bromo-2'-deoxyuridine antibodies. Biotechniques. Jun;44(7):927-9. doi: 10.2144/000112812. PMID 18533904
- Vindeløv LL, Christensen IJ, Nissen NI (March 1983). "A detergent-trypsin method for the preparation of nuclei for flow cytometric DNA analysis". Cytometry. 3 (5): 323–327. doi:10.1002/cyto.990030503. PMID 6188586.
- Sharpless T, Traganos F, Darzynkiewicz Z, Melamed MR. (1975) Flow cytofluorimetry: discrimination between single cells and cell aggregates by direct size measurements. Acta Cytol. 19(6):577-81. PMID 1108568
- Wersto RP, Chrest FJ, Leary JF, Morris C, Stetler-Stevenson MA, Gabrielson E (15 October 2001). "Doublet discrimination in DNA cell-cycle analysis". Cytometry. 46 (5): 296–306. doi:10.1002/cyto.1171. PMID 11746105.
- Nicoletti I, Migliorati G, Pagliacci MC, Grignani F, Riccardi C (3 June 1991). "A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry". Journal of Immunological Methods. 139 (2): 271–279. doi:10.1016/0022-1759(91)90198-O. PMID 1710634.
- Riccardi C, Nicoletti I (9 November 2006). "Analysis of apoptosis by propidium iodide staining and flow cytometry". Nature Protocols. 1 (3): 1458–1461. doi:10.1038/nprot.2006.238. PMID 17406435
- Darzynkiewicz Z, Bedner E, Traganos F. (2001) Difficulties and pitfalls in analysis of apoptosis. Methods Cell Biol 63:527-559, PMID 11060857
- بوابة تقانة
- بوابة صحة
- بوابة طب
- بوابة الكيمياء