دورة الخلية
دورةُ (انقسامِ) الخليةِ هي الأطوار المتتابعة من النمو والانقسام التي تحدث للخلية في الفترة الزمنية الواقعة بين انقسامين متتاليين وتختلف مدة هذة الفترة من خلية إلى أخرى.[1][2][3]

تستمر دورة الخلية لمدة أقلها 12 ساعة، ولا تنتقل الخلية من المرحلة التمهيدي حتى تجهز المركبات الكيميائية التي تحتاجها للانقسام من أحماض أمينية وليبيدات وسكريات ولذلك يعتمد وقت وسرعة انقسام الخلية على كمية المواد الغذائية التي يتلقاها الجسم. تمر معظم الخلايا بأربع مراحل وهي المرحلة التمهيدية تليها المرحلة الاستوائية ثم المرحلة الانفصالية وأخيرا المرحلة النهائية وهكذا تكون الخلية قد انقسمت وشكلت خليتين بنتين.
الأطوار
تتكون دورة الخلية من طورين متبادلين هما الطور البيني وطور الانقسام الخلوي.
- أولاً: الطور البيني (بالإنجليزية: Interphase): ويستغرق 90% من زمن الدورة، ويتضمن ثلاث فترات هي:
- طور النمو الأول: فيه يتضاعف عدد عضيات الخلية وانزماتها وبالتالي يزداد حجم الخلية.
- طور التركيب: يتضاعف الحمض النووي الريبي منقوص الأكسجين
- طور النمو الثاني: تنمو الخلية سريعا تأهبًا للانقسام
- ثانيا: طور الانقسام الخلوي
يوجد نوعان من الانقسام الخلوي هما الانقسام غير المباشر والانقسام الاختزالي والذي ينتهي بتكوين خليتين، تدخل كل خلية منهما طورا بينيا جديدا.
الطور جي صفر (طور السكون)

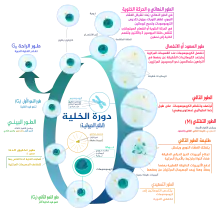
الطور جي صفر هو طور راحة، إذ تغادر الخلية الدورة الانقسامية وتتوقف عن الانقسام. تبدأ الدورة الانقسامية الخلوية بهذا الطور. تستخدم عبارة «الطور ما بعد الانقسام الفتيلي» أحيانًا للإشارة إلى كل من الخلايا الساكنة والخلايا الهرمة. تدخل الخلايا غير المتكاثرة (غير المنقسمة) في حقيقيات النوى عديدة الخلايا بشكل عام إلى الطور جي صفر الساكن من جي 1 وقد تبقى ساكنة لفترة زمنية طويلة أحيانًا وربما إلى الما لا نهاية (كما هو الحال في كثير من الأحيان بالنسبة للأعصاب). هذا شائع جدًا بالنسبة للخلايا المتمايزة بشكل كامل. تحصل الشيخوخة الخلوية كاستجابة لتضرر الحمض النووي والإجهاد الخارجي وعادةً ما تسبب توقف في الطور جي 1. تدخل بعض الخلايا الطور جي صفر بشكل شبه دائم وتعتبر في طور ما بعد الانقسام الفتيلي مثل بعض خلايا الكبد والمعدة والكلى. العديد من الخلايا لا تدخل الطور جي صفر وتستمر بالانقسام طوال حياة الكائن الحي كالخلايا الظِهَارِيّة على سبيل المثال.
الشيخوخة الخلوية هي أيضًا حالة تحدث كاستجابة لتضرر الحمض النووي أو تَدَرُّكه مما يجعل سلالة الخلية لَاعَيُوشة، وهي غالبًا ما تكون بديلًا كيميائيًا حيويًا لتدمير الخلية لنفسها من خلال الاستماتة.
الطور البيني
الطور البيني عبارة عن سلسلة من التغيرات التي تطرأ على الخلية المتشكلة حديثًا ونواتها قبل أن تصبح قادرة على الانقسام مرة أخرى. ويسمى أيضًا الطور التحضيري أو الطور بين مراحل الانقسام الفتيلي. يدوم الطور البيني عادةً لما لا يقل عن 91% من المدة الإجمالية لدورة حياة الخلية.
يشتمل الطور البيني على ثلاثة أطوار وهي جي 1 وإس وجي 2 يليه دورة الانقسام الفتيلي والانقسام السيتوبلازمي. تتضاعف محتويات نواة الخلية من الحمض النووي خلال الطور إس (طور التركيب).
الطور جي 1 (طور النمو الأول أو طور فجوة ما بعد الانقسام الفتيلي)
يسمى الطور الأول خلال الطور البيني من نهاية المرحلة إم السابقة إلى بداية تركيب الحمض النووي جي 1 (جي تشير إلى الفجوة). ويسمى أيضًا طور النمو. تُستأنف خلال هذه المرحلة الأنشطة الحيوية للخلية، التي تباطأت إلى حد كبير خلال الطور إم، بمعدل مرتفع. تتفاوت مدة الطور جي 1 بشكل كبير، حتى بين الخلايا المختلفة من نفس النوع. تزيد الخلية في هذا الطور إمدادها من البروتينات وتزيد من عدد عضيّاتها (كالميتاكوندريا والريبوسومات) ويزداد حجمها. يوجد أمام الخلية في الطور جي 1 ثلاثة خيارات.
- متابعة الدورة الخلوية والدخول في طور التركيب
- إيقاف الدورة الخلوية والدخول في الطور جي صفر والخضوع للتمايز
- التوقف في الطور جي 1 وبالتالي إما أن تدخل في الطور جي صفر أو تعيد الدخول في الانقسام الخلوي.
تسمى نقطة التقرير بنقطة التحقق (نقطة التقييد). تسمى نقطة التحقق هذه بنقطة التقييد أو ستارت وتُنظم من قبل ساكلينات إس/جي 1 التي تسبب الانتقال من الطور جي 1 إلى طور التركيب. عبور نقطة التحقق في جي 1 يُلزم الخلية بالانقسام.
الطور إس (طور تضاعف الحمض النووي)
يبدأ الطور إس اللاحق عندما يبدأ تركيب الحمض النووي، عندما ينتهي تكون كل الصبغيات قد انقسمت أي أن كل صبغي يتكون من زوج من الصبيغيات. وهكذا وخلال هذا الطور فإن كمية الحمض النووي في الخلية تكون قد تضاعفت، على الرغم من أن الصِّيغَةُ الصِّبْغِيَّة وعدد الصبغيات لم يتغير. تكون معدلات انتساخ الحمض النووي الريبي وتصنيع البروتين متدنية جدًا خلال هذا الطور. الاستثناء الوحيد هو تصنيع الهيستون الذي يتم بمعظمه خلال هذا الطور.[4][5][6]
الطور جي 2 (طور النمو)
يحصل الطور جي 2 بعد تضاعف الحمض النووي وهي مرحلة من تصنيع البروتين وتسارع في نمو الخلية لتحضير الخلية للانقسام الفتيلي. خلال هذا الطور تبدأ الأُنَيبوبات الميكروية بإعادة التنظيم لتشكل المغزل (مرحلة ما قبل الطور التمهيدي). يجب أن يتم التحقق من الخلايا في نقطة التحقق في جي 2 قبل الشروع بالانقسام الفتيلي وذلك للتحقق من أي أعطاب في الحمض النووي في الصبغيات. تُنظم نقطة التحقق في جي 2 من قبل البروتين الورمي بّي 53. في حال وجود أعطاب في الحمض النووي فسيقوم البّي 53 إما بإصلاحه أو بتحريض الاستماتة. في حال كان بّي 53 غير وظيفي أو طافر فقد تتابع الخلايا ذات الحمض النووي المعطوب الدورة الانقسامية مما سيؤدي إلى نشوء السرطان.
طور الانقسام الفتيلي (انفصال الصبغيات)
يتكون الطور إم القصير نسبيًا من الانقسام النووي. هذا الطور معقد ومنظم للغاية. ينقسم تسلسل الأحداث إلى أطوار تقابل إكمال مجموعة واحدة من الأنشطة وبداية المرحلة التالية. تُعرف هذه الأطوار على التتابع بالأسماء التالية:

الانقسام الفتيلي هو مرحلة تفصل بها الخلية حقيقية النواة الصبغيات ضمن نواتها إلى مجموعتين متطابقتين ضمن نواتين.[7] أثناء عملية الانقسام الفتيلي تتكثف الصبغيات وتتعلق على الأُنَيبوبات الميكروية التي تسحب الصبيغيات الشقيقة إلى جانبي الخلية.[8]
يحصل الانقسام الفتيلي في حقيقيات النوى حصرًا ولكن يحدث بطرق مختلفة ضمن الأنواع المختلفة. على سبيل المثال، تخضع الخلايا الحيوانية لانقسام فتيلي «مفتوح» حيث يتفكك الغلاف النووي قبل أن تنفصل الصبغيات، في حين أن الفطريات مثل الرَّشَّاشِيَّةُ المُعَشِّشَة والسُّكَيراءُ الجِعَوِيَّة تخضع لانقسام فتيلي «مغلق» حيث تنقسم الصبغيات ضمن نواة خلوية سليمة الغشاء.[9]
طور انقسام السيتوبلازم (فصل جميع مكونات الخلية)
يتبع الانقسام الفتيلي مباشرةً بانقسام السيتوبلازم الذي يقسم النواة والسيتوبلازما والعضيات وغشاء الخلية إلى خليتين تحتويان على حصص متساوية تقريبًا من هذه المكونات الخلوية. يحدد الانقسام الفتيلي وانقسام السيتوبلازم معًا انقسام الخلية الأم إلى خليتين متطابقتين وراثيًا بالنسبة لبعضهما وللخلية الأم. هذا يمثل حوالي 10% من الدورة الخلوية.
نظرًا لأن الانقسام السيتوبلازمي عادةً ما يحصل بالتزامن مع الانقسام الفتيلي فيُستخدم مصطلح طور الانقسام الفتيلي بالتبادل مع الطور إم. مع ذلك فهناك العديد من الخلايا التي يحصل فيها الانقسام الفتيلي والانقسام السيتوبلازمي بشكل منفصل، وتشكل خلايا وحيدة مع نوى متعددة ضمن عملية تسمى Endoreduplication. يحصل هذا بشكل ملحوظ بين الفطريات والعفن الغروي ولكن يوجد في مجموعات مختلفة. حتى لدى الحيوانات، قد يحصل الانقسام الفتيلي والانقسام السيتوبلازمي بشكل منفصل، على سبيل المثال خلال مراحل معينة من تطور ذبابة الفاكهة الجنينية.[10] يمكن أن تؤدي الأخطاء في الانقسام الفتيلي إلى موت الخلية عبر الاستماتة أو حدوث الطفرات التي تؤدي إلى السرطان.
نقاط التحقق
تُستخدم نقاط التحقق الخلوية من قبل الخلية لمراقبة وتنظيم سير عملية الدورة الخلوية.[11] تمنع نقاط التحقق استمرار الدورة الخلوية عند نقاط معينة مما يسمح بالتحقق من نقاط ضرورية في أطوار معينة وإصلاح أعطاب الحمض النووي. لا يمكن أن تنتقل الخلية إلى المرحلة التالية في حال لم تحقق متطلبات عبور نقطة التحقق. تتكون نقاط التحقق عادةً من شبكة من البروتينات المنظمة التي تراقب وتفرض تقدم الخلية خلال المراحل المختلفة من الدورة الخلوية.
هناك العديد من نقاط التحقق وذلك لضمان عدم انتقال الحمض النووي الضعيف أو التالف إلى الخلايا البنات. توجد ثلاث نقاط تفتيش رئيسية: النقطة جي 1/إس، النقطة جي 2/إم ونقطة الطور التالي (الفتيلي).
الانتقال جي 1/إس هو مرحلة محددة للسرعة في الدورة الخلوية ويعرف أيضًا باسم نقطة التقييد.[12] هذه هي النقطة التي تقوم الخلية عندها بالتحقق فيما إن كان لديها ما يكفي من المواد الخام لتنسخ الحمض النووي بشكل كامل (الأسس النيكليوتيدية، سينثاز الحمض النووي، الكروماتين إلخ). الخلية المعطوبة أو غير السليمة ستعلق عند نقطة التحقق هذه.
نقطة التحقق جي 2/إم هي النقطة التي تضمن عندها الخلية أنها تحوي ما يكفي من السيتوبلازما والفوسفوليبيدات لإنتاج خليتين بنتين. ولكن الأهم من ذلك في بعض الأحيان أنها تتحقق لمعرفة فيما إذا كان هذ هو الوقت المناسب للانتساخ. هناك بعض الحالات التي تحتاج فيها العديد من الخلايا أن تنتسخ بوقت واحد (على سبيل المثال، يجب أن يكون للجنين في طور التشكل توزيع متناظر للخلايا إلى أن يبلغ نقطة الأُرَيمَة الوسطى). يتم هذا عن طريق التحكم بنقطة جي2/إم.
نقطة الطور التالي هي نقطة تحقق بسيطة إلى حد ما إذ أنه بمجرد أن تكون الخلية قد بلغت الطور التالي فإنها ستخضع للانقسام حكمًا. مع ذلك فهذا لا يعني أنها غير مهمة. تقوم الخلية في نقطة التحقق هذه بالتحقق فيما إذا كان المغزل قد تشكل وأن جميع الصبغيات مصطفة بمحاذاة المغزل قبل بدء طور الصعود.[13]
في حين أن هذه هي نقاط التفتيش الرئيسية الثلاث إلا أنه ليس بالضرورة أن تمر بها كل الخلايا بهذا الترتيب في كل انتساخ. تتسبب أنواع كثيرة من السرطان بحدوث طفرات تسمح للخلايا بعبور نقاط التحقق بسرعة أو بتجاوزها بالكامل حتى. والانتقال من الطور إس إلى الطور إم إلى الطور إس على التوالي تقريبًا. لأن هذه الخلايا قد خسرت نقاط التحقق فسيتم تجاهل أي طفرات في الحمض النووي وستمرر إلى الخلايا البنات. هذا هو سبب ميل الخلايا السرطانية إلى مراكمة الطفرات بشكل أسي. بصرف النظر عن الخلايا السرطانية، هناك العديد من الخلايا المتمايزة بالكامل التي لا تنتسخ بعد ذلك وتبقى في الطور جي صفر إلى حين موتها، مما يُلغي الحاجة إلى نقاط التحقق. اقترح نموذج بديل لاستجابة الدورة الخلوية إلى تلف الحمض النووي ويُعرف باسم نقاط التحقق ما بعد الانتساخ.
يلعب تنظيم نقاط التحقق دورًا مهمًا في تطور الكائن الحي. في التكاثر الجنسي وعندما تُخصّب البويضة وعندما يرتبط الحيوان المنوي بالبيضة فإنه يطلق إشارات تُعلم البويضة أنها خُصّبت. من بين أمور أخرى، هذا يحث الخَلِيَّةُ البَيضِيَّة الملقحة على العودة من حالتها السابقة، حالة السكون أو جي صفر، إلى الدورة الخلوية ومتابعة الانقسام الفتيلي والانشطار.
يلعب بّي 53 دورًا هامًا في تحريض آليات التحكم في كل من نقاط التحقق جي 1/إس وجي 2/إم. بالإضافة إلى بّي 53 فإنه يتم البحث في منظمات نقاط التحقق ودورها في نمو السرطان وانتشاره بشكل مكثف.
ملاحظات
- إن خلايا أجسامنا تنقسم بمعدل ملايين الخلايا في الثانية، ولكن لاتنقسم الخلايا كلها بالمعدل نفسه، وبعضها لا ينقسم إلا أثناء النمو ثم يتوقف، أسرع الخلايا انقسامًا هي التي تبطن الأمعاء الدقيقة، فهي تنقسم كل بضعة أيام. أما خلايا الجلد فتنقسم كل بضعة أسابيع.
- يموت كل يوم حوالي 2% من خلايا الإنسان البالغ، وهذا يعني أن هذه الكمية قد تصل إلى 18 مليون خلية كل ثانية.
- يؤدي الخلل في تتابع دورة الخلية إلى انقسام الخلايا بسرعة ودون تحكم مما يؤدي إلى وجود الخلايا السرطانية أو الخبيثة.
انظر أيضًا
مراجع
- Rodriguez EA, Tran GN, Gross LA, Crisp JL, Shu X, Lin JY, Tsien RY (سبتمبر 2016)، "A far-red fluorescent protein evolved from a cyanobacterial phycobiliprotein"، Nature Methods، 13 (9): 763–9، doi:10.1038/nmeth.3935، PMC 5007177، PMID 27479328.
- Presentation on CDC25 PHOSPHATASES: A Potential Target for Novel Anticancer Agents [وصلة مكسورة] نسخة محفوظة 03 مارس 2016 على موقع واي باك مشين.
- Champeris Tsaniras S, Kanellakis N, Symeonidou IE, Nikolopoulou P, Lygerou Z, Taraviras S (يونيو 2014)، "Licensing of DNA replication, cancer, pluripotency and differentiation: an interlinked world?"، Seminars in Cell & Developmental Biology، 30: 174–80، doi:10.1016/j.semcdb.2014.03.013، PMID 24641889.
- Wu RS, Bonner WM (ديسمبر 1981)، "Separation of basal histone synthesis from S-phase histone synthesis in dividing cells"، Cell، 27 (2 Pt 1): 321–30، doi:10.1016/0092-8674(81)90415-3، PMID 7199388.
- Nelson DM, Ye X, Hall C, Santos H, Ma T, Kao GD, Yen TJ, Harper JW, Adams PD (نوفمبر 2002)، "Coupling of DNA synthesis and histone synthesis in S phase independent of cyclin/cdk2 activity"، Mol. Cell. Biol.، 22 (21): 7459–72، doi:10.1128/MCB.22.21.7459-7472.2002، PMC 135676، PMID 12370293.
- Cameron IL, Greulich RC (يوليو 1963)، "Evidence for an essentially constant duration of DNA synthesis in renewing epithelia of the adult mouse"، J. Cell Biol.، 18: 31–40، doi:10.1083/jcb.18.1.31، PMC 2106275، PMID 14018040.
- Rubenstein, Irwin, and Susan M. Wick. "Cell." World Book Online Reference Center. 2008. 12 January 2008 <"Archived copy"، مؤرشف من الأصل في 30 مايو 2011، اطلع عليه بتاريخ 10 يوليو 2009.
{{استشهاد ويب}}: صيانة CS1: الأرشيف كعنوان (link)> - Maton, Anthea؛ Lahart, David؛ Hopkins, Jean؛ Warner, Maryanna Quon؛ Johnson, Susan؛ Wright, Jill D. (1997)، Cells: Building Blocks of Life، New Jersey: Prentice Hall، ص. 70–4، ISBN 978-0-13-423476-2، مؤرشف من الأصل في 2 فبراير 2020.
- De Souza CP, Osmani SA (سبتمبر 2007)، "Mitosis, not just open or closed"، Eukaryotic Cell، 6 (9): 1521–7، doi:10.1128/EC.00178-07، PMC 2043359، PMID 17660363.
- Lilly MA, Duronio RJ (أبريل 2005)، "New insights into cell cycle control from the Drosophila endocycle"، Oncogene، 24 (17): 2765–75، doi:10.1038/sj.onc.1208610، PMID 15838513.
- Elledge SJ (ديسمبر 1996)، "Cell cycle checkpoints: preventing an identity crisis"، Science، 274 (5293): 1664–72، Bibcode:1996Sci...274.1664E، doi:10.1126/science.274.5293.1664، PMID 8939848.
- Robbins, Stanley L؛ Cotran, Ramzi S (2004)، Kumar, Vinay؛ Abbas, Abul K؛ Fausto, Nelson (المحررون)، Pathological Basis of Disease، إلزيفير، ISBN 978-81-8147-528-2.
- LeMaire-Adkins R, Radke K, Hunt PA (ديسمبر 1997)، "Lack of checkpoint control at the metaphase/anaphase transition: a mechanism of meiotic nondisjunction in mammalian females"، The Journal of Cell Biology، 139 (7): 1611–9، doi:10.1083/jcb.139.7.1611، PMC 2132649، PMID 9412457.
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الأحياء التطوري
- بوابة علوم