تدخل الرنا
تدخل الرنا (بالإنجليزية: RNAi) أو تداخل الرنا أو تداخل الحمض النووي الريبي (بالإنجليزية: Ribonucleic Acid Interference) اختصارًا: (بالإنجليزية: RNA interference (RNAi))؛ هو عملية بيولوجية يتم من خلالها تثبيط التعبير الجيني في جزيئات الرنا، ويحدث عادة بسبب تخريب جزيئات محددة في ناقل الشفرة الوراثية (mRNA) وقد عرفت هذه العملية تاريخياً بأسماء أخرى مثل " المشاركة في الإعاقة" و" سكون جينات مابعد النسخ" و"التهدئة" إلى أن تم فهم هذه العملية بعدما كانت تبدو غير مترابطة، وأصبح جلياً أنها تصف ظاهرة "تداخل الرنا". في عام 2006 تشارك آندرو فاير وكريغ فيلو جائزة نوبل في الفسيولوجيا -علم وظائف الأعضاء- أو الطب عن دراسة نشراها في العام 1998 وقدما فيها بحثاً عن تداخل الرنا في الربداء الرشيقة إحدى الديدان الخيطية.

يوجد نوعين لجزيئات الحمض الريبي النووي الصغيرة (RNA) والتي تشكّل أساساً لعملية تداخل الرنا وهي جزيئات الحمض النووي الريبي الميكروية (miRNA) وجزيئات الحمض النووي الريبي المتداخلة الصغيرة (siRNA)، تعدّ الرناوات منتجات مباشرة للجينات، وبذلك تتمكن جزيئات الرناوات الصغيرة من الارتباط بجزيئات محددة من مرسال الرنا مما يؤثر عليها إما بزيادة أو تقليل نشاطها، ومثال على ذلك منع مرسال الرنا من إنتاج البروتين. إن عملية تداخل الرنا لها دور مهم في الدفاع عن الخلايا ضد سلاسل النوكليوتيد الطفيلي أي الفيروسات والنيقولات، كما أن لها دور في توجيه عملية النماء (التطور) كما هو دورها في التعبير الجيني بشكل عام.
العملية الخلوية
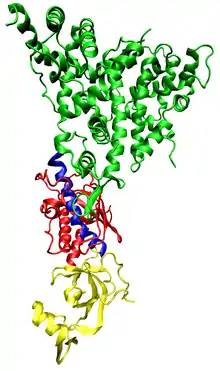
تداخل الحمض النووي الريبي (RNAi) هو عملية سكون الجينات التابعة للحمض النووي الريبي (RNA) والتي ينظمها الحمض النووي الريبي الذي يزيد من هدوء وسكون المركب (RISC)، وكذلك هي العملية التي ابتدأتها جزئيات الحمض النووي الريبي القصيرة والمجدولة ازدواجياً في سيتوبلازم الخلية حيثما تتفاعل مع المكونات المحفزة للحمض النووي الريبي المؤدي لسكون المركب المعقد (RISC).[1]
عندما تكون جزئيات الحمض النووي المزدوجة والمجدولة مع بعضها (dsRNA) خارجية أي قادمة من عدوى عن طريق فيروس مع جينات الحمض النووي الريبي أو من تلاعب في المختبر، فإنه يتم استيراد الحمض النووري الريبي (RNA) مباشرة من السيتوبلازم والمنشطر إلى أجزاء قصيرة بواسطة الإنزيم، وكذلك عند بداية جزيئات الحمض النووري الريبي المزدوجة والمجدولة مع بعضها (dsRNA) يمكنها أن تكون باطنية النمو بأن يكون منشأها داخل الخلية كما هو الحال في بداية الأحماض النووية الريبية الصغيرة (microRNAs) التي تبدي النمط الظاهري من ترميز الجينات في مجموعة العوامل الوراثية؛ وسلسلة الحمض النووي الريبي (RNA) الأولية من جينات هائلة هي أول عملية لتنظيم هيكل الحلقة الجذعية المميز في بداية الأحماض النووية الريبية الصغيرة (microRNAs) في النوية، ثم يخرج إلى السيتوبلازم ليكون منشطر بواسطة إنزيم دايسر (Dicer)، ولهذا فإن كلا الطريقتين الداخلية والخارجية تتلاقيان في مركب الحمض النووي الريبي المؤدي لسكون المركب.[2]
انشطار الحمض النووي الريبي المزدوج (dsRNA)
الحمض النووي الريبي المزدوج الباطني (dsRNA) يحفز تداخل الحمض النووي الريبي (RNAi) (وهو عملية بيولوجية التي تمنع جزيئات RNA من التغير الجيني) عن طريق تفاعل الإنزيم دايسر (Dicer) [3] الذي يعمل على تشكيل رابطة كيميائية وانشطار الأجزاء الصغيرة المنتجة مباشرة من الحمض النووي الريبي المزودج (dsRNA) لتنتج سلاسل مزدوجة منفصلة إلى 20-25 أزواج رئيسية مع ثنائي النواة وتكون متصلة في آخر الجزء الثالث.[4][5][6][7] وقد اقترحت الدراسات الحيوية على المعلومات الوراثية للكائنات الثنائية أشارت إلى أن هذا الطول يزيد الجين المستهدف خصوصا ويقلل التأثيرات الغير محددة.[8] وتسمى تلك السلاسل المزدوجة المنفصلة بالأحماض النووية الريبية صغيرة التداخل (siRNA) وهذه الخلايا الثنائية القصيرة يتم فصلها بعد ذلك إلى أحادية البنية ودمجها مع الحمض النووي الريبي المعقد الذي يزيد من سكون المركب (RISC) وبعد الاندماج في الحمض النووي الريبي الزائد من سكون المركب (RISC)، زوجان أساسيان من الحمض النووي الريبي صغير التداخل (siRNAs) وفقاً لناقل الشفرة الوراثية (mRNA) ويزيد من إنتاجية انقسام الناقل (mRNA) وبالتالي يمنع من استخدامها في عملية تصنيع البروتين[9]
والحمض النووي الريبي المزدوج خارجي النمو محمي ومترابط بواسطة بروتين مستجيب يعرف بـ (RDE-4) في الديدان الخيطية وبـ (R2D2) في الذباب الصغير والذي يحفز من فعالية إنزيم دايسر (dicer) [10] وهذا البروتين الوحيد التي يرتبط على طول الحمض النووي الريبي المزدوج dsRNAs)) ولكن الطريقة المتبعة تنتج هذا الطول تحديدا كالغير معروف ويسهل كذلك من نقل أجزاء الحمض النووي الريبي صغير التداخل (siRNA) إلى الحمض النووي الريبي المعقد (RISC) [10] This RNA-binding protein then facilitates the transfer of cleaved siRNAs to the RISC complex.[11]
في الديدان الخيطية بدأ هذه العملية يتزايد عن طريق تركيب مجاميع الحمض النووي الريبي صغير التداخل الثانوي (siRNAs) خلال عملية إنتاج إنزين دايسر أو الحمض النووي الريبي صغير التداخل الأولي (siRNAs) الذي يستخدم كجزيئات.[12] والحمض النووي الريبي صغير التداخل الثانوي مختلف تماماً عن إنتاج الحمض النووي الريبي صغير التداخل لإنزيم دايسر ويظهر لينتج عن طريق الحمض النووي الريبي المعتمد على البلمرة_الحمض النووي الريبي المنتسخ_ (RdRP).[13][14]
الأحماض النووية الريبية الصغيرة

يعمل الحمض النووي الريبي الصغير (miRNA) على ترميز الرنا غير المرمز بطريقة جينومية وهذا بدوره يساعد على ضبط التعبير الجيني وخصوصاً أثناء عملية النماء.[15][16] إن ظاهرة تداخل الرنا بصورة عامة تتضمن تأثيرات إسكات الجينات المحرضة المتطورة طبيعياً في ميكرو الرنا وكذلك آثار الإسكات عن طريق رنا ذو نطاقين غريب. إن الميكرو رنا الناضج مماثل في تركيبته للرنا المتدخل الصغير الذي ينتج من رنا ذي نطاقين خارجي، ولكن قبل وصول الميكرو رنا للنضج فإنه يجب أن يجتاز عملية معالجة الرنا (تحويل النسخة الأولية). إن الميكرو رنا يعبر عنه بترميز جيني أكثر طولاً كنسخة أولية تعرف بـ "الميكرو رنا الأولي" الذي يتم معاجته في نواة الخلية بواسطة معالجات دقيقة معقدة لتحوله إلى ما يسمّى ب "الميكرو رنا السابق" الذي يتكون من 70 نيوكليتيد ذو تركيب حلقي جذعي. هذه المكونات المغقدة لإنزيم الريبوكلياز تسمى بروتين دروشا وبروتين باشا (DGCR8). إن بروتين الحمض النووي الريبي المزدوج لهذا "الميكرو رنا السابق" يكون مرتبط وملتصق بإنزيم دايسر لينتج جزيء الميكرو رنا الناضج التي يمكن أن يندمج مع (الرنا-مركب الإسكات والتحفيز) وهكذا فإن الميكرو رنا والرنا المتدخل الصغير يتشاركان نفس آلية المجرى السفلي الخلوية في عملية المعالجة الأولية.[17]
إن الرنا المتدخل الصغير ينشأ من مجموعة سابقة طويلة من الرنا ذي النطاقين تختلف عن الميكرو رنا في ذلك الميكرو رنا، وخاصة في الحيوانات، عادة يكون فيهم ازدواج القواعد غير مكتمل وذلك بهدف منع ترجمة مراسيل رنا كثيرة مختلفة بنفس المتتاليات.[18] وفي المقابل يكون زوج القوعد في الرنا المتدخل الصغير مكتملاً ويحث مرسال الرنا على الانقسام في هدف محدد ومنفرد. في ذبابة الفاكهة وفي الربداء الرشيقة يعالج الميكرو رنا والرنا المتدخل الصغير بواسطة بروتينات محفزة مستقلة وبزاسطة انزيم دايسر.[19][20]
تنشيط وتحفيز RISC
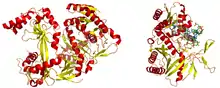
تعتبر أنزيمات الإندونيوكليزيز endonucleases المركب النشط والذي يكون (RISC) وهي ماتسمى ببروتينات الأرجونات argonaute proteins والتي تقوم بعملية شطر خيط الحامض النووي الريبوزي الرسول (mRNA) المستهدف والمكمل لـ (si RNA). تكون الخيوط العشوائية الناتجة عبارة عن خيوط مزدوجة. ونظريا يمكن لهذه الخيوط إنتاج (si RNA). لكن واحد فقط من هذه الخيوط والذي يعرف باسم الخيط القائد يمكنه أن يرتبط ببروتين الأرجونات ويقوم بعملية إسكات الجين. أما الخيط الثاني والمضاد للخيط القائد فإنه يحدث له عملية تحلل أثناء تفعيل (RISC).[21] وان كان يعتقد في البدء أن أنزيم الهيليكاز والمعتمد على مركب أدونيسين ثلاثي الفوسفات (ATP-dependent helicase) هو الذي يقوم بعملية فصل الخيطين،[22] ولكن في الواقع فإن هذه العملية لا تعتمدإطلاقا على مركب (ATP) وتنشط بفعل التراكيب البروتينية في (RISC).[23][24] ومع ذلك فإن التجارب المعملية على ميكانيكية عمل (RNAi) في وجود مركب (ATP) من عدمه أشارت إلى أن مركب (ATP) قد يتطلب وجوده في عملية الفصل بين الخيطين المكونة للحامض النووي الريبوزي الرسول (mRNA) وإزالته من مركب (RISC) بعد عملية التفاعل.[25] والخيط الذي تم اختياره ليكون الخيط القائد تتميز نهايته 5' بعدم ثباتها وارتباطها بمكملها،[26] لكن عملية اختيار الخيط لاتعتمد على الاتجاه الذي تتم فيه عملية انشطار الخيط المزدوج من (ds RNA)، وقبل التحامه مع مركب (RISC).[27] وبدلا من ذلك قد يقوم بروتين (R2D2) بمثابة عامل التفريق حيث يرتبط بالنهاية 5' في الخيط المكمل للخيط القائد.[28]
هيولي – الخلية وقد تم اقتباس هذا المصطلح من الصفحة العربية له في ويكيبيديا
تمت دراسة الأسس الهيكلية اللازمة لربط RNA مع البروتين الأرجونتي عن طريق دراسة البلورات بالأشعة السينية لمجال ارتباط RNA بالبروتين الأرجونتي. يدخل حينها الطرف الخامس من RNA والمتحول إلى فسفور في السطح الجيبي الأساسي المحجوز، الذي يقوم بالاتصال من خلال الأيون الديفلنتي (ذرة بشحنتين موجبتين) مثل المغنيزيوم وذلك عن طريق الاصطفاف العطري (عملية كيميائية تسمح لأكثر من ذرة بمشاركة الكترون وذلك عن طريق إرساله واستقباله بشكل متكرر) بين النيكلوتيد رقم 5 في RNA وبقايا التريزيون.
من المتوقع أن هذا الموقع هو الذي يشكل موقع التحول إلى نيكلوتيد والذي يتم فيه ارتباط siRNA بال miRNA الهدف.[29] أظهرت الدراسة التحليلية للتأثير المكتسب للأزواج المترابطة عن طريق الخطأ في النهاية الخامسة أو الثالثة للنهاية الجزيئية تحت الدراسة أن الحد الخامس هو المسؤول عن الارتباط والتزواج في الناقل للشفرة الوراثية، بينما الحد الثالث هو المسؤول عن الترتيب الفيزيائي للطرف الثالث الهدف الذي يساهم في تشكيل منطقة الريسك لصالح عملية الفصل في miRNA.[25]
من غير الواضح حتى الآن كيفية اكتشاف مركب الريسك الفعَال مكان تواجد miRNA التكميلي في الخلية. بالرغم من أنَ عملية الفصل قد يتم افتراض حدوثها بسبب عملية تحول الناقل للشفرة الوراثية (mRNA) والتي لا تعد ضرورية لعملية تفكك الوسيط لتداخل الحمض النووي الريبي (RNAi) [30]
في الواقع تداخل الأحماض النووية الريبية (RNAi) فد تكون أكثر فعالية من ناقل الشفرة الوراثية (mRNA)الذي لا ينتقل.[31] ولقد تم اكتشاف أنّ البروتينات الأرجونتية _العناصر المحفزة للحمضو النووي الريبي المسكن (RISC)، موجهة محلياً لمناطق معينة في هيولي الخلية والتي تعرف بـأجسام P أو أجسام هيولي الخلية والتي تعتبر من مناطق تفكيك RNAi بمستويات عالية.[32]
الإسكات النسخي

تستخدم مركبات تداخل RNA في العديد من الخلايا حقيقية النواة للحفاظ على تنظيم وتركيب الجينوم الخاص بها. يساعد تعديل الهستونات وحث تشكيل الهتروكروماتين في التقليل من الجينات قبل عملية النسخ؛[33] يُشار إلى هذه العملية بالإسكات النسخي RITS وتتم من خلال مجموعة معقدة من البروتينات التي تتكون في انشطار الخميرة من الأرجونات التي تتكون من بروتين يسمى Chp1 وآخر يسمى Tas3؛ البروتين مجهول الوظائف.[34] ونتيجة لذلك فإن تتطلب عملية الحث أرجونات وبروتينات RdRP.[35] في الواقع، حذف هذه الجينات في انشطار الخميرة يعطل مثيلة الهيستون ويشكل السنترومير،[36] مما يتسبب في تباطؤ أو توقف طور الصعود أثناء انقسام الخلية.[37] في بعض الحالات، لوحظ في عمليات مماثلة مرتبطة بتعديل الهيستونات زيادة عدد الجينات عن طريق النسخ.[38] الآلية التي يحث بها البروتين RITS الهتروكروماتين على التشكيل والتزاوج ليست مفهومة بشكل جيد. ركزت معظم الدراسات على التزاوج من نوع انشطار الخميرة، التي قد لا تكون ممثلة للأنشطة الجينية في الكائنات الأخرى. للحفاظ على تواجد الهتروكروماتين يُشكل البروتين RITS عقدة مع مكملة (siRNAscomplementary) الجينات المحلية والهستونات. يعتمد تشكيل الهتروكروماتين على المقامر وذلك قد يكون لكونه مطلوباً لتوليد التكملة الأولى siRNAs التي هي النسخ الهدف لاحقا.[39]
التداخل مع تحرير الحمض النووي الربيبي (RNA)
نوع تحرير الحمض النووي الريبي (RNA) هو الأكثر انتشاراً في الكائنات حقيقة النواة السائدة التي تحول نيوكليوتيد الأدينوسين إلى إينوسين في الحمض النووي الربيبي المزدوج (dsRNA) وذلك عن طريق إنزيم "نازعة أمين الأدينوسين"(ADAR) [40] والذي تم اقتراحه أول مرة في عام 2000م بأن تداخل الحمض النووي الريبي RNAi)) وتحرير مسارات الحمض النووي الريبي (A→I RNA) قد يتزاحما على سطح الحمض النووي الريبي المزدوج (dsRNA) _ السطح الذي ينمو عليه كائن حي أو يتصل به _ .[41] وبالفعل تخضع بعض بدايات الأحماض النووية الريبية الصغيرة (miRNAs) لتحرير الحمض النووي الريبي (RNA) [42][43] وهذه المكيانيكية قد تنظم تسلسل وتعبير الأحماض النووية الصغيرة miRNA)) الناضجة [43] وعلاوة على ذلك، فإن واحداً على الأقل من إنزيم "نازعة أمين الأدينوسين " (ADAR) الخاص بالثدييات يمكنه عزل الأحماض النووية صغيرة التداخل ((siRNA من مسار عناصر تداخل الأحماض النووية الريبية (RNAi) [44] ؛ ويصدر المزيد من الدعم لهذه النماذج من الدراسات التي أجريت على إنزيم نازعة أمين الأدينوسين الصفرية _ أي التي بلا قيمة _ على سلاسلات الديدان الخيطية وتشير إلى أن تحرير الحمض النووي الريبي (A→I RNA) قد يتفاعل عكسيا مع تداخل الحمض النووي الريبي لإخماد الطفرات باطنية النمو والطفرات المتنقلة[45]
التباين بين الكائنات الحية

الكائنات تختلف في قدرتها على تناول الحمض النووي الرايبوزي المزدوج الجديلة dsRNA واستخدامها في مسار الحمض النووي الرايبوزي المتداخل RNAi. تأثير الحمض النووي الرايبوزي المتداخل يمكن أن يكون نظامي أو وراثي في النباتات ودودة الربداء الرشيقة C. elegans وليس في ذبابة الفاكهة أو الثدييات. في النباتات يُعتقد أن الحمض النووي الرايبوزي المتداخل ينتشر عن طريق انتقال الحمض النووي الرايبوزي المتداخل الصغيرsiRNA بين الخلايا من خلال الرابطة الهيولية (قنوات في جدران الخلايا التي تمكِّن التواصل والنقل).[22] ويأتي التوريث من مثيلة من المحفزات المستهدفة من قبل RNAi؛ يتم نسخ النمط الجديد من الحامض في كل جيل جديد من الخلية.[46]
هناك تمييز واسع النطاق بين النباتات والحيوانات في إنتاج الحمض النووي الرايبوزي الصغير miRNA. ففي النباتات الحمض النووي الرايبوزي الصغير يكون عادة مكمل بشكل مثالي أو شبه مثالي للجين الهدف ويحث على إنتاج الحمض الرايبوزي الناقل mRNA وينشق ب RISC . بينما في الحيوانات الحمض الرايبوزي الصغير miRNA مختلف في التركيب ويؤدي إلى إحباط الإسنتساخ. بينما الـ miRNAs الخاصة بالحيوانات تميل لتكون أكثر تبايناً في التسلسل.[47] يمكن أن تنتج تفاعلات تحول دون البدء من عوامل الترجمة للـ RNA الرسول.[48]
بعض البروتوزوا وحيدة الخلية مثل الليشمينيا الكبيرة " leishmania major" وتريبانوسوما كروزي "Trypanosoma cruzi " تفتقد إلى مسار تداخل الحمض الريبي النووي - التداخل الرناوي RNAi.[49][50] كل أو اغلب المكونات مفقودة في بعض أنواع الفطريات وأوضح مثال لذلك فطريات الخميرة" saccharomyces cerevisiae".[51] بالرغم من ذلك، دراسه حديثة أوضحت وجود التداخل الرناوي في فصائل أخرى من الفطريات كال ساكرومايسيس كاتالي saccharomyces caatellii وكانديدا البيكانز candida albicans .
دلالات أخرى تشير إلى وجود نوعان من البروتينات المتعلقة بالتداخل الرناوي في S. castellii والتي تسهل هذا التداخل في فطريات الخميرة S. cerevisiae.[52] وهذا يدل على أن بعض الفطريات الكيسية والدعامية تفتقد إلى هذا التداخل وبالتالي البروتينات الضرورية لعملية تقطيع حمض الـ ار ان آي"RNA silencing" تكون قد فقدت بشكل تام في العديد من سلالات الفطريات وغالبا ذلك يعود إلى تطور طرق غير مألوفة بوظائف مشابهة أو فقدان بعض المميزات الاختيارية في جدران الخميرة.[53]
الأجهزة المرتبطة بالكائنات وحيدة الخلايا
عملية التعبير الجيني"Gene expression"
في الكائنات متعدده الخلايا تتآثر بنظام يعتمد على RNA مشابها نوعا ما لنظام التداخل الرناويRNAi.
شفرات الحمض الريبي النووي الجينية"RNA-encoding gene" تقوم بالتحكم بالحمض الريبي النووي المراسلRNAm بترجمة تلك الجينات بواسطة تكوين مكمَل للحمض الريبي النووي ثم ينفصل عنه ليكون الحمض الريبي النووي المراسلRNAm. وعلى الرغم من كل هذه المنظمات الرناوية إلا أنها لا تعتبر مماثلة لـ miRNA بسبب عدم وجود أنزيم "dicer"دايسر.[54] وقد اقتُرِح أن تداخل كريسبر "كريسبر interference "في الكائنات متعددة الخلايا متماثل للموجود في نظام التداخل الرناوي في وحيدات الخلية بالرغم من أنه لا يوجد أي تشابه في تركيب البروتينات للحمض الريبي النووي.[55]
الوظايف الحيوية
المناعة
التداخل الرناوي يعتبر جزء مهم وحيوي في الدفاع المناعي ضد الفيروسات أو أي مواد جينيه لأجسام غريبة، خصوصا في النباتات حيث أنها قد تمنع الانتشار الذاتي للينقولات.[56] النباتات مثل Adabidopsis thaliana ("أرابيدوبسيس ثاليانا) المطلق عليه إذن الفأر" تقوم بتمثيل العديد من التنادد _أي تشابه بين عضيات بسبب انحدارهم من جد مشترك_ أو الصفات المتشابهة المختصة بالتفاعل بطريقة مختلفة عندما يتعرض النبات لأنواع عديدة من الڤيروسات.[57] مع العلم أنه حتى قبل فهم التداخل الرناوي بشكل واضح، كان معروفا أن عملية إلغاء تنشيط الجين (gene silencing) في النباتات قد تنتشر في النبتة ذاتها على هيئة التأثير الكلي؟!![58]
و بالتالي قد تنتقل من الأصل إلى السلالة المطعمة (النبتة الاساس للنبات الجديد) بواسطة عملية تطعيم النباتات. منذ أن اكتشفت هذه الصفة وعرفت كأحد وسائل الجهاز المناعي المكتسب، سمحت للنبات بأن يستجيب للفايروس بعد المواجهة الأولية.[59] في عملية الاستجابة، العديد من فيروسات النباتات قامت بتطوير وسائلها لتثبيط استجاب التداخل الرناوي؛ وهذا يتضمن بروتينات الفايروس التي تربط قطع الحمض النووي الرايبوزي المزدوج بالفردي siRNA كالتي تتكون بواسطة نشاط انزيم ديسر (dicer)[60] بعض جينات النباتات تقوم بتمثيل أو تعريض siRNA من أجل الاستجابة في حال وجود التهابات بسبب أنواع محددة من البكتيريا،[61] هذا التآثير قد يكون نوعا من الاستجابة الكلية لمسبب المرض الذي يعمل على إخلال تنظيم أي عملية حيوية في النبات والذي يساعد في عملية الإصابة أو الالتهاب.[62]
بالرغم من أن الحيوانات بشكل عام تتعرض لانزيم Dicer (إنزيم مفتت) أقل من النباتات إلا أن التداخل الرناوي في بعض الحيوانات أظهر بعض الاستجابة لمضادات الفيروسات. في كلا نوعا ذبابة الفاكهة (البالغ والصغير)، أظهر التداخل الرناوي أهميته في المناعة الاساسية ضد الفيروسات وتتنشط ضد أي مسبب مرضي ك Drosophila X virus.[63][64] نفس دور المناعة موجود أيضا في ايليجانس (C.)elegans كبروتين ارجونايتي (argonaute) الذي يتنظم حين الاستجابة إلى الفيروسات والديدان اللذان يعملان على زيادة تمثيل التداخل الرناوي وبالتالي تقاوم الالتهاب الفايروسي.[65][66]
دور التداخل الرناوي في الجهاز المناعي الأساسي للثدييات غير مفهوم كليا بعد، وذلك قد يعود إلى كمية المعلومات الضئيلة المتوفرة، وعلى الرغم من ذلك وجود فيروسات قادرة على تثبيط استجابة عملية التداخل الرناوي قد يكون دلالة على أن التداخل الرناوي يعتمد على الجهاز المناعي في الثدييات ولكن هذه النظرية قد تبطل نظرا لضعف الأدلة والبراهين.[67][68]
هناك أيضا وظائف أخرى بديلة للتداخل الرناوي في الثدييات، على سبيل المثال هذا التداخل قد ظهر بواسطة فايروس الهربس الذي يعمل كمحفز للكروماتين المغاير الذي يؤدي إلى تعديل الفيروس الكامن[69]
قله (ضعف) عمل الجينات
التطور الطبيعي (المقصود به النمو والتكون) بقوم ب"تنشيط عمل" مايكرو الحمض الرايبي النوووي وهذا يتضمن كلا من الانترون و" المناطق الفاصله بين كل جين". التطور يلعب دور مهم في كبح ترجمة الجين[47] and in the regulation of.[70] وفي تنظيم النمو خصوصا في وقت التخلق والحفاظ على الخلايا الغير متمايزة أو المتباينة بشكل غير كامل كالخلايا الجذعيه.[70] هذه العملية تم تعريفها لأول مره في عام 1993 في c.elegans.[71]
و تم اكتشافها أيضاً في النبات، في نبته تدعى ارابيدوبسيس عندما وجد ان JAW microRNA" يدخل في تنظيم عدد من الجينات المسئوله عن تحديد شكل النبتة.[72] في النباتات، اغلب الجينات التي تنظم بواسطه مايكرو حمض الرايبو النووي تعتبر من عوامل عملية النسخ.[73] وبالتالي نشاط هذا الحمض يعتبر واسع حيث يمتد لكل شبكات للجين خلال فتره النمو بواسطة إحداث تعديلات لأهم الجينات المنظمة. وهذا يتضمن عوامل النسخ وبروتينات F-box.[74]
في اغلب الكائنات (وهذا يتضمن الإنسان)، ارتبط مفهوم مايكرو حمض الرايبو النووي بتكوين الأورام وعدم انتظام دورة حياة الخلية. في هذه الحالة يعمل الحمض كجين ورمي وجين مثبط للورم.[75]
عملية التطور
بناءً على التحليل القائم على التبسيط (parsimony-based) في علم الوراثة العرقي -دراسة العلاقات التطورية بين مجموعات الكائنات الحية، التي تُكتشف عبرَ التحاليل الجزيئية ودراسة تشكيل الكائنات المختلفة-، وجد أن أغلب المورثات في حقيقيات النوى (Eukaryote) على الأرجح تمر في مسار تداخل الحمض النووي الريبي المبكر، كما اعتُقد أن عدم وجود هذا المسار في حقيقيات نوى معينة يعتبر صفة.[76] إن هذا النظام الموروث غالباً يحتوي بروتين واحد على الأقل شبيه بالدايسر وواحد من كل من بروتين أرجونات argonaute وبروتين PIWI بالإضافة إلى الرنا المعتمد على بوليميراز الرنا، ويشار إلى أن هذه البروتينات من الممكن أن يكون لها مهمات أخرى في الخلية. وفي مجال أوسع فإن إحدى دراسات علم الجينوم المقارن أشارت أيضاً إلى أن حقيقيات النوى التابعة للمجموعة التاجية قد مرت بكل المراحل السابقة وبالتالي فقد يكون لها ارتباط بطريقة ما بأنظمة تحطيم الحمض الرايبوزي كما في exosom.[77] هذه الدراسة اقترحت أيضاً أن عائله بروتين أرجونات argonaute والتي يتشارك فيها جميع الكائنات حقيقيات النوى وأغلب العتائق (الجراثيم العتيقة Archaea) وبعض البكتيريا مثل أكويفكس إيوليكوس (Aquifex aeolicus) قد تكون مماثلة ومنشأة بالأصل من مكونات المرحلة الأولى في نظام الترجمة (translation initiation system).
على وجه العموم فقد اتفق على أن دور المورّثات في نظام تداخل الرنا يكمن في أنها خط الدفاع المناعي الأول ضد الأجزاء الجينية الخارجية الغريبة عنه كالترانسبوزونات وفيروسات الجينوم.[76][78] ربما كانت الأدوار المرتبطة بذلك مثل تعديل هيستون قد لوحظت في مورثات حقيقيات النوى الحديثة، وإن كانت الأدوار الأخرى المرتبطة كضبط عملية النمو بواسطة مايكرو الحمض الرايبوزي miRNA استنبطت في وقتٍ لاحق.[76]
إن جينات RNAi (كمكونات للجهاز المناعي الأساسي ضد الفيروسات في العديد من كائنات حقيقيات النوى) يدخل في عملية سباق التسلح التطوري مع الجين الفيروسي. بعض الفيروسات كوّنت آليات محددة من أجل تثبيط الاستجابة لعملية تداخل الرنا RNAi في خلايا الجسم المُضيف، وهذا ماتم ملاحظته في فيروسات النبات على وجه الخصوص.[79] دراسات أخرى عن مستوى التطور في ذبابة الفاكهة (Drosophila) أوضحت ان الجينات في مسار RNAi تخضع لانتقاء اتجاهي قوي وهي أسرع الجينات تطوراً في جينوم هذا الكائن.[80]
التطبيقات التقنية
يستخدم نظام تدخل RNA عادة في علم الأحياء التجريبي لدراسة وظائف الجينات في مزرعة الخلية والكائنات الحية المثالية. الحمض الثنائي الشريطي RNA مركب من سلسلة مكملة لجين نافع ويدخل في الخلية أو الكائن الحي، حيث يتم التعرف عليه كجين وراثي خارجي ينشط مسار تدخل RNA. وقد توصل الباحثون إلى ان استخدام هذه الالية يُسبب نقصاً حاداً في مقدار الجين المستهدف، ويمكن دراسة تاثيرات هذا النقصان ان يظهر الدور الفسيولوجي لمنتج الجين.وقد لا يلغي حمض RNAi الرنوي التعبير عن الجينات تماما، ويُطلق على هذه التقنية أحيانا مُسمى "الضربة" لتمييزها عن إجراءات "الضربة القاضية" التي يتم من خلالها التخلص من الجين تماما.[81]
وُجهت الجهود في علم الأحياء الحسابي نحو تصميم كاشفات dsRNA المزدوجة الناجحة التي تزيد من الضربات الجينية أن الكاشف مع التقليل من التأثيرات الخارجية. تنشأ التأثيرات الخارجية البعيدة عن الهدف عندما يكون لدى إنتاج الحمض النووي الريبي قاعدة لترتيب المكونات في شيء مبلور _خاصة ترتيب النيوكوتيد في الأحماض النووية _وتقترن وبالتالي تخفض مقدار الجينات المتعددة في كل مرة. تحدث هذه المشاكل بشكل أكثر عندما يحتوي dsRNA المزدوج الجديلة على تسلسلات متكررة . وقد تشير الدراسات إلى أن جينات H . sapiens, C. elegans, and S. إلى احتمال احتواء 10% من siRNAs على آثار جوهرية خارج نطاق الهدف. وقد طورت أدوات برمجيات التصميم العام لتطبيق الخوارزميات،[82][83] على حيوانات ثديه خاصة، وفيروسات خاصة. ويتم التحقق تلقائياً من siRNAs لاحتمال حدوث تفاعلات معاكسة.
علم الجينوم الوظيفي
.jpg.webp)
استخدمت معظم تطبيقات علم الجينوم الوظيفي RNA في الحيوانات C. elegans[84] الربداء الأنيقة (أحد أنواع الديدان الاسطوانية) وDrosophila,[85] ذبابة الفاكهة، باعتبارهما النموذح الحي المنتشر الذي يمتاز بأن تداخل RNA فيه هو الأكثر فعالية. الربداء الأنيقة مفيدة بشكل خاص في أبحاث تداخل RNA وذلك لسببين؛ الأول لأن تأثيرات اطفاء الجينات تنتقل عادة بالوراثة والثاني لأن عملية تسليم الرنا ذي النطاقين تكون سهلة جداً. من خلال آلية غير مفهومة التفاصيل فإن بكتيريا مثل "البكتيريا الإشريكية القولونية" التي تحمل RNA ذي النطاقين المطلوب يتم تقديمها كغذاء للديدان ومن خلالها ستنتقل حمولتها من RNA إلى الدودة عن طريق السبيل المعوي.[86] تُعد طريقة "التسليم بالتغذية" مماثلة في كفاءتها من حيث اطفاء الجينات المحرضة لطرق نقل أخرى أكثر تكلفة والتي تستغرق وقتاً طويلاً، ومثال على تلك الطرق نقع الديدان في محلول RNA ذي نطاقين وحقن RNA ذي النطاقين في الغدد التناسلية. على الرغم من أن التسليم أكثر صعوبة في باقي الكائنات الحية إلا أن الجهود المبذولة تتولّى تطبيقات الفرز الجينومي في المزرعة الخلوية لخلايا الثدييات على نطاق واسع.[87]
يتطلب اقتراب التوصل لتصميم مكتبات (المقصود بمكتبات الجينوم، تقطيع الجينوم إلى أجزاء تم تحميلها على فيروس أو بلازميد أو كروموسوم اصطناعى للخميرة حتى يمكن اللجوء إلى أي منها عند القيام بالأبحاث) نطاق جينوم تداخل RNA تطور علمي وتكنولوجي أكثر مما يتطلبه تصميم RNA متداخل صغير مفرد وذلك بسبب مجموعة محددة من ظروف التجربة اللازمة لكل تصميم.[88] يتم عادة استخدام شبكات عصبونية اصطناعية لأغراض تصميم مكتبات RNA متداخل صغير ولغرض توقع الكفاءة المحتملة عند سقوط الجين وانتهاؤه.[89] كما ينظر إلى الفرز الجينومي الشامل كطريقة واعدة مبشرة للمشروع الجينومي (تفسير السلسلة الجينومية) ولقد أثارت هذه الطريقة طرق فرز أخرى لتتطور وتحقق انتاجية عالية باستخدام المجموعات الصغيرة.[90][91] غير أنه تم طرح عدة تساؤلات حول الفائدة من هذه الآليات المستخدمة بالفرز وحول قابلية التقنية للتطور والتطبيق على نموذج حي لتعميمها على كائنات متقاربة وذات صلة. مثل تعميم نموذج الربداء الأنيقة لما هو قريب منها من الديدان الخيطية الطفيلية.[92][93]
يُعد علم الجينوم الوظيفي الذي يـستخدم تداخل RNA تقنية خاصة وجذابة في النباتات من نواحي الرسم التفصيلي الجينومي وفي التفسير، وذلك لأن كثير من النباتات تكون متعددة الصيغ الصبغية مما يشكل تحدي جوهري للطرق الجينية الهندسية التقليدية، مثال ذلك: نجح استخدام تداخل RNA في دراسات علم الجينوم الوظيفي على قمح الخبز (سداسي الصيغة الصبغية)[94] بالإضافة إلى أكثر النماذج النباتية المنتشرة مثل نبتة كشف الألغام ونبات الذرة.[95]
الطب

قد يكون من الممكن استخدام مثبط "RNA interference" في العلاج. على الرغم من صعوبة ادخال شريط طويل من RNA المزدوج "dsRNA" إلى خلايا الثدييات حيث تتعارض مع تأثير المضادات، إلا أن استعمال مثبط RNA القصير "short interfering RNA" كان أكثر نجاحا.[96][97] وقد كان من ضمن التطبيقات الأولى للتجارب السريرية تلك التي استخدمت لعلاج التنكس البقعي والفَيْروسُ المِخْلَوِيُّ التَّنَفُّسِيّ[98]] كما أثبت مثبط RNAi فعاليته في عكس فشكل الكبد في التجارب السريرية التي أجريت على الفئران.[99] ومن الإستخدامات السريرية الأخرى المُقترحة كمضاد للفيروسات، يتضمن استعمال RNAi بشكل موضعي لحالات الالتهابات (في جامعة هارفرد، التجارب التي طُبقت على الفئران حتى الآن على فيروس الحلأ البسيط النوع 2 وتثبيط التعبير الجيني لفيروس الخلايا السرطانية،[100] بالإضافة إلى أنه قضى تماماً على المستقبلات والمستقبلات المشاركة المضيفة لفيروس نقص المناعة المكتسبة HIV،[101] تثبيط فيروس التهاب الكبد الوبائي أ[102] وفيروس التهاب الكبد الوبائي ب،[103] والتعبير الجيني للإنفلونزا[104] وتثبيط عملية تكاثر فيروس الحصبة[105] وقد تم اقتراحه من ضمن العلاجات المُحتملة للأمراض التنكسية العصبية، مع اهتمام خاص بأمراض عديد الغلوتامين كمرض هانتنجتون[106]
كما ينظر إلى تدخل الحمض النووي الريبي (RNA) باعتباره طريقة واعدة لعلاج السرطان عن طريق إيقاف الجينات المختلفة في عملية زيادة الاستجابة على التحفيز في الخلايا السرطانية أو الجينات المسؤولة عن انقسام الخلايا.[107][108] اظهرت البحوث الأساسية في مجال استخدام تدخل الحمض النووي الريبي (RNAi) خلال الاختبارات السريرية له تطوير في طريقة التوليد الآمنة، والتي حتى الآن شملت أنظمة النواقل الفيروسية المشابهة لتلك التي تم اقتراحها للعلاج بالجينات.[109][110]
يتم توظيف الوسائل القائمة على الدهون عادة بسبب مخاوف تتعلق بالسلامة مع وسائل النواقل الفيروسية، والغير الفيروسية[111][112] والنواقل البوليمرية أيضا من الوسائل المرشحة الواعدة.[113][114] اوضحت دراسات الموروث القاضية من قبل بارتليت وديفيز في النمذجة الحاسوبية لتدخل الحمض النووي الريبي الصغير (RNAi) الغير فيروسي بالتجارب المختبرية السلوك الزماني لتدخل الحمض النووي الريبي الصغير في هذه الأنظمة.[115] فاستخدموا نموذجهم دخال جرعات علاجية لإدخال الحمض النووي الريبي الصغير (RNAi)، كانوا قادرين حسابياً وتجريبياً على إظهار أن المدة القاضية كانت تعتمد بشكل رئيسي على مضاعفة الوقت من الخلايا التي سلمها التدخل الحمض النووي الريبي الصغير، بينما تعتمد الذروة القاضية على جرعة تسليمها في المقام الأول. سوف تكون الاعتبارات الحركية لإدخال الحمض النووي الريبي الصغير (RNAi) حتمية للتخطيط الآمن وجداول الجرعات الفعالة كأساليب غير فيروسية على حمل تدخل الحمض النووي الريبي الصغير (RNAi)على مواصلة التطوير.
على الرغم من كثرة الدراسات الواعدة لزراعة الخلايا بواسطة مثبط "RNAi"، فهناك تساؤلات عن مدى سلامة استخدامه، خاصة من احتمال حدوث آثار غير مرغوبة "off-target" كالتأثيرعلى جين ذو تسلسل مشابه للجين المستهدف مصادفة للذي تم قمعه أيضاً.[116] قدرت إحدى الدراسات الحسابية لعلم الجينات ان معدل الخطأ للتفاعل الجيني غير المستهدف "off-target" يصل إلى ما يقارب 10٪.[8] وقد ذكرت إحدى الدراسات الكبرى التي أُجريت على الفئران المصابة بمرض كبدي ان 23 فأراً من 49 ممن تم استخدام مثبط "RNAi" لعلاجهم حسب الأنظمة المُتبعة أدت إلى وفاتهم.[117] وقد افترض الباحثون ان هذه النسبة الكبيرة المُثيرة للقلق هي سبب زيادة التشبع في مسار dsRNA المزدوج،[118] ناتجاً عن استخدام shRNAs مما قلل الهيبارين الذي يجب معالجته في النواة ونقله إلى السيتوبلازم بطريقة فعالة. وكل ما سبق ما هي إلا نظريات ما زالت قيد الدراسة، وبهدف الحدّ من الأثار الجانبية في تطبيقات RNAiالعلاجية المحتملة، يتم حالياً تطوير تطبيقات علاج RNA واستخدامه لإستهداف فيروس نقص المناعة المكتسبة، وفيروسات أخرى كفيروس نقص المناعة المكتسبة "HIV-1 " التي تُعد أهدافاً صعبة على وجه التحديد بالنسبة لهجوم RNAiحيث يسهل عليها الهروب، مما يتطلب استخدام استراتيجيات دمج RNAi لتجنب هروب الفيروس. يُعد استعمال " RNAi" كمضاد للفيروسات واعد جداً، لكنه يبقى ذو أهمية حاسمة لتشمل العديد من الضوابط في فحوصات الاختبارات ما قبل السريرية التي تظهر بشكل قاطع التسلسل المحدد لعمل محفزات RNAi المثبط.[119]
نمت المعرفة بشكل كبير منذ اكتشاف تداخل [118] RNA وعلى الرغم من أنه مفيد جداً، إلا ان تداخل RNA يصل للأنسجة مما يبرهن انها تشكل تحدياً علمياً مستعصياً وخاصة في الأنسجة العميقة داخل الجسم[120] ويكون وصول RNAi للانسجة السطحية مثل العين والجهاز التنفسي سهلاً.[118]
يستخدم siRNA في هذه الحالات للاتصال المباشر مع الانسجة بهدف النقل .وتداخل RNA الناتج يكون ناجحاً للغاية في التركيز على الجينات المستهدفة .[118] يجب اتخاذ التدابير اللازمة عند وصول siRNA لطبقات الانسجة العميقة داخل الجسم لحماية siRNA من nucleases ، لكن استهداف مناطق معينة يشكل عقبة رئيسية.[118] بالرغم من ذلك تحارب الجرعات العالية من siRNA ضمان الوصول للانسجة، وهذه الصعوبة في مثل هذه الحالات hepatotoxicity was reported.[118]
التكنولوجيا الحيوية
تم استخدام تداخل RNA في عدة تطبيقات من التقنية الحيوية وخاصة في هندسة الأغذية النباتية التي تنتج مستويات قليلة من السموم النباتية الطبيعية. تستغل مثل هذه التقنيات النمط الظاهري للتداخل الرني الثابت والموروث في مخزون النبتة، فعلى سبيل المثال تعتبر بذور القطن غنية بالبروتين الغذائي ولكنها تحتوي بشكل طبيعي على سم التيربينويد الذي يُنتج الجوسيبول مما يجعلها غير مناسبة للاستهلاك البشري. تم استخدام التداخل الرني لانتاج مخزون القطن الذي تحتوي بذوره على مستويات منخفضة من delta-cadinene synthase وهو الإنزيم الأساسي لإنتاج الجوسيبول دون أن يؤثر على إنتاج الإنزيم في أجزاء أخرى من النبتة، علماً بأن للجوسيبول دوراً هاماً في الحد من تضرر النبتة من التلف.[121] كذلك توجهت جهود مشابه للتقليل من إنتاج الينامارين الطبيعي والمنتج لسيانيد الهيدروجين في نبتة الكسافا.[122]
بالرغم من عدم اجتياز المنتجات النباتية التي تعتمد على التداخل الرني في الهندسة الجينية مرحلة التجارب بعد، إلا أن جهود التطوير خفضت مستويات المواد المُسببة للحساسية في نبات الطماطم بنجاح كما خفضت احتمال ظهور مواد سرطانية في نبات التبغ، كما تم هندسة صفات أخرى للنباتات في المعمل ومن ضمن تلك الصفات إنتاج منتجات طبيعية غير مخدرة من نبتة الخشخاش المنوم ومقاومة فيروسات النباتات الشائعة وتحصين النباتات مثل الطماطم[123] بمضادات الأكسدة الغذائية. وُضعت المنتجات التجارية السابقة مثل طماطم Flavr Savr وصنفين من البابايا المقاومة لفيروس ringspot الذي يصيب البابايا باستخدام تقنية مضادة ولكن من الأرجح أنها استغلت نهج التداخل الرني.[124][125]
فحص RNAi بمقياس جينوم
تعتمد أبحاث فحص RNAi على مقياس الجينوم في تقنية فحص سرعة المعالجة العالية وتتيح تقنية RNAi HTS لفحص الجينومwide loss-of-function screening وهي تستخدم على نطاق واسع للتعرف على الجينات المرتبطة بأنماط حيوية ظاهرية وقد سُميت هذه التقنية بالموجة الجينومية الثانية التي تلت الموجة الجينومية الأولى لتعبيرالإصطفاف الجيني المجهري microarray واكتشاف أشكال النيوكليدات الأُحادية.[126] وأحد أعظم مزايا فحص RNAi بمقياس الجينوم هي التسارع الكبير في انتاجية المعلومات مع القدرة على إنتاج قدرٍ كبير من المعلومات في كل تجربة، فقد أدى فحص RNAi بمقياس الجينوم إلى ثورة في كمية المعلومات الناتجة وبناء عليه فقد كانت أحد الصعوبات الأساسية في أبحاث RNAi بمقياس الجينوم هي تقاط أهم المعلومات الحيوية من بين ذلك الكم الهائل من المعلومات المُنتجة مما يستدعي استخدام وسائل احصائية معلوماتية حيوية كتلك الواردة في الكتاب الذي تم نشره مؤخراً لتحليل فحوصات RNAi وتشمل العملية الأساسية لفحص RNAi المعتمدة على الخلايا: (1) اختيار مكتبة RNAi المناسبة، (2) اختيار نوع صامد ومستقر من الخلايا، (3) عملية نعد الخلايا المختارة باستخدام عناصر RNAi من مكتبة RNAi المختارة، (4) العلاج اللازم أو فترة الحضانة، (5) التقاط الإشارات، (6) تحليل الإحصاءات والبيانات الحيوية، (7) تحديد الجينات الهامة أو الأهداف العلاجية.[127]
المراجع
- Daneholt, Bertil، "Advanced Information: RNA interference"، The Nobel Prize in Physiology or Medicine 2006، مؤرشف من الأصل في 20 يناير 2007، اطلع عليه بتاريخ 25 يناير 2007.
- Bagasra O, Prilliman KR (2004)، "RNA interference: the molecular immune system"، J. Mol. Histol.، 35 (6): 545–53، doi:10.1007/s10735-004-2192-8، PMID 15614608، مؤرشف من الأصل (PDF) في 14 مارس 2020.
- Bernstein E, Caudy A, Hammond S, Hannon G (2001)، "Role for a bidentate ribonuclease in the initiation step of RNA interference"، Nature، 409 (6818): 363–6، doi:10.1038/35053110، PMID 11201747.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Siomi, Haruhiko؛ Siomi, Mikiko C. (22 يناير 2009)، "On the road to reading the RNA-interference code"، نيتشر (مجلة)، 457 (7228): 396–404، Bibcode:2009Natur.457..396S، doi:10.1038/nature07754، PMID 19158785.
- Zamore P, Tuschl T, Sharp P, Bartel D (2000)، "RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals"، Cell، 101 (1): 25–33، doi:10.1016/S0092-8674(00)80620-0، PMID 10778853.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Vermeulen A, Behlen L, Reynolds A, Wolfson A, Marshall W, Karpilow J, Khvorova A (2005)، "The contributions of dsRNA structure to Dicer specificity and efficiency"، RNA، 11 (5): 674–82، doi:10.1261/rna.7272305، PMC 1370754، PMID 15811921.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Castanotto, Daniela؛ Rossi, John J. (22 يناير 2009)، "The promises and pitfalls of RNA-interference-based therapeutics"، نيتشر (مجلة)، 457 (7228): 426–433، Bibcode:2009Natur.457..426C، doi:10.1038/nature07758، PMC 2702667، PMID 19158789.
- Qiu S, Adema C, Lane T (2005)، "A computational study of off-target effects of RNA interference"، Nucleic Acids Res، 33 (6): 1834–47، doi:10.1093/nar/gki324، PMC 1072799، PMID 15800213.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ahlquist P (2002)، "RNA-dependent RNA polymerases, viruses, and RNA silencing"، Science، 296 (5571): 1270–3، Bibcode:2002Sci...296.1270A، doi:10.1126/science.1069132، PMID 12016304.
- Parker G, Eckert D, Bass B (2006)، "RDE-4 preferentially binds long dsRNA and its dimerization is necessary for cleavage of dsRNA to siRNA"، RNA، 12 (5): 807–18، doi:10.1261/rna.2338706، PMC 1440910، PMID 16603715.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Liu Q, Rand T, Kalidas S, Du F, Kim H, Smith D, Wang X (2003)، "R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway"، Science، 301 (5641): 1921–5، Bibcode:2003Sci...301.1921L، doi:10.1126/science.1088710، PMID 14512631.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Baulcombe D (2007)، "Molecular biology. Amplified silencing"، Science، 315 (5809): 199–200، doi:10.1126/science.1138030، PMID 17218517.
- Pak J, Fire A (2007)، "Distinct populations of primary and secondary effectors during RNAi in C. elegans"، Science، 315 (5809): 241–4، Bibcode:2007Sci...315..241P، doi:10.1126/science.1132839، PMID 17124291.
- Sijen T, Steiner F, Thijssen K, Plasterk R (2007)، "Secondary siRNAs result from unprimed RNA synthesis and form a distinct class"، Science، 315 (5809): 244–7، Bibcode:2007Sci...315..244S، doi:10.1126/science.1136699، PMID 17158288.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wang QL, Li ZH (2007)، "The functions of microRNAs in plants"، Front. Biosci.، 12: 3975–82، PMID 17485351.
- Zhao Y, Srivastava D (2007)، "A developmental view of microRNA function"، Trends Biochem. Sci.، 32 (4): 189–97، doi:10.1016/j.tibs.2007.02.006، PMID 17350266.
- Gregory R, Chendrimada T, Shiekhattar R (2006)، "MicroRNA biogenesis: isolation and characterization of the microprocessor complex"، Methods Mol Biol، 342: 33–47، doi:10.1385/1-59745-123-1:33، ISBN 1-59745-123-1، PMID 16957365.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Pillai RS, Bhattacharyya SN, Filipowicz W (2007)، "Repression of protein synthesis by miRNAs: how many mechanisms?"، Trends Cell Biol، 17 (3): 118–26، doi:10.1016/j.tcb.2006.12.007، PMID 17197185.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Okamura K, Ishizuka A, Siomi H, Siomi M (2004)، "Distinct roles for Argonaute proteins in small RNA-directed RNA cleavage pathways"، Genes Dev، 18 (14): 1655–66، doi:10.1101/gad.1210204، PMC 478188، PMID 15231716.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lee Y, Nakahara K, Pham J, Kim K, He Z, Sontheimer E, Carthew R (2004)، "Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways"، Cell، 117 (1): 69–81، doi:10.1016/S0092-8674(04)00261-2، PMID 15066283.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Gregory R, Chendrimada T, Cooch N, Shiekhattar R (2005)، "Human RISC couples microRNA biogenesis and posttranscriptional gene silencing"، Cell، 123 (4): 631–40، doi:10.1016/j.cell.2005.10.022، PMID 16271387.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J (2004)، Molecular Cell Biology (ط. 5th)، WH Freeman: New York, NY، ISBN 978-0-7167-4366-8، مؤرشف من الأصل في 18 أكتوبر 2009.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Matranga C, Tomari Y, Shin C, Bartel D, Zamore P (2005)، "Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes"، Cell، 123 (4): 607–20، doi:10.1016/j.cell.2005.08.044، PMID 16271386.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Leuschner P, Ameres S, Kueng S, Martinez J (2006)، "Cleavage of the siRNA passenger strand during RISC assembly in human cells"، EMBO Rep، 7 (3): 314–20، doi:10.1038/sj.embor.7400637، PMC 1456892، PMID 16439995.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Haley, B (2004)، "Kinetic analysis of the RNAi enzyme complex"، Nature Structural & Molecular Biology، 11 (7): 599–606، doi:10.1038/nsmb780، مؤرشف من الأصل في 25 مارس 2016.
- Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (2003)، "Asymmetry in the assembly of the RNAi enzyme complex"، Cell، 115 (2): 199–208، doi:10.1016/S0092-8674(03)00759-1، PMID 14567917.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Preall J, He Z, Gorra J, Sontheimer E (2006)، "Short interfering RNA strand selection is independent of dsRNA processing polarity during RNAi in Drosophila"، Curr Biol، 16 (5): 530–5، doi:10.1016/j.cub.2006.01.061، PMID 16527750.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Tomari Y, Matranga C, Haley B, Martinez N, Zamore P (2004)، "A protein sensor for siRNA asymmetry"، Science، 306 (5700): 1377–80، Bibcode:2004Sci...306.1377T، doi:10.1126/science.1102755، PMID 15550672.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ma J, Yuan Y, Meister G, Pei Y, Tuschl T, Patel D (2005)، "Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi protein"، Nature، 434 (7033): 666–70، Bibcode:2005Natur.434..666M، doi:10.1038/nature03514، PMID 15800629.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Sen G, Wehrman T, Blau H (2005)، "mRNA translation is not a prerequisite for small interfering RNA-mediated mRNA cleavage"، Differentiation، 73 (6): 287–93، doi:10.1111/j.1432-0436.2005.00029.x، PMID 16138829.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Gu S, Rossi J (2005)، "Uncoupling of RNAi from active translation in mammalian cells"، RNA، 11 (1): 38–44، doi:10.1261/rna.7158605، PMC 1370689، PMID 15574516.
- Sen G, Blau H (2005)، "Argonaute 2/RISC resides in sites of mammalian mRNA decay known as cytoplasmic bodies"، Nat Cell Biol، 7 (6): 633–6، doi:10.1038/ncb1265، PMID 15908945.
- Holmquist G, Ashley T (2006)، "Chromosome organization and chromatin modification: influence on genome function and evolution"، Cytogenet Genome Res، 114 (2): 96–125، doi:10.1159/000093326، PMID 16825762.
- Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal S, Moazed D (2004)، "RNAi-mediated targeting of heterochromatin by the RITS complex"، Science، 303 (5658): 672–6، Bibcode:2004Sci...303..672V، doi:10.1126/science.1093686، PMC 3244756، PMID 14704433.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Irvine D, Zaratiegui M, Tolia N, Goto D, Chitwood D, Vaughn M, Joshua-Tor L, Martienssen R (2006)، "Argonaute slicing is required for heterochromatic silencing and spreading"، Science، 313 (5790): 1134–7، Bibcode:2006Sci...313.1134I، doi:10.1126/science.1128813، PMID 16931764.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Volpe T, Kidner C, Hall I, Teng G, Grewal S, Martienssen R (2002)، "Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi"، Science، 297 (5588): 1833–7، Bibcode:2002Sci...297.1833V، doi:10.1126/science.1074973، PMID 12193640.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Volpe T, Schramke V, Hamilton G, White S, Teng G, Martienssen R, Allshire R (2003)، "RNA interference is required for normal centromere function in fission yeast"، Chromosome Res، 11 (2): 137–46، doi:10.1023/A:1022815931524، PMID 12733640.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Li LC, Okino ST, Zhao H, Pookot D, Place RF, Urakami S, Enokida H, Dahiya R (2006)، "Small dsRNAs induce transcriptional activation in human cells"، Proc Natl Acad Sci USA، 103 (46): 17337–42، Bibcode:2006PNAS..10317337L، doi:10.1073/pnas.0607015103، PMC 1859931، PMID 17085592.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Noma K, Sugiyama T, Cam H, Verdel A, Zofall M, Jia S, Moazed D, Grewal S (2004)، "RITS acts in cis to promote RNA interference-mediated transcriptional and post-transcriptional silencing"، Nat Genet، 36 (11): 1174–80، doi:10.1038/ng1452، PMID 15475954.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Bass B (2002)، "RNA Editing by Adenosine Deaminases That Act on RNA"، Annu Rev Biochem، 71: 817–46، doi:10.1146/annurev.biochem.71.110601.135501، PMC 1823043، PMID 12045112.
- Bass B (2000)، "Double-stranded RNA as a template for gene silencing"، Cell، 101 (3): 235–8، doi:10.1016/S0092-8674(02)71133-1، PMID 10847677.
- Luciano D, Mirsky H, Vendetti N, Maas S (2004)، "RNA editing of a miRNA precursor"، RNA، 10 (8): 1174–7، doi:10.1261/rna.7350304، PMC 1370607، PMID 15272117.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Yang W, Chendrimada T, Wang Q, Higuchi M, Seeburg P, Shiekhattar R, Nishikura K (2006)، "Modulation of microRNA processing and expression through RNA editing by ADAR deaminases"، Nat Struct Mol Biol، 13 (1): 13–21، doi:10.1038/nsmb1041، PMC 2950615، PMID 16369484.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Yang W, Wang Q, Howell K, Lee J, Cho D, Murray J, Nishikura K (2005)، "ADAR1 RNA Deaminase Limits Short Interfering RNA Efficacy in Mammalian Cells"، J Biol Chem، 280 (5): 3946–53، doi:10.1074/jbc.M407876200، PMC 2947832، PMID 15556947.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Nishikura K (2006)، "Editor meets silencer: crosstalk between RNA editing and RNA interference"، Nat Rev Mol Cell Biol، 7 (12): 919–31، doi:10.1038/nrm2061، PMC 2953463، PMID 17139332.
- Jones L, Ratcliff F, Baulcombe DC (2001)، "RNA-directed transcriptional gene silencing in plants can be inherited independently of the RNA trigger and requires Met1 for maintenance"، Current Biology، 11 (10): 747–757، doi:10.1016/S0960-9822(01)00226-3، PMID 11378384، مؤرشف من الأصل في 6 أبريل 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Saumet A, Lecellier CH (2006)، "Anti-viral RNA silencing: do we look like plants ?"، Retrovirology، 3 (1): 3، doi:10.1186/1742-4690-3-3، PMC 1363733، PMID 16409629.
- Humphreys DT, Westman BJ, Martin DI, Preiss T (2005)، "MicroRNAs control translation initiation by inhibiting eukaryotic initiation factor 4E/cap and poly(A) tail function"، Proc Natl Acad Sci USA، 102 (47): 16961–16966، Bibcode:2005PNAS..10216961H، doi:10.1073/pnas.0506482102، PMC 1287990، PMID 16287976.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - DaRocha W, Otsu K, Teixeira S, Donelson J (2004)، "Tests of cytoplasmic RNA interference (RNAi) and construction of a tetracycline-inducible T7 promoter system in Trypanosoma cruzi"، Mol Biochem Parasitol، 133 (2): 175–86، doi:10.1016/j.molbiopara.2003.10.005، PMID 14698430.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Robinson K, Beverley S (2003)، "Improvements in transfection efficiency and tests of RNA interference (RNAi) approaches in the protozoan parasite Leishmania"، Mol Biochem Parasitol، 128 (2): 217–28، doi:10.1016/S0166-6851(03)00079-3، PMID 12742588.
- L. Aravind, Hidemi Watanabe, David J. Lipman, and Eugene V. Koonin (2000)، "Lineage-specific loss and divergence of functionally linked genes in eukaryotes"، Proceedings of the National Academy of Sciences، 97 (21): 11319–11324، Bibcode:2000PNAS...9711319A، doi:10.1073/pnas.200346997، PMC 17198، PMID 11016957.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Drinnenberg IA, Weinberg DE, Xie KT, Nower JP, Wolfe KH, Fink GR, Bartel DP (2009)، "RNAi in Budding Yeast"، Science، 326 (5952): 544–50، Bibcode:2009Sci...326..544D، doi:10.1126/science.1176945، PMID 19745116.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Nakayashiki H, Kadotani N, Mayama S (2006)، "Evolution and diversification of RNA silencing proteins in fungi"، J Mol Evol، 63 (1): 127–35، doi:10.1007/s00239-005-0257-2، PMID 16786437.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Morita T, Mochizuki Y, Aiba H (2006)، "Translational repression is sufficient for gene silencing by bacterial small noncoding RNAs in the absence of mRNA destruction"، Proc Natl Acad Sci USA، 103 (13): 4858–63، Bibcode:2006PNAS..103.4858M، doi:10.1073/pnas.0509638103، PMC 1458760، PMID 16549791.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Makarova K, Grishin N, Shabalina S, Wolf Y, Koonin E (2006)، "A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action"، Biol Direct، 1: 7، doi:10.1186/1745-6150-1-7، PMC 1462988، PMID 16545108.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Stram Y, Kuzntzova L (2006)، "Inhibition of viruses by RNA interference"، Virus Genes، 32 (3): 299–306، doi:10.1007/s11262-005-6914-0، PMID 16732482.
- Blevins T, Rajeswaran R, Shivaprasad P, Beknazariants D, Si-Ammour A, Park H, Vazquez F, Robertson D, Meins F, Hohn T, Pooggin M (2006)، "Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing"، Nucleic Acids Res، 34 (21): 6233–46، doi:10.1093/nar/gkl886، PMC 1669714، PMID 17090584.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Palauqui J, Elmayan T, Pollien J, Vaucheret H (1997)، "Systemic acquired silencing: transgene-specific post-transcriptional silencing is transmitted by grafting from silenced stocks to non-silenced scions"، EMBO J، 16 (15): 4738–45، doi:10.1093/emboj/16.15.4738، PMC 1170100، PMID 9303318.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Voinnet O (2001)، "RNA silencing as a plant immune system against viruses"، Trends Genet، 17 (8): 449–59، doi:10.1016/S0168-9525(01)02367-8، PMID 11485817.
- Mérai Z, Kerényi Z, Kertész S, Magna M, Lakatos L, Silhavy D (2006)، "Double-Stranded RNA Binding May Be a General Plant RNA Viral Strategy To Suppress RNA Silencing"، J Virol، 80 (12): 5747–56، doi:10.1128/JVI.01963-05، PMC 1472586، PMID 16731914.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Katiyar-Agarwal S, Morgan R, Dahlbeck D, Borsani O, Villegas A, Zhu J, Staskawicz B, Jin H (2006)، "A pathogen-inducible endogenous siRNA in plant immunity"، Proc Natl Acad Sci USA، 103 (47): 18002–7، Bibcode:2006PNAS..10318002K، doi:10.1073/pnas.0608258103، PMC 1693862، PMID 17071740.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fritz J, Girardin S, Philpott D (2006)، "Innate immune defense through RNA interference"، Sci STKE، 2006 (339): pe27، doi:10.1126/stke.3392006pe27، PMID 16772641.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Zambon R, Vakharia V, Wu L (2006)، "RNAi is an antiviral immune response against a dsRNA virus in Drosophila melanogaster"، Cell Microbiol، 8 (5): 880–9، doi:10.1111/j.1462-5822.2006.00688.x، PMID 16611236.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wang X, Aliyari R, Li W, Li H, Kim K, Carthew R, Atkinson P, Ding S (2006)، "RNA Interference Directs Innate Immunity Against Viruses in Adult Drosophila"، Science، 312 (5772): 452–4، Bibcode:2006Sci...312..452W، doi:10.1126/science.1125694، PMC 1509097، PMID 16556799.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lu R, Maduro M, Li F, Li H, Broitman-Maduro G, Li W, Ding S (2005)، "Animal virus replication and RNAi-mediated antiviral silencing in C elegans"، Nature، 436 (7053): 1040–3، Bibcode:2005Natur.436.1040L، doi:10.1038/nature03870، PMC 1388260، PMID 16107851.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wilkins C, Dishongh R, Moore S, Whitt M, Chow M, Machaca K (2005)، "RNA interference is an antiviral defence mechanism in Caenorhabditis elegans"، Nature، 436 (7053): 1044–7، Bibcode:2005Natur.436.1044W، doi:10.1038/nature03957، PMID 16107852.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Berkhout B, Haasnoot J (2006)، "The interplay between virus infection and the cellular RNA interference machinery"، FEBS Lett، 580 (12): 2896–902، doi:10.1016/j.febslet.2006.02.070، PMID 16563388.
- Schütz S, Sarnow P (2006)، "Interaction of viruses with the mammalian RNA interference pathway"، Virology، 344 (1): 151–7، doi:10.1016/j.virol.2005.09.034، PMID 16364746.
- Li H, Ding S (2005)، "Antiviral silencing in animals"، FEBS Lett، 579 (26): 5965–73، doi:10.1016/j.febslet.2005.08.034، PMC 1350842، PMID 16154568.
- Carrington J, Ambros V (2003)، "Role of microRNAs in plant and animal development"، Science، 301 (5631): 336–8، Bibcode:2003Sci...301..336C، doi:10.1126/science.1085242، PMID 12869753.
- Lee R, Feinbaum R, Ambros V (1993)، "The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14"، Cell، 75 (5): 843–54، doi:10.1016/0092-8674(93)90529-Y، PMID 8252621.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Palatnik J, Allen E, Wu X, Schommer C, Schwab R, Carrington J, Weigel D (2003)، "Control of leaf morphogenesis by microRNAs"، Nature، 425 (6955): 257–63، Bibcode:2003Natur.425..257P، doi:10.1038/nature01958، PMID 12931144.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Zhang B, Pan X, Cobb G, Anderson T (2006)، "Plant microRNA: a small regulatory molecule with big impact"، Dev Biol، 289 (1): 3–16، doi:10.1016/j.ydbio.2005.10.036، PMID 16325172.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Jones-Rhoades M, Bartel D, Bartel B (2006)، "MicroRNAS and their regulatory roles in plants"، Annu Rev Plant Biol، 57: 19–53، doi:10.1146/annurev.arplant.57.032905.105218، PMID 16669754.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Zhang B, Pan X, Cobb G, Anderson T (2007)، "microRNAs as oncogenes and tumor suppressors"، Dev Biol، 302 (1): 1–12، doi:10.1016/j.ydbio.2006.08.028، PMID 16989803.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Cerutti H, Casas-Mollano J (2006)، "On the origin and functions of RNA-mediated silencing: from protists to man"، Curr Genet، 50 (2): 81–99، doi:10.1007/s00294-006-0078-x، PMC 2583075، PMID 16691418.
- Anantharaman V, Koonin E, Aravind L (2002)، "Comparative genomics and evolution of proteins involved in RNA metabolism"، Nucleic Acids Res، 30 (7): 1427–64، doi:10.1093/nar/30.7.1427، PMC 101826، PMID 11917006.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Buchon N, Vaury C (2006)، "RNAi: a defensive RNA-silencing against viruses and transposable elements"، Heredity، 96 (2): 195–202، doi:10.1038/sj.hdy.6800789، PMID 16369574.
- Lucy A, Guo H, Li W, Ding S (2000)، "Suppression of post-transcriptional gene silencing by a plant viral protein localized in the nucleus"، EMBO J، 19 (7): 1672–80، doi:10.1093/emboj/19.7.1672، PMC 310235، PMID 10747034.
- Obbard D, Jiggins F, Halligan D, Little T (2006)، "Natural selection drives extremely rapid evolution in antiviral RNAi genes"، Curr Biol، 16 (6): 580–5، doi:10.1016/j.cub.2006.01.065، PMID 16546082.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Voorhoeve PM, Agami R (2003)، "Knockdown stands up"، Trends Biotechnol.، 21 (1): 2–4، doi:10.1016/S0167-7799(02)00002-1، PMID 12480342، مؤرشف من الأصل في 3 ديسمبر 2019.
- Naito Y, Yamada T, Matsumiya T, Ui-Tei K, Saigo K, Morishita S (2005)، "dsCheck: highly sensitive off-target search software for double-stranded RNA-mediated RNA interference"، Nucleic Acids Res، 33 (Web Server issue): W589–91، doi:10.1093/nar/gki419، PMC 1160180، PMID 15980542.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Henschel A, Buchholz F, Habermann B (2004)، "DEQOR: a web-based tool for the design and quality control of siRNAs"، Nucleic Acids Res، 32 (Web Server issue): W113–20، doi:10.1093/nar/gkh408، PMC 441546، PMID 15215362.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Kamath R, Ahringer J (2003)، "Genome-wide RNAi screening in Caenorhabditis elegans"، Methods، 30 (4): 313–21، doi:10.1016/S1046-2023(03)00050-1، PMID 12828945.
- Boutros M, Kiger A, Armknecht S, Kerr K, Hild M, Koch B, Haas S, Paro R, Perrimon N (2004)، "Genome-wide RNAi analysis of growth and viability in Drosophila cells"، Science، 303 (5659): 832–5، Bibcode:2004Sci...303..832B، doi:10.1126/science.1091266، PMID 14764878.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fortunato A, Fraser A (2005)، "Uncover genetic interactions in Caenorhabditis elegans by RNA interference"، Biosci Rep، 25 (5–6): 299–307، doi:10.1007/s10540-005-2892-7، PMID 16307378.
- Cullen L, Arndt G (2005)، "Genome-wide screening for gene function using RNAi in mammalian cells"، Immunol Cell Biol، 83 (3): 217–23، doi:10.1111/j.1440-1711.2005.01332.x، PMID 15877598.
- Huesken D, Lange J, Mickanin C, Weiler J, Asselbergs F, Warner J, Meloon B, Engel S, Rosenberg A, Cohen D, Labow M, Reinhardt M, Natt F, Hall J (2005)، "Design of a genome-wide siRNA library using an artificial neural network"، Nat Biotechnol، 23 (8): 995–1001، doi:10.1038/nbt1118، PMID 16025102.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ge G, Wong G, Luo B (2005)، "Prediction of siRNA knockdown efficiency using artificial neural network models"، Biochem Biophys Res Commun، 336 (2): 723–8، doi:10.1016/j.bbrc.2005.08.147، PMID 16153609.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Janitz M, Vanhecke D, Lehrach H (2006)، "High-throughput RNA interference in functional genomics"، Handb Exp Pharmacol، Handbook of Experimental Pharmacology، 173 (173): 97–104، doi:10.1007/3-540-27262-3_5، ISBN 3-540-27261-5، PMID 16594612.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Vanhecke D, Janitz M (2005)، "Functional genomics using high-throughput RNA interference"، Drug Discov Today، 10 (3): 205–12، doi:10.1016/S1359-6446(04)03352-5، PMID 15708535.
- Geldhof P, Murray L, Couthier A, Gilleard J, McLauchlan G, Knox D, Britton C (2006)، "Testing the efficacy of RNA interference in Haemonchus contortus"، Int J Parasitol، 36 (7): 801–10، doi:10.1016/j.ijpara.2005.12.004، PMID 16469321.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Geldhof P, Visser A, Clark D, Saunders G, Britton C, Gilleard J, Berriman M, Knox D. (2007)، "RNA interference in parasitic helminths: current situation, potential pitfalls and future prospects"، Parasitology، 134 (Pt 5): 1–11، doi:10.1017/S0031182006002071، PMID 17201997.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Travella S, Klimm T, Keller B (2006)، "RNA Interference-Based Gene Silencing as an Efficient Tool for Functional Genomics in Hexaploid Bread Wheat"، Plant Physiol، 142 (1): 6–20، doi:10.1104/pp.106.084517، PMC 1557595، PMID 16861570.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - McGinnis K, Chandler V, Cone K, Kaeppler H, Kaeppler S, Kerschen A, Pikaard C, Richards E, Sidorenko L, Smith T, Springer N, Wulan T (2005)، "Transgene-induced RNA interference as a tool for plant functional genomics"، Methods Enzymol، Methods in Enzymology، 392: 1–24، doi:10.1016/S0076-6879(04)92001-0، ISBN 978-0-12-182797-7، PMID 15644172.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Paddison P, Caudy A, Hannon G (2002)، "Stable suppression of gene expression by RNAi in mammalian cells"، Proc Natl Acad Sci USA، 99 (3): 1443–8، Bibcode:2002PNAS...99.1443P، doi:10.1073/pnas.032652399، PMC 122210، PMID 11818553.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - ، PMID 22432611.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة)، الوسيط|title=غير موجود أو فارغ (مساعدة) - Sah D (2006)، "Therapeutic potential of RNA interference for neurological disorders"، Life Sci، 79 (19): 1773–80، doi:10.1016/j.lfs.2006.06.011، PMID 16815477.
- Zender L, Hutker S, Liedtke C, Tillmann H, Zender S, Mundt B, Waltemathe M, Gosling T, Flemming P, Malek N, Trautwein C, Manns M, Kuhnel F, Kubicka S (2003)، "Caspase 8 small interfering RNA prevents acute liver failure in mice"، Proc Natl Acad Sci USA، 100 (13): 7797–802، Bibcode:2003PNAS..100.7797Z، doi:10.1073/pnas.1330920100، PMC 164667، PMID 12810955.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Jiang M, Milner J (2002)، "Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference"، Oncogene، 21 (39): 6041–8، doi:10.1038/sj.onc.1205878، PMID 12203116.
- Crowe S (2003)، "Suppression of chemokine receptor expression by RNA interference allows for inhibition of HIV-1 replication, by Martínez et al"، AIDS، 17 Suppl 4: S103–5، PMID 15080188، مؤرشف من الأصل في 5 ديسمبر 2019.
- Kusov Y, Kanda T, Palmenberg A, Sgro J, Gauss-Müller V (2006)، "Silencing of Hepatitis A Virus Infection by Small Interfering RNAs"، J Virol، 80 (11): 5599–610، doi:10.1128/JVI.01773-05، PMC 1472172، PMID 16699041.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Jia F, Zhang Y, Liu C (2006)، "A retrovirus-based system to stably silence hepatitis B virus genes by RNA interference"، Biotechnol Lett، 28 (20): 1679–85، doi:10.1007/s10529-006-9138-z، PMID 16900331.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Li Y, Kong L, Cheng B, Li K (2005)، "Construction of influenza virus siRNA expression vectors and their inhibitory effects on multiplication of influenza virus"، Avian Dis، 49 (4): 562–73، doi:10.1637/7365-041205R2.1، PMID 16405000.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Hu L, Wang Z, Hu C, Liu X, Yao L, Li W, Qi Y (2005)، "Inhibition of Measles virus multiplication in cell culture by RNA interference"، Acta Virol، 49 (4): 227–34، PMID 16402679.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Raoul C, Barker S, Aebischer P (2006)، "Viral-based modelling and correction of neurodegenerative diseases by RNA interference"، Gene Ther، 13 (6): 487–95، doi:10.1038/sj.gt.3302690، PMID 16319945.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Putral L, Gu W, McMillan N (2006)، "RNA interference for the treatment of cancer"، Drug News Perspect، 19 (6): 317–24، doi:10.1358/dnp.2006.19.6.985937، PMID 16971967.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Izquierdo M (2005)، "Short interfering RNAs as a tool for cancer gene therapy"، Cancer Gene Ther، 12 (3): 217–27، doi:10.1038/sj.cgt.7700791، PMID 15550938.
- Li C, Parker A, Menocal E, Xiang S, Borodyansky L, Fruehauf J (2006)، "Delivery of RNA interference"، Cell Cycle، 5 (18): 2103–9، doi:10.4161/cc.5.18.3192، PMID 16940756.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Takeshita F, Ochiya T (2006)، "Therapeutic potential of RNA interference against cancer"، Cancer Sci، 97 (8): 689–96، doi:10.1111/j.1349-7006.2006.00234.x، PMID 16863503.
- Ma, Z (2005)، "Cationic lipids enhance siRNA-mediated interferon response in mice"، Biochemical and Biophysical Research Communications، 330 (3): 755–759، doi:10.1016/j.bbrc.2005.03.041، مؤرشف من الأصل في 5 نوفمبر 2018.
{{استشهاد بدورية محكمة}}: صيانة CS1: extra punctuation (link) - Morrissey, DV (2005)، "Potent and persistent in vivo anti-HBV activity of chemically modified siRNAs"، Nature Biotechnology، 23 (8): 1002–1007، doi:10.1038/nbt1122، مؤرشف من الأصل في 23 مارس 2017.
- Urban-Klein, B (2004)، "RNAi-mediated gene-targeting through systemic application of polyethylenimine (PEI)-complexed siRNA in vivo"، Gene Therapy، 12 (5): 461–466، doi:10.1038/sj.gt.3302425، مؤرشف من الأصل في 7 يوليو 2016.
- Zintchenko, A (2008)، "Simple modifications of branched PEI lead to highly efficient siRNA carriers with low toxicity"، Bioconjugate Chemistry، 19 (7): 1448–1455، doi:10.1021/bc800065f، مؤرشف من الأصل في 3 ديسمبر 2019.
- Bartlett, DW (2006)، "Insights into the kinetics of siRNA-mediated gene silencing from live-cell and live-animal bioluminescent imaging"، Nucleic Acids Research، 34 (1): 322–333، doi:10.1093/nar/gkj439، مؤرشف من الأصل في 14 مارس 2020.
- Tong A, Zhang Y, Nemunaitis J (2005)، "Small interfering RNA for experimental cancer therapy"، Curr Opin Mol Ther، 7 (2): 114–24، PMID 15844618.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Check, Erika، "RNA treatment kills mice"، نيتشر (مجلة)، Nature Publishing Group، doi:10.1038/news060522-10، مؤرشف من الأصل في 29 أبريل 2014، اطلع عليه بتاريخ 17 ديسمبر 2012.
- Grimm D, Streetz K, Jopling C, Storm T, Pandey K, Davis C, Marion P, Salazar F, Kay M (2006)، "Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways"، Nature، 441 (7092): 537–41، Bibcode:2006Natur.441..537G، doi:10.1038/nature04791، PMID 16724069.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Berkhout, B; ter Brake, O (2010)، "RNAi Gene Therapy to Control HIV-1 Infection"، RNA Interference and Viruses: Current Innovations and Future Trends، Caister Academic Press، ISBN 978-1-904455-56-1.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Grimm D, Kay M. Therapeutic application of RNAi: is mRNA targeting finally ready for prime time?. Journal Of Clinical Investigation [serial online]. December 2007;117(12):3633-3641. Available from: Academic Search Elite, Ipswich, MA. Accessed April 3, 2012.
- Sunilkumar G, Campbell L, Puckhaber L, Stipanovic R, Rathore K (2006)، "Engineering cottonseed for use in human nutrition by tissue-specific reduction of toxic gossypol"، Proc Natl Acad Sci USA، 103 (48): 18054–9، Bibcode:2006PNAS..10318054S، doi:10.1073/pnas.0605389103، PMC 1838705، PMID 17110445.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Siritunga D, Sayre R (2003)، "Generation of cyanogen-free transgenic cassava"، Planta، 217 (3): 367–73، doi:10.1007/s00425-003-1005-8، PMID 14520563.
- Le L, Lorenz Y, Scheurer S, Fötisch K, Enrique E, Bartra J, Biemelt S, Vieths S, Sonnewald U (2006)، "Design of tomato fruits with reduced allergenicity by dsRNAi-mediated inhibition of ns-LTP (Lyc e 3) expression"، Plant Biotechnol J، 4 (2): 231–42، doi:10.1111/j.1467-7652.2005.00175.x، PMID 17177799.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Sanders R, Hiatt W (2005)، "Tomato transgene structure and silencing"، Nat Biotechnol، 23 (3): 287–9، doi:10.1038/nbt0305-287b، PMID 15765076.
- Chiang C, Wang J, Jan F, Yeh S, Gonsalves D (2001)، "Comparative reactions of recombinant papaya ringspot viruses with chimeric coat protein (CP) genes and wild-type viruses on CP-transgenic papaya"، J Gen Virol، 82 (Pt 11): 2827–36، PMID 11602796.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Matson RS (2005)، Applying genomic and proteomic microarray technology in drug discovery، CRC Press، ISBN 0-8493-1469-0.
- Zhang XHD (2011)، Optimal High-Throughput Screening: Practical Experimental Design and Data Analysis for Genome-scale RNAi Research، Cambridge University Press، ISBN 978-0-521-73444-8، مؤرشف من الأصل في 14 مارس 2020.
- بوابة أيض
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الفيروسات