تعرف جزيئي
التعرف الجزيئي هو تآثر خاص بين جزيئين أو أكثر عبر ترابط غير تساهمي مثل: الترابط الهيدروجيني، تناسق الفلز، القوى الكارهة للماء،[2][3] قوى فان دير فالس، تآثرات π-π، الترابط الهالوجيني، التأثيرات الكهروستاتيكية و/أو الكهرومغناطيسية.[4] فضلا عن هذه التآثرات المباشرة يمكن لمذيب أن يلعب دورا رئيسا غير مباشرٍ في قيادة التعرف الجزيئي في المحلول.[5][6] كيمياء ضيف-مضيف المشارِكة في التعرف الجزيئي تُظهِر تكاملا جزيئيا.[7][8]
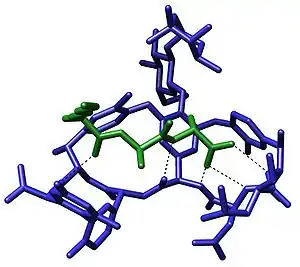
أنظمة بيولوجية
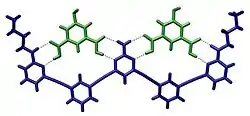
يلعب التعرف الجزيئي دورا مهما في الأنظمة البيولوجية ويُلاحظ بين المستقبِل-الربيطة،[2][3] مولد الضد-الجسم المضاد، الدنا-البروتين، السكر-الليكتين، الرنا-الريبوسوم ..إلخ. من الأمثلة المهمة على التعرف الجزيئي المضاد الحيوي فانكوميسين الذي يرتبط اختياريا مع البيدبتيدات التي تحوي النهاية D-alanyl-D-alanine في الخلايا البكتيرية عبر خمس روابط هيدروجينية. الفانكوميسين قاتل للبكتيريا لأنه حين يرتبط بهذه البيبتيدات المحددة تُصبح غير قابلة للاستخدام في بناء الجدار الخلوي للبكتيريا.
التعرف الجزيئي الصناعي
تقترح بعض الأبحاث الحديثة أن عناصر التعرف الجزيئي يمكن إنتاجها بأبعاد النانو،[10] متحايلةً على الحاجة إلى وجود عناصر تعرف جزيئي طبيعية لتطوير أدوات استشعار للجزيئات الصغيرة. يمكن أن تُستخدم بوليميرات المحاكاة الحيوية مثل البيبتويدات في التعرف على أهداف بيولوجية أكبر مثل البروتينات[11] وتحول البوليميرات إلى مواد نانوية صناعية فلورية يمكن أن يولد هياكل صناعية ميكروية تعمل كأجسام مضادة لتعرفٍ بصريٍّ وكشف للبروتين.[12]
الأنظمة الجزيئات الضخمة

أظهر علماء الكيمياء أن أنظمة الجزيئات الضخمة الصناعية يمكن أن تُصمَّمَ لإظهار تعرف جزيئي. أحد الأمثلة الأولى على مثل هذه الأنظمة هي الإيثرات التاجية التي يمكنها الارتباط اختياريا بالكايتونات، ومنذ ذلك الوقت تم إنشاء العديد من الأنظمة الصناعية.
ساكن مقابل الحركي
يمكن تقسيم التعرف الجزيئي إلى تعرف جزيئي ساكن وتعرف جزيئي حركي. يرتبط التعرف الجزيئي الساكن بالتآثرات بين المفتاح وثقب المفتاح وهو تعقيد تفاعلي من النوع 1:1 بين جزيء مضيف وجزيء ضيف لتشكيل مركب ضيف-مضيف. لتحقيق تعرف جزيئي ساكن متقدم، من الضروري إنشاء مواقع تعرف مخصصة لجزيئات ضيفة.
في حالة التعرف الجزيئي الحركي؛ ارتباط أول ضيف بأول موقع ارتباط للمضيف يؤثر على ثابت ارتباط الضيف الثاني بموقع الارتباط الثاني.[13] في حالة الأنظمة التفارغية الإيجابية ارتباط أول ضيف يزيد من ثابت ارتباط الضيف الثاني، بينما في الأنظمة التفارغية السلبية ارتباط الضيف الأول يقلل من ثابت ارتباط الضيف الثاني. الطبيعة الحركية لهذا النوع من التعرف الجزيئي مهمة بشكل خاص لأنها توفر آلية لتنظيم ترابط الأنظمة البيولوجية. يمكن أن يحسن التعرف الجزيئي الديناميكي قابلية التمييز بين الأهداف المتعدد المتنافسة عبر آلية تعرف وتدقيق بنيوية، وتتم دراسته كذلك من أجل تطبيقه لإنشاء مستشعرات كيميائية عالية الحساسية وأجهزة جزيئية.
التعقيد
تصف دراسة حديثة مبنية على محاكاة جزيئية وثوابت المطاوعة التعرفَ الجزيئيَّ على أنه ظاهرة تنظيم. حتى بالنسبة لجزيئات صغيرة مثل السكريات، لايمكن التنبؤ بعملية التعرف أو تصميمها حتى بافتراض معرفة قوة كل رابطة هيدروجينية تماما.[14] استخلص موبلي وزملاؤه [15] أن دقة التنبؤ بأحداث التعرف الجزيئي تحتاج معرفة تتجاوز الصورة العامة للترابط بين الضيف والمضيف. الإنتروبيات هي مساهمات مفتاحية في الترابط الديناميكي الحراري ويجب أخذها بالاعتبار في سبيل تنبؤٍ أكثر دقة لعملية التعرف. الأنتروبيات غير مرئية في البنيات أحادية الرابطة.
المراجع
- Knox, James R.؛ Pratt, R. F. (يوليو 1990)، "Different modes of vancomycin and D-alanyl-D-alanine peptidase binding to cell wall peptide and a possible role for the vancomycin resistance protein"، Antimicrobial Agents and Chemotherapy، 34 (7): 1342–7، doi:10.1128/AAC.34.7.1342، PMC 175978، PMID 2386365، مؤرشف من الأصل (Free full text) في 11 يونيو 2011.
- "The Binding of Benzoarylsulfonamide Ligands to Human Carbonic Anhydrase is Insensitive to Formal Fluorination of the Ligand"، Angew. Chem. Int. Ed.، 52 (30): 7714–7717، 2003، doi:10.1002/anie.201301813، PMID 23788494.
- "Water Networks Contribute to Enthalpy/Entropy Compensation in Protein–Ligand Binding"، J. Am. Chem. Soc.، 135 (41): 15579–15584، 2013، doi:10.1021/ja4075776، PMID 24044696.
- Cosic, I (1994)، "Macromolecular bioactivity: is it resonant interaction between macromolecules?—theory and applications"، IEEE transactions on bio-medical engineering، 41 (12): 1101–14، doi:10.1109/10.335859، PMID 7851912.
- Baron, Riccardo؛ Setny, Piotr؛ McCammon, J. Andrew (2010)، "Water in Cavity-Ligand Recognition"، Journal of the American Chemical Society، 132 (34): 12091–12097، doi:10.1021/ja1050082، PMC 2933114، PMID 20695475.
- Baron, Riccardo؛ McCammon, J. Andrew (2013)، "Molecular Recognition and Ligand Binding"، Annual Review of Physical Chemistry، 64: 151–175، Bibcode:2013ARPC...64..151B، doi:10.1146/annurev-physchem-040412-110047، PMID 23473376.
- Lehn, Jean-Marie (1995)، Supramolecular Chemistry، فاينهايم: Wiley-VCH، ISBN 978-3-527-29312-4، OCLC 315928178.[بحاجة لرقم الصفحة]
- Gellman, Samuel H. (1997)، "Introduction: Molecular Recognition"، Chemical Reviews، 97 (5): 1231–1232، doi:10.1021/cr970328j، PMID 11851448.
- Bielawski, Christopher؛ Chen, Yuan-Shek؛ Zhang, Peng؛ Prest, Peggy-Jean؛ Moore, Jeffrey S. (1998)، "A modular approach to constructing multi-site receptors for isophthalic acid"، Chemical Communications (12): 1313–4، doi:10.1039/a707262g، مؤرشف من الأصل (Free full text) في 15 ديسمبر 2019.
- Zhang, Landry, Strano et al. Nature Nanotechnology 2013 http://www.nature.com/nnano/journal/v8/n12/full/nnano.2013.236.html
- Mannige, Ranjan V.؛ Haxton, Thomas K.؛ Proulx, Caroline؛ Robertson, Ellen J.؛ Battigelli, Alessia؛ Butterfoss, Glenn L.؛ Zuckermann, Ronald N.؛ Whitelam, Stephen (15 أكتوبر 2015)، "Peptoid nanosheets exhibit a new secondary-structure motif"، Nature (باللغة الإنجليزية)، 526 (7573): 415–420، Bibcode:2015Natur.526..415M، doi:10.1038/nature15363، ISSN 0028-0836، مؤرشف من الأصل في 15 ديسمبر 2019.
- Beyene, Abraham G.؛ Demirer, Gozde S.؛ Landry, Markita P. (01 يناير 2009)، Current Protocols in Chemical Biology (باللغة الإنجليزية)، John Wiley & Sons, Inc.، doi:10.1002/cpch.10/full، ISBN 9780470559277، مؤرشف من الأصل في 10 مايو 2017.
- Shinkai, Seiji؛ Ikeda, Masato؛ Sugasaki, Atsushi؛ Takeuchi, Masayuki (2001)، "Positive allosteric systems designed on dynamic supramolecular scaffolds: toward switching and amplification of guest affinity and selectivity"، Accounts of Chemical Research، 34 (6): 494–503، doi:10.1021/ar000177y، PMID 11412086.
- Complexity in Molecular Recognition, Phys. Chem. Chem. Phys., 2011, 13, 10136-10146
- Binding of Small-Molecule Ligands to Proteins: "What You See" Is Not Always "What You Get", Structure 17(4): 489-498, 2009
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء الحيوية