تغير هيئي
التغير الهَيئِيّ (بالإنجليزية: Conformational change) هو تغيّر في شكل بنية جزيء كبير عادة ما تُحدثه عوامل محيطية. الجزيئات الكبيرة مرنة وديناميكية في العادة، ويمكن أن يتغير شكل بنيتها استجابة لتغيرات في محيطها أو عوامل أخرى، يسمى كل شكل يمكن أن تتخذه بنية جزيء بالهيئة والانتقال بين هاته الأشكال يسمى تغير هيئي.
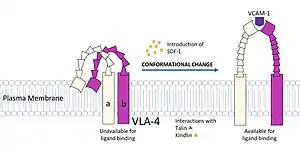

من العوامل التي يمكن أن تسبب تغيرًا هيئيًا: الحرارة، الأس الهيدروجيني، الجهد الكهربائي، الضوء في حوامل اللون، تراكيز الأيونات، الفسفرة، أو ارتباط ربيطة. يحدث الانتقال بين هاته الحالات على مقاييس طول (من الأنغستروم إلى النانومتر) ومقاييس زمن (نانوثانية إلى ثانية) مختلفة، وتم ربطها بظواهر وظيفية مثل التأشير التفارغي[1] وتحفير الإنزيم.[2]
يمكن استخدام العديد من التقنيات الفيزيائية الحيوية لدراسة التغيرات الهيئيّة للجزيئات الكبيرة ومنها: علم البلورات السيني، مطيافية الرنين المغناطيسي النووي، الرنين البارامغنطيسي الإلكتروني، ازدواج اللون الدائري، تبادل الهيدروجين ديوتيريوم [الإنجليزية] ونقل الطاقة برنين فورستر (FRET). قياس التداخل ثنائي الاستقطاب هي تقنية قادرة على توفير معلومات حول التغيرات الهيئيّة في الجزيئات الحيوية.[3]
دراسات حاسوبية
يمكن لعلم البلورات السيني توفير معلومات حول التغيرات في الهيئة على المستوى الذري، لكن تكاليف وصعوبة الاختبارات التي تُستخدم فيها تجعل الطرق الحاسوبية بديلا أكثر جاذبية.[4] يمكن استخدام وضع التحليل العادي مع نماذج الشبكة المرنة مثل نموذج الشبكة الغاوسي [الإنجليزية] لسبر مسارات الديناميكا الجزيئية وكذلك البنُى المعروفة.[5][6] برنامج ProDy وسيلة مشهورة لإجراء مثل تلك التحاليل.[7]
مراجع
- "Proteins move! Protein dynamics and long-range allostery in cell signaling"، Protein Structure and Diseases، Advances in Protein Chemistry and Structural Biology، ج. 83، 2011، ص. 163–221، doi:10.1016/B978-0-12-381262-9.00005-7، ISBN 9780123812629، PMID 21570668.
- "Hidden alternative structures of proline isomerase essential for catalysis"، Nature، 462 (7273): 669–73، ديسمبر 2009، Bibcode:2009Natur.462..669F، doi:10.1038/nature08615، PMC 2805857، PMID 19956261.
- "Real time, high resolution studies of protein adsorption and structure at the solid–liquid interface using dual polarization interferometry"، Journal of Physics: Condensed Matter، 16 (26): S2493–S2496، 19 يونيو 2004، doi:10.1088/0953-8984/16/26/023، ISSN 0953-8984، مؤرشف من الأصل في 31 أغسطس 2021.
- "Chapter 3. High-throughput protein purification for x-ray crystallography and NMR"، Advances in Protein Chemistry and Structural Biology، 75: 85–105، 01 يناير 2008، doi:10.1016/S0065-3233(07)75003-9، PMC 3366499، PMID 20731990.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - "Long-range correlation in protein dynamics: Confirmation by structural data and normal mode analysis"، PLOS Computational Biology، 16 (2): e1007670، فبراير 2020، doi:10.1371/journal.pcbi.1007670، PMC 7043781، PMID 32053592.
- "A comparative study of motor-protein motions by using a simple elastic-network model"، Proceedings of the National Academy of Sciences of the United States of America، 100 (23): 13253–8، نوفمبر 2003، doi:10.1073/pnas.2235686100، PMC 263771، PMID 14585932.
- "ProDy: protein dynamics inferred from theory and experiments"، Bioinformatics، 27 (11): 1575–7، يونيو 2011، doi:10.1093/bioinformatics/btr168، PMC 3102222، PMID 21471012.
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء الحيوية