حمض الأنثرانيليك
حمض الأنثرانيليك هو حمض عطري صيغته الكيميائية C6H4(NH2)(CO2H) وطعمه حلو.[3] [4] [5] يتكوّن جزيء الأنثرانيليك من حلقة البنزين، نمط الاستبدال في الحلقات العطرية|تستبدل الحلقات العطرية مع حمض الكربوكسيلية و الأمينات. نتيجة لاحتوائه على المجموعات الوظيفية الحمضية والأساسية، يكون المركب مذبذبًا. عندما يكون الأنثرانيليك نقياً يكون بشكل مادة صلبة بيضاء، على الرغم من أن العينات التجارية قد تظهر صفراء. الأنيون[C6H4(NH2)(CO2)]−، الذي يتم الحصول عليه عن طريق نزع بروتون حمض الأنثرانيليك، يسمى anthranilate. كان يُعتقد أن حمض الأنثرانيليك عبارة عن فيتامين وكان يشار إليه باسم فيتامين L1، ولكن من المعروف الآن أنه غير ضروري في تغذية الإنسان.
| حمض الأنثرانيليك | |
|---|---|
 نموذج الكرات والعصيّ لتمثيل جزيء حمض الأنثرانيليك |
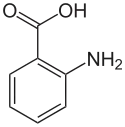 الصيغة التركيبية لحمض الأنثرانيليك |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
2-Aminobenzoic acid[1] | |
| تسمية الاتحاد الدولي للكيمياء | |
2-Aminobenzenecarboxylic acid | |
| أسماء أخرى | |
| |
| المعرفات | |
| رقم CAS | 118-92-3 |
| بوب كيم (PubChem) | 227 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | C7H7NO2 |
| كتلة مولية | 137.14 غ.مول−1 |
| المظهر | مادة صلبة بيضاء أو صفراء |
| الرائحة | عديم الرائحة |
| الكثافة | 1.412 g/cm3 |
| نقطة الانصهار | 146 إلى 148 °س، خطأ في التعبير: علامة ترقيم لم نتعرف عليها «إ». °ك، خطأ في التعبير: علامة ترقيم لم نتعرف عليها «إ». °ف |
| نقطة الغليان | 200 °س، 473 °ك، 392 °ف |
| الذوبانية في الماء | 0.572 غم/100 مل (25 °درجة مئوية) |
| الذوبانية | شديد الذوبان في الكلوروفورم والبيريدين يذوب في الإيثانول، الإيثر، ثنائي إيثيل الإيثر قليل الذوبان في ثلاثي فلورو أسيتيك والبنزين |
| log P | 1.21 |
| ضغط البخار | 0.1 Pa (52.6 °C) |
| حموضة (pKa) |
|
| قابلية مغناطيسية | -77.18·10−6 cm3/mol |
| معامل الانكسار (nD) | 1.578 (144 °C) |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الاستخدامات
صناعيًا، حمض الأنثرانيليك هو وسيط يُستخدم لإنتاج أصباغ الآزو والسكارين. يستخدم وإستراته في تحضير العطور بمماثلة روائح الياسمين والبرتقال، والمستحضرات الصيدلانية (مدرات البول الحلقية، مثل الفوروسيميد) وممتص للأشعة فوق البنفسجية، بالإضافة إلى مثبطات تآكل المعادن ومثبطات العفن في صلصة الصويا.
اقتُرح استخدام مبيدات الحشرات المصنّعة باستخدام الأنثرانيلات كبدائل لمبيدات ديت.
حمض الفيناميك هو أحد مشتقات حمض الأنثرانيليك، [6] :235 والذي بدوره عبارة عن إيزوستير نيتروجين لحمض الساليسيليك، وهو المستقلب النشط للأسبرين :235 العديد من العقاقير غير الستيرويدية المضادة للالتهابات ، بما في ذلك حمض الميفيناميك وحمض التوفيناميك وحمض الفلوفيناميك وحمض ميكلوفيناميك مشتقة من حمض الفيناميك أو حمض الأنثرانيليك وتسمى «مشتقات حمض الأنثرانيليك» أو «الفينامات».[7] :17
التفاعلات
يمكن تحويل حمض أنثرانيليك إلى ديازوتيز لتكوين ديازونيوم كاتيون [C6H4(CO2H)(N2)]+. يمكن استخدام هذا الكاتيون لتوليد بنزين، أو ثنائي الصوديوم لإعطاء حمض ديفينيك، [8] أو الخضوع لتفاعلات اقتران الديازونيوم كما هو الحال في تخليق أحمر الميثيل .
يتفاعل مع الفوسجين ليعطي أنهيدريد isatoic ، وهو كاشف متعدد الاستخدامات.[9]
ينتج عن معالجة حمض الأنثرانيليك بالكلور مشتق مشتق 4-ثنائي كلورو، والذي يمكن أن يخضع لاقتران اختزالي لتشكيل مركب بياريل.[10]
السلامة والتنظيم
هو أيضًا أحد المواد الكيميائية المدرجة في قائمة إدارة مكافحة المخدرات (DEA) نظرًا لاستخدامه في صنع عقار ميثاكوالون المهدئ الذي يسبب البهجة، وهو محظور الآن على نطاق واسع (كوالود ، ماندراكس).[11]
انظر أيضًا
- كينورينيناز
- 3-حمض أمينوبنزويك
- 4-حمض أمينوبنزويك
- ميثيل أنثرانيلاتي
المراجع
- "Front Matter"، Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)، Cambridge: الجمعية الملكية للكيمياء، 2014، ص. 748، doi:10.1039/9781849733069-FP001، ISBN 978-0-85404-182-4.
- Haynes, William M., المحرر (2016)، CRC Handbook of Chemistry and Physics (ط. 97th)، سي آر سي بريس، ص. 5–89، ISBN 978-1498754286.
-
{{استشهاد بكتاب}}: استشهاد فارغ! (مساعدة) -
{{استشهاد بكتاب}}: استشهاد فارغ! (مساعدة) - The Merck Index, 10th Ed. (1983), p.62., Rahway: Merck & Co.
- Sriram D, Yogeeswari P. Medicinal Chemistry, 2nd Edition. نسخة محفوظة 5 سبتمبر 2020 على موقع واي باك مشين.
- Auburn University course material.
- Atkinson, E. R.؛ Lawler, H. J. (1927)، "Diphenic Acid"، Organic Syntheses، 7: 30، doi:10.15227/orgsyn.007.0030.
- Wagner, E. C.؛ Fegley, Marion F. (1947)، "Isatoic anhydride"، Org. Synth.، 27: 45، doi:10.15227/orgsyn.027.0045.
- (1951)"dl-4,4',6,6'-Tetrachlorodiphenic Acid". Org. Synth.31.
- Angelos SA, Meyers JA (1985)، "The isolation and identification of precursors and reaction products in the clandestine manufacture of methaqualone and mecloqualone"، Journal of Forensic Sciences، 30 (4): 1022–1047، PMID 3840834.
- بوابة الكيمياء
- بوابة كيمياء عضوية