خلل التنسج العضلي الليفي
خلل التنسج العضلي الليفي(بالإنجليزية: fibromuscular dysplasia) هو انعدام التصلب العصيدي مصحوبا بمرض الأوعية الدموية غير الملتهبة الذي يسبب نمو غير طبيعي داخل جدار الشريان،[1] وقد تم العثور على خلل التنسج العضلي الليفي في كل فراش شرياني تقريبًا في الجسم على الرغم من أن الشرايين الأكثر شيوعًا بالإصابة هي الشرايين الكلوية والسباتية. [1][2][3]
| خلل التنسج العضلي الليفي | |
|---|---|
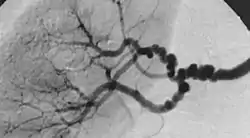 شكل "خيط السبحة" في خلل التنسج الليفي العضلي متعدد البؤر، وتحدث بسبب مناطق التضيق النسبي بالتناوب مع تمدد الأوعية الدموية الصغيرة. شكل "خيط السبحة" في خلل التنسج الليفي العضلي متعدد البؤر، وتحدث بسبب مناطق التضيق النسبي بالتناوب مع تمدد الأوعية الدموية الصغيرة. | |
| معلومات عامة | |
| الاختصاص | طب القلب |
| من أنواع | أمراض الانسداد الشريانية |
هناك أنواع مختلفة من الخلل التنسج العضلي الليفي ويعد التنسج الليفي متعدد البؤر هو الأكثر شيوعًا، علاوة على ذلك تشمل أشكال المرض الأقل شيوعًا التنسج الليفي البؤري (المعروف سابقًا باسم المتعلق ببطانة الشريان) والتنسج الليفي البراني،[1][2][3][4] ويؤثر خلل التنسج العضلي الليفي في الغالب على النساء في منتصف العمر لكنه يوجد لدى الرجال والأشخاص من جميع الأعمار،[1] وتختلف حالات خلل التنسج الليفي العضلي عند الأطفال اختلافًا كبيرًا عن حالات البالغين ويتم دراستها بشكل سيء، ويعد انتشار خلل التنسج العضلي الليفي غير معروف، ورغم أنه كان يعتقد في البداية أن المرض نادر فقد أشارت الدراسات الحديثة إلى أنه قد يكون منخفض التشخيص. [5]
العلامات والأعراض
تعتمد الأعراض التي يعبر عنها مرضى خلل التنسج العضلي الليفي إلى حد كبير على الفراش الوعائي المتأثر بالمرض، وقد يكون المرضى أيضًا بدون أعراض تمامًا ولديهم خلل التنسج العضلي الليفي المكتشف عن طريق المصادفة (عند إجراء دراسات بالتصوير لأسباب أخرى مثلا)، وفي دراسة من مكتب تسجيل الولايات المتحدة لخلل التنسج الليفي العضلي كان متوسط العمر للعرض الأول حوالي 47 عام.[2]
الشرايين الكلوية
الأعراض الرئيسية المرتبطة بخلل التنسج العضلي الليفي هي ارتفاع ضغط الدم الثانوي واللغطات التي يمكن سماعها من خلال سماعة الطبيب على البطن أو الخاصرة، وقد ارتبطت مضاعفات مثل الأنورسما (أم الدم) أو التسلخ أو انسداد الشريان الكلوي مع خلل التنسج العضلي الليفي للشريان الكلوي.[4]
المناطق الدماغية الوعائية
تتأثر الشرايين السباتية والفقارية في الغالب، وكثيرا ما تشترك معها المناطق الوسطى والبعيدة من الشرايين السباتية الداخلية، [1] ويتضح أن المرضى الذين يعانون من خلل التنسج العضلي الليفي في الشرايين السباتية يبلغون عادة حوالي 50 سنة من العمر،[3] وتشمل أعراض اشتراك العنق القحفي الصداع (غالبا الصداع النصفي) والطنين النابض والدوخة وآلام الرقبة على الرغم من أن المرضى غالباً ما يكونون بدون أعراض، وعند الفحص البدني يمكن اكتشاف الأعراض العصبية الثانوية لسكتة دماغية أو نوبة نقص تروية عابرة (TIA) ولغط فوق الشريان المصاب وتناقص النبض البعيد، وتشتمل مضاعفات خلل التنسج العضلي الليفي بالمناطق الدماغية الوعائية نوبة نقص تروية عابرة أو السكتة الدماغية النزفية أو متلازمة هورنر أو نزيف تحت العنكبوتية.[1][2][3]
مواقع أخرى
المرضى الذين يعانون من احتشاء مساريقي أو خلل التنسج العضلي الليفي المعوي قد يعانون من آلام في البطن بعد تناول الطعام أو فقدان الوزن، وقد يسبب خلل التنسج العضلي الليفي داخل الأطراف العرج أو قد يمكن اكتشافه بواسطة اللغوط،[1] إذا تأثرت شرايين الطرف السفلي فقد يصاب المريض بأرجل باردة دليلا على الإصابة بانسداد وعائي بالأماكن البعيدة، قد يسبب خلل التنسج العضلي الليفي الموجود في الشريان تحت الترقوة ضعف في الذراع وتقوس وعرج ومتلازمة سرقة تحت الترقوة.[6]
الأطفال
الأطفال الذين يعانون من خلل التنسج العضلي الليفي غالباً ما يبلغون عن أعراض مختلفة غير محددة أو يعانون من ارتفاع ضغط الدم خلال الفحوصات البدنية الروتينية، وترتبط الأعراض عادةً بالشريان المصاب، وقد تشمل الأعراض الصداع والأرق والتعب وألم في الصدر أو البطن، ويعد خلل التنسج العضلي الليفي التي تؤثر على شرايين رقبة الرأس معروفا بشكل شائع كسبب للسكتات الدماغية للأطفال.[7]
قد ينشأ الاكتشاف عن وجود لغط فوق الفراش الوعائي المصاب أثناء إجراء الفحص البدني، ومع ذلك فإن عدم وجود لغط لا يستثني مرض الأوعية الدموية الكبير.[8]
وفي الأطفال تمثل الأمراض الوعائية الكلوية حوالي 10٪ من جميع أسباب ارتفاع ضغط الدم الثانوي،[8] ويعتبر الفشل الكلوي عرض شائع عند الرضع والأطفال ولكنه غير شائع عند البالغين على الرغم من أنه يمثل مشكلة في بعض الأحيان عند البالغين المصابين بمرض بؤري،[3]
السبب
في حين لا يزال سبب خلل التنسج العضلي الليفي غير واضح تشير النظرية الحالية إلى أنه قد يكون هناك استعداد وراثي لأن تقارير الحالة قد حددت مجموعات من المرض وانتشاره بين التوائم،[7] في الواقع فإنه وفقًا لمستشفي كليفلاند كلينك فإن حوالي 10٪ من الحالات تبدو وراثية وغالبًا ما تتعايش مع تشوهات جينية أخرى تؤثر على الأوعية الدموية، وما يقرب من 10٪ من المرضى الذين يعانون من خلل التنسج العضلي الليفي لديهم أحد أفراد الأسرة متضررا،[1] أفادت دراسة أجريت من سجل المرضى في برنامج لبحوث وتقارير نتائج القلب والأوعية الدموية في ميتشيغان (MCORRP) في النظام الصحي بجامعة ميشيغان عن ارتفاع نسبة الإصابة بسكتة دماغية في تاريخ العائلة بنسبة (53.5٪) وأم الدم (الأنورسما) بنسبة (23.5٪) والموت المفاجئ بنسبة ( 19.8٪)،[2] وعلى الرغم من أن خلل التنسج العضلي الليفي هو مرض عائلي غير مصاحب بتصلب الشرايين فإن تاريخ الإصابة بارتفاع ضغط الدم وفرط شحميات الدم كانت شائعة أيضًا بين المصابين بخلل التنسج العضلي الليفي، ومن المعتقد أن سبب خلل التنسج العضلي الليفي ليس محددا بمفرده مثل علم الوراثة ولكن له عدة عوامل أساسية، نظريات التأثير الهرموني -الإجهاد الميكانيكي من الصدمة والضغط على جدران الشرايين- وكذلك تأثير فقدان الأكسجين في جدار الوعاء الدموي الناجم عن الآفات الليفية[7] اقترحت أن العوامل البيئية مثل التدخين والإستروجين قد تلعب دورًا بالإضافة إلى العوامل الوراثية.
الفيزيولوجيا المرضية
يمكن العثور على خلل التنسج العضلي الليفي في كل شريان في جسم الإنسان تقريبًا، ولكن غالبًا ما يصيب الشرايين السباتية والفقارية والكلوية وحتى تلك التي تمد الأمعاء والذراعين والساقين،[1] وقد تم تصنيف خلل التنسج العضلي الليفي بشكل مرضي إلى ثلاثة أنواع من التصنيفات: متعدد البؤر وبؤري وبراني إشارة إلى طبقة معينة من الجدار الشرياني تتأثر. [4]
بؤري
يعد الشكل الأكثر شيوعًا في طب الأطفال للإصابة بمرض FMD هو التنسج الليفي البؤري، ويوصف التنسج الليفي البؤري بأنه تضيق بؤري طويل ضيق غير منتظم أو أملس ويمكن أن يحدث في أي سرير شرياني، وفي حين أن هذا هو النوع الأكثر شيوعًا بين الأطفال إلا أنه لا يمثل سوى حوالي 10٪ من حالات مرض خلل التنسج العضلي الليفي بشكل عام،[8] وغالبًا ما تظهر عليه أعراض نقص التروية، وغالبًا ما تكون مخطئة بسبب التهاب الشرايين تاكاياسو[9] (المعروف سابقًا باسم باطنة الشريان).
متعدد البؤر
النوع الثاني هو التنسج الليفي المتعدد البؤر الذي ينطوي على تكثيف الوسط وتشكيل الكولاجين، وعادة ما يتم الإبلاغ عن وجود "خيط السبحة" في مراجعة الصورة الوعائية،[4] "السبحة" غالبًا ما تكون أكبر من التجويف الشرياني الطبيعي، وفي مجموعة فرعية من مرضى يحدث تمدد الأوعية الدموية وقد تتطلب العلاج،[4] ويشغل النوع الفرعي متعدد البؤر من FMD ما يقرب من 80٪ إلى 90٪ من جميع الحالات FMD [4] (المعروف سابقًا باسم الإنسي).
براني
التصنيف الثالث هو التنسج الليفي البراني حيث يحل الكولاجين محل الطبقة الليفية البرانية من الاوعية الدموية ويمتد إلى ما بعد الشريان، ويعتبر هذا النموذج نادرًا ولكن قد يبدو المظهر الوعائي مشابهًا للنوع الفرعي البؤري لـ FMD مما يجعل التمييز صعبًا.
تشخيص
إن قلة الأعراض المحددة وإمكانية ظهورها في أي مكان تجعل من مرض خلل التنسج العضلي الليفي تحديا يجب اكتشافه في وقت مبكر، ويأتي التشخيص الأكثر دقة من الجمع بين العرض السريري والتصوير الوعائي، ووفقًا لبرنامج ميشيغان لأبحاث وتقارير النتائج (MCORRP ، 2013) فإن طول الفترة الزمنية من ظهور الأعراض الأولى للمريض إلى التشخيص هو عادةً 5 سنوات.
يتم تشخيص خلل التنسج العضلي الليفي حاليا من خلال استخدام كل من الاختبارات الغازية وغير الغازية، وتشمل الاختبارات غير الغازية تخطيط صدى القلب الدوبلري وتصوير الأوعية بالرنين المغناطيسي وتصوير الأوعية الطبقي المبرمج (CTA)،[4] ويعد اختبار الغازية من خلال تصوير الأوعية هو المعيار الذهبي، ومع ذلك فإنه بسبب ارتفاع خطر حدوث مضاعفات فعادة لا يتم في وقت مبكر، وفي بعض الأحيان يتم تشخيص مرض FMD بدون أعراض بعد أن تعرض الأشعة السينية غير المرتبطة شكل "خيط السبحة" الكلاسيكي للشرايين أو عندما يحقق ممارس في لغط غير متوقع تم العثور عليه أثناء الفحص، وعند النظر في تشخيص خلل التنسج العضلي الليفي للحصول على تاريخ طبي شامل للمريض يجب إكمال تاريخ العائلة وكذلك فحص الأوعية الدموية.
لا يمكن إجراء تشخيص نهائي لخلل التنسج العضلي الليفي إلا من خلال دراسات التصوير، وقد أثبت تصوير الأوعية القائم على القسطرة (على النقيض من ذلك) أنه أكثر تقنيات التصوير دقة: يتضمن هذا الاختبار إدخال قسطرة في شريان كبير فستم إدخالها حتى تصل إلى الوعاء المراد،[1] وتسمح القسطرة للممارسين بمراقبة وقياس ضغط الشريان الذي يساعد في تصنيف ووخامة الشريان المصاب بمرض خلل التنسج العضلي الليفي، ووفقا لأولين "تصوير الأوعية القائم على القسطرة هو طريقة التصوير الوحيدة التي يمكن أن تحدد بدقة التغيرات في خلل التنسج العضلي الليفي وتمدد الأوعية الدموية والتشريح في الأوعية الفرعية." ويعتقد الممارسون أنه من المهم استخدام تصوير IVUS لأن التضيق لا يمكن في بعض الأحيان اكتشافه إلا من خلال طرق تدرج الضغط أو تصوير IVUS،[4] بالإضافة إلى ذلك يتم استخدام تصوير الأوعية الطبقي المبرمج وتصوير الأوعية بالرنين المغناطيسي عادة لتقييم الشرايين في الدماغ، ويمكن استخدام تخطيط صدى القلب الدوبليري في كل من تشخيص ومتابعة خلل التنسج العضلي الليفي.[1]
الأطفال
العروض التمايزية توحي بأن خلل التنسج العضلي الليفي متلازمة فريدة فيما يتعلق بالأطفال، ويحذر أطباء FMD المتمرسون من الاعتماد على "سبحة الخرز" لتصوير الأوعية، وفي الواقع يُقترح أن خلل التنسج العضلي الليفي قد يكون ناقصًا وتشخيصًا زائدًا عند الأطفال المصابين بالجلطة الدماغية.[7]
علاج
لا يوجد علاج معروف لخلل التنسج العضلي الليفي، ومع ذلك يركز العلاج على تخفيف الأعراض المرتبطة به، وتعد الإدارة الطبية هي أكثر أشكال العلاج شيوعًا، يتم إعادة تقييم أفضل طريقة لإدارة هؤلاء المرضى طبيا باستمرار حيث يتم معرفة المزيد من المعلومات حول هذا المرض.
علاج الكلى
التحكم في ضغط الدم هو الشاغل الرئيسي عند علاج مرضى خلل التنسج العضلي الليفي في حالات التضيق الكلوي وإشارات للتدخل، وقد يوصى بعمل رأب الوعاء عن طريق الجلد، قيمت العديد من الدراسات معدل نجاح رأب الأوعية الدموية عن طريق الجلد (PTA) في هذه الحالات ووجدت تخفيفًا من أعراض ارتفاع ضغط الدم،[3][10] يجب إجراء تخطيط صدى القلب الدوبليري بعد فترة وجيزة من هذا الإجراء لضمان سرعات كلوية كافية.[3]
الدعامات لديها معدل عودة التضيق من 10-20 ٪ وربما تجعل إعادة التوعي الجراحي أكثر صعوبة، وقد يكون إعادة التوعي الجراحي ضروريًا إذا تطور تمدد الأوعية الدموية داخل الشريان المصاب أو إذا لم يحل PTA المشكلة.
وفي بعض الأحيان يتم استخدام إعادة بناء الشريان الكلوي خارج الجسم للأمراض المعقدة حيث تتأثر فروع الشريان الكلوي.[11]
علاج دماغي وعائي
المرضى الذين يعانون من خلل التنسج العضلي الليفي السباتي أو الفقري يجب أن تدار طبيا لتقليل خطر الإصابة بالسكتة الدماغية، ويوصف الأسبرين 81mg عادة للمرضى الذين يعانون من خلل التنسج العضلي الليفي السباتي، ويمكن استخدام مضادات الصفيحات و مضادات التخثر للحد من خطر تكوين تجلط الدم، وفي حالة حدوث TIA أو السكتة الدماغية فقد يكون من الضروري إجراء جراحة رأب الأوعية الدموية عن طريق الجلد واستخدام مضادات الصفيحات.[3]
علاج خلل التنسج العضلي الليفي في مناطق أخرى
يُعرف القليل من المعلومات حول أفضل علاج لمرض FMD خارج المناطق الكلوية وخارج القحف، وإذا كان العرج أو نقص تروية الأطراف ينتج عن مرض FMD في الأطراف فقد يتم تنفيذ عملية رأب الأوعية الدموية.
الأطفال
تعد علاجات FMD الطبية والجراحية أو التدخلات للأطفال متاحة، ويتم تحديد العلاج من خلال عوامل مثل العمر وموقع المرض ولكن بشكل روتيني ينطوي على السيطرة على ارتفاع ضغط الدم وإعادة إنشاء تدفق الأوعية الدموية والوقاية من الجلطة وتحسين نمط الحياة مثل النظام الغذائي وممارسة الرياضة والإقلاع عن التدخين.
قد يتضمن العلاج الطبي لسكان الأطفال استخدام مثبطات الإنزيم المحول للأنجيوتنسين (ACE) و/أو مضادات مستقبلات أنجيوتنسين II والأدوية المتعددة المضادة لارتفاع ضغط الدم ومدرات البول وحاصرات قنوات الكالسيوم ، وحاصرات البيتا يمكن أخذ الوقاية من تجلط الدم في الشرايين المصابة من خلال تناول الأدوية المضادة للصفيحات مثل الأسبرين.
لا يزال رأب الأوعية الكلوية عبر الجلد (PTRA) هو المعيار الذهبي للحمى القلاعية القلاعية، ويعد هذا العلاج مفيدا عندما يكون من الصعب السيطرة على ارتفاع ضغط الدم -المريض غير متحمل الأدوية المضادة لارتفاع ضغط الدم- لا يشتكي من نظام الدواء وفقدان المريض لحجم كلوي بسبب نقص التروية، ويمكن لـ PTRA أيضًا المساعدة في منع الاعتماد مدى الحياة على الدواء لمثل هذا المريض الشاب، وفقا لمايرز "يعد رأب الأوعية الكلوية عبر الجلد فعالا ويؤدي إلى علاج أو السيطرة على ضغط الدم والذي غالبا ما يدل عليه بانخفاض في نشاط رينين البلازما ومستويات الأنجيوتنسين 2، وعند المقارنة مع الجراحة فإن رأب الوعاء عن طريق الجلد أقل تكلفة ويمكن إجرائها في العيادات الخارجية، فيؤدي إلى انخفاض معدل المراضة، واستخدام الدعامات ليست ضرورية في المقام الأول" ومع ذلك هناك مجموعة فرعية من الأطفال الذين يقاومون PTRA، وقد تشمل الأحداث السلبية، "تضيق متكرر وانسداد الشرايين مع فقدان الكلى وتمزق الشرايين مع التسرب وتشكيل تمدد الأوعية الدموية الزائفة وقد تتطلب التدخل الجراحي.
مراجع
- "Fibromuscular dysplasia"، Circulation، 125 (18): e636–9، مايو 2012، doi:10.1161/CIRCULATIONAHA.111.090449، PMID 22566353.
- Olin J.W.؛ Froehlich J.؛ Gu X.؛ وآخرون (2012)، "The United States registry for fibromuscular dysplasia: results in the first 447 patients"، Circulation، 125 (25): 3182–90، doi:10.1161/CIRCULATIONAHA.112.091223، PMID 22615343.
- "Recognizing and managing fibromuscular dysplasia"، Cleveland Clinic Journal of Medicine، 74 (4): 273–4, 277–82، أبريل 2007، doi:10.3949/ccjm.74.4.273، PMID 17438676.
- "Diagnosis, management, and future developments of fibromuscular dysplasia"، Journal of Vascular Surgery، 53 (3): 826–36.e1، مارس 2011، doi:10.1016/j.jvs.2010.10.066، PMID 21236620.
- "Is fibromuscular dysplasia underdiagnosed? A comparison of the prevalence of FMD seen in CORAL trial participants versus a single institution population of renal donor candidates"، Vasc Med، 19 (5): 363–7، أكتوبر 2014، doi:10.1177/1358863X14544715، PMID 25082538.
- "Arterial fibromuscular dysplasia"، Mayo Clin. Proc.، 62 (10): 931–52، أكتوبر 1987، doi:10.1016/s0025-6196(12)65051-4، PMID 3309488.
- Kirton A.؛ Crone M.؛ Benseler S.؛ Mineyko A.؛ Armstrong D.؛ Wade A.؛ Crous-Tsanaclis A. M. (2013)، "Fibromuscular dysplasia and childhood stroke"، Brain، 136 (6): 1846–1856، doi:10.1093/brain/awt111، PMID 23715093.
- Meyers K. E.؛ Sharma N. (2007)، "Fibromuscular dysplasia in children and adolescents"، Cath Lab Digest، 15 (6).
- Tullus K (2013)، "Renovascular hypertension—is it fibromuscular dysplasia or Takayasu arteritis"، Pediatric Nephrology، 28 (2): 191–196، doi:10.1007/s00467-012-2151-7، PMID 22453736.
- "Percutaneous transluminal renal angioplasty in renovascular hypertension due to atheroma or fibromuscular dysplasia"، The New England Journal of Medicine، 309 (5): 274–9، أغسطس 1983، doi:10.1056/NEJM198308043090504، PMID 6223227.
- "Ex vivo renal artery reconstruction"، Annals of Surgery، 182 (4): 456–63، أكتوبر 1975، doi:10.1097/00000658-197510000-00011، PMID 1180583.
- بوابة طب