دارونافير
دارونافير هو مثبط بروتياز من الجيل الثاني ويستخدم لعلاج عدوى فيروس العوز المناعي البشري، وينصح مكتب المجلس الاستشاري لأبحاث الإيدز باستخدامه في البالغين والمراهقين في المرضى الذين لم يستخدموا علاجا مسبقا أو كانوا على علاج سابق.[3]
| دارونافير | |
|---|---|
 | |
 دارونافير | |
| الاسم النظامي | |
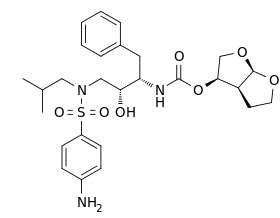
| [(1R,5S,6R)-2,8-dioxabicyclo[3.3.0]oct-6-yl] N-[(2S,3R)-4- [(4-aminophenyl)sulfonyl- (2-methylpropyl)amino]-3-hydroxy-1-phenyl- butan-2-yl] carbamate | |
| تداخل دوائي | |
| يعالج | |
| اعتبارات علاجية | |
| اسم تجاري | Prezista |
| ASHPDrugs.com | أفرودة |
| مدلاين بلس | a607042 |
| فئة السلامة أثناء الحمل | B2 (أستراليا) C (الولايات المتحدة) |
| طرق إعطاء الدواء | oral |
| بيانات دوائية | |
| توافر حيوي | 37% (without ريتونافير), 82% (with ريتونافير) |
| ربط بروتيني | 95% |
| استقلاب (أيض) الدواء | hepatic (سيتوكروم 3A4) |
| عمر النصف الحيوي | 15 hours |
| إخراج (فسلجة) | Faeces (80%), urine (14%) |
| معرّفات | |
| CAS | 206361-99-1 |
| ك ع ت | J05J05AE10 AE10 |
| بوب كيم | CID 213039 |
| ECHA InfoCard ID | 100.111.730 |
| درغ بنك | DB01264 |
| كيم سبايدر | 184733 |
| المكون الفريد | YO603Y8113 |
| كيوتو | D03656 |
| ChEBI | CHEBI:367163 |
| ChEMBL | CHEMBL1323 |
| NIAID ChemDB | 073035 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C27H37N3O7S |
| الكتلة الجزيئية | 547.665 g/mol |
طورته تيبوتك، علما أن دارونافير قد أخذ اسم الدكتور آرون غوش الأستاذ في جامعة إلينوي في شيكاغو الذي اكتشف الدواء مع مجموعته.[4]
رخصت إدارة الغذاء والدواء استخدام دارونافير تحت اسم تجاري هو بريزيستا (Prezista) بتاريخ 23 حزيران 2006.[5]
كما يتوفر ضمن دواء مركب مع كوبيسيستات تحت اسم برزكوبكس الذي رخصت إدارة الغذاء والدواء بتاريخ 29 كانون الثاني 2015 استخدامه في علاج متلازمة العوز المناعي المكتسب.[6][7]
الاستخدامات الطبية
الدارونافير خيار علاجي موصى به من قبل مكتب المجلس الاستشاري لأبحاث الإيدز (دي إتش إتش إس) للبالغين والمراهقين، بغض النظر عما إذا كانوا قد تلقوا علاجًا لفيروس العوز المناعي البشري (إتش آي في) في الماضي.[8] في دراسة على المرضى الذين لم يتلقوا علاجًا لفيروس إتش آي في، كانت فعالية الدارونافير مشابهة لفعالية اللوبينافير/الريتونافير عند إعطائه لمدة 96 أسبوعًا بجرعة يومية واحدة.[9] حصل على موافقة إدارة الغذاء والدواء (إف دي إيه) في 21 أكتوبر من عام 2008 لعلاج الأشخاص الذين لم يتلقوا علاجًا سابقًا لفيروس العوز المناعي المكتسب.[10] كما هو الحال بالنسبة إلى مضادات الفيروسات الأخرى، لا يشفي الدارونافير مرض الإيدز.[11]
يُستطب الدارونافير لعلاج عدوى فيروس العوز المناعي البشري (إتش آي في 1) لدى البالغين والأطفال بسن ثلاث سنوات أو أكبر عند إعطائه مع الريتونافير، بالاشتراك مع غيره من العوامل المضادة للفيروسات.[12][13]
الآثار الضارة
الدارونافير جيد التحمل بشكل عام عند البشر. الطفح الجلدي هو أكثر الآثار الجانبية شيوعًا (7% من المرضى).[11] من الآثار الجانبية الشائعة الأخرى الإسهال (2.3%)، والصداع (3.8%)، وآلام البطن (2.3%)، والإمساك (2.3%)، والإقياء (1.5%). قد يسبب الدارونافير أيضًا ارتكاسات أرجية، وقد يكون لدى الأشخاص الذين يعانون حساسية تجاه الريتونافير أيضًا ردُّ فعل تجاه الدارونافير.[11]
وردت تقارير عن حدوث فرط سكر الدم، أو السكري، أو تفاقم الداء السكري، وألم أو إيلام أو ضعف عضلي، وزيادة النزيف لدى المصابين بالناعور، عند المرضى الذين يتناولون أدوية مثبطة للبروتياز مثل الدارونافير. لُوحظت تغييرات في دهون الجسم عند بعض المرضى الذين يتناولون أدوية لفيروس إتش آي في، بما في ذلك خسارة الدهون من الساقين والذراعين والوجه، وزيادة الدهون في البطن والأعضاء الداخلية الأخرى، وتضخم الثدي، ووجود كتل دهنية في الجزء الخلفي من الرقبة. إن سبب هذه الحالات غير معروف وكذلك آثارها الصحية على المدى الطويل.[11]
التداخلات الدوائية
قد يتداخل الدارونافير مع الأدوية التي يتناولها عادة الأشخاص المصابون بالإيدز مثل مضادات الفيروسات الأخرى، ومضادات الحموضة مثل مثبطات مضخة البروتون ومضادات مستقبلات الهيستامين2. قد تقلل نبتة القديس يوحنا المثقبة من فعالية الدارونافير عن طريق زيادة تفككه بواسطة الإنزيم الاستقلابي سي واي بّي 3 إيه (CYP3A؛ السيتوكروم بّي 450).[11]
التاريخ
جرت الموافقة على استخدام الدارونافير في الولايات المتحدة في شهر يونيو من عام 2006 وعلى استخدامه في الاتحاد الأوروبي في شهر فبراير من عام 2007.[14][15][16][17][16][13]
تأسس تطوير الجيل الأول من المثبطات السريرية على خلق المزيد من تآثرات البروتياز والربيطة من خلال الروابط الهيدروجينية والتآثرات الكارهة للماء.[18] كان الساكوينافير أول مثبط بروتياز لفيروس إتش آي في وافقت عليه إدارة الغذاء والدواء الأمريكية، الذي صُمم بغرض استهداف بروتياز فيروس إتش آي في 1 من النمط البري. ومع ذلك، لم يكن هذا المثبط فعالًا بسبب الطفرات المسببة للمقاومة في بنية بروتياز فيروس إتش آي في 1.[19] يتميز جينوم فيروس العوز المناعي البشري بالمرونة العالية، لذا يصبح قادرًا على مقاومة العديد من مثبطات بروتياز فيروس إتش آي في 1. بعد الساكوينافير، وافقت إدارة الغذاء والدواء الأمريكية على العديد من مثبطات البروتياز،[20] ومن ضمنها الدارونافير.[17]
مراجع
- المؤلف: Shobha Phansalkar، Amrita A Desai، Douglas S. Bell، Eileen Yoshida و John Doole — العنوان : High-priority drug-drug interactions for use in electronic health records — نشر في: Journal of the American Medical Informatics Association — المجلد: 19 — الصفحة: 735–743 — العدد: 5 — https://dx.doi.org/10.1136/AMIAJNL-2011-000612 — https://pubmed.ncbi.nlm.nih.gov/22539083 — https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3422823 — العمل الكامل مُتوفِّر في: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3422823/
- https://dx.doi.org/10.5281/ZENODO.1435999
- Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents, November 3, 2008, Developed by the DHHS Panel on Antiretroviral Guidelines for Adults and Adolescents – A Working Group of the Office of AIDS Research Advisory Council (OARAC). full guidelines. نسخة محفوظة 29 يوليو 2014 على موقع واي باك مشين.
- Ghosh Group, Purdue University نسخة محفوظة 11 سبتمبر 2017 على موقع واي باك مشين.
- Rodger D MacArthura, Darunavir: promising initial results, دُوِي:10.1016/S0140-6736(07)60499-1
- PREZCOBIX™ (darunavir/cobicistat) Approved in the U.S. for the Treatment of Adults Living With HIV-1 نسخة محفوظة 04 مارس 2016 على موقع واي باك مشين.
- Darunavir/Cobicistat (Prezcobix) Combo Pill Clears FDA نسخة محفوظة 12 مايو 2015 على موقع واي باك مشين.
- Panel on Antiretroviral Guidelines for Adults and Adolescents (18 ديسمبر 2019)، "Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV" (PDF)، Department of Health and Human Services، مؤرشف من الأصل (PDF) في 13 أغسطس 2020، اطلع عليه بتاريخ 21 أبريل 2020، ضع ملخصا.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة)، الاستشهاد يستخدم وسيط مهمل|lay-url=(مساعدة) - hivandhepatitis.com نسخة محفوظة 2007-07-13 على موقع واي باك مشين., Efficacy and Safety of Boosted Darunavir (Prezista) Are Superior to Lopinavir/ritonavir (Kaletra) at 96 Weeks: ARTEMIS Trial, 2008-10-28, URL نسخة محفوظة 2009-07-19 على موقع واي باك مشين..
- hivandhepatitis.com نسخة محفوظة 2007-07-13 على موقع واي باك مشين., Darunavir (Prezista) Receives Full Traditional Approval, Dose Set for Treatment-naive Patients, Caution Urged for Pregnant Women, 2008-10-24, URL نسخة محفوظة 2009-05-19 على موقع واي باك مشين..
- "Drug Monograph, Prezista"، مؤرشف من الأصل في 11 نوفمبر 2016.
- "Prezista- darunavir tablet, film coated Prezista- darunavir suspension"، DailyMed، 06 يونيو 2019، مؤرشف من الأصل في 06 فبراير 2019، اطلع عليه بتاريخ 21 أبريل 2020.
- "Prezista EPAR"، European Medicines Agency (EMA)، مؤرشف من الأصل في 25 يونيو 2019، اطلع عليه بتاريخ 21 أبريل 2020.
 تتضمن هذه المقالة نصًا من هذا المصدر المُتاح في الملكية العامة.
تتضمن هذه المقالة نصًا من هذا المصدر المُتاح في الملكية العامة. - MacArthur, Rodger D (2007)، "Darunavir: promising initial results"، The Lancet، 369: 1143–1144، doi:10.1016/S0140-6736(07)60499-1.
- "FDA Approves New HIV Treatment for Patients Who Do Not Respond to Existing Drugs"، U.S. إدارة الغذاء والدواء (الولايات المتحدة) (FDA) (Press release)، مؤرشف من الأصل في 13 نوفمبر 2016، اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد ببيان صحفي}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)، الوسيط|access-date=و|تاريخ الوصول=تكرر أكثر من مرة (مساعدة) - "Drug Approval Package: Prezista (Darumavir) NDA #021976"، U.S. إدارة الغذاء والدواء (الولايات المتحدة) (FDA)، 06 سبتمبر 2006، مؤرشف من الأصل في 01 يوليو 2016، اطلع عليه بتاريخ 21 أبريل 2020.
- "HIV/AIDS Historical Time Line 2000 - 2010"، U.S. إدارة الغذاء والدواء (الولايات المتحدة)، 05 يناير 2018، مؤرشف من الأصل في 01 يونيو 2019، اطلع عليه بتاريخ 21 أبريل 2020.
- Leonis, G.؛ Czyznikowska, Z.؛ وآخرون (2012)، "Computational Studies of Darunavir into HIV-1 Protease and DMPC Bilayer: Necessary Conditions for Effective Binding and the Role of the Flaps"، J. Chem. Inf. Model.، 52: 1542–1558، doi:10.1021/ci300014z.
- Liu, F.؛ Kovalevsky, A.Y. (2008)، "Effect of Flap Mutations on Structure of HIV-1 Protease and Inhibition by Saquinavir and Darunavir"، J. Mol. Biol.، 381 (1): 102–115، doi:10.1016/j.jmb.2008.05.062، PMC 2754059، PMID 18597780.
- Eron, J (2000)، "HIV-1 Protease Inhibitors"، Oxford Journal of Clinical Infectious Diseases، 30: 160–170.