زوج إلكترون
زوج إلكترون في الكيمياء يتكون من الكترونين يشغلان نفس المدار ولكنهما يدوران بلف مغزلي متعاكس.[1]
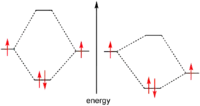
ولأن الإلكترونات هي فرميونات، فإن مبدأ استبعاد باولي يمنع تلك الجسيمات أن يكون لديهما نفس رقم الكم، لذا فإن الطريقة الوحيدة لشغل نفس المدار، بمعنى أن لها نفس أعداد الكم المدارية هو أن تختلف في عدد الكم المغزلي. وهذا يحدد أعداد الإلكترونات الموجودة في نفس المدار إلى اثنين فقط.
يتوافق الاقتران في اللف في كثير من الأحيان بقوة، لذا فأزواج الإلكترونات تلعب دورا كبيرا جدا في مجال الكيمياء. ويمكن أن تشكل:
- رابطة كيميائية بين ذرتين.
- زوج وحيد.
- تملأ مستويات اللب في الذرة.
بسبب اقتران اللف المغزلي، فإن العزم المغناطيسي للإلكترونات يتلاشى، وتكون مساهمة الزوج للخصائص المغناطيسية بصورة مغناطيسية معاكسة.
مع أنه يمكن ملاحظة وجود قابلية قوية لإزدواجية الإلكترونات في الكيمياء، إلا أنه يمكن أن تظهر الإلكترونات في حالة منفردة.
في حالة الروابط الفلزية فإن العزم المغناطيسي يعوض إلى حد كبير، ولكن الرابطة هي أكثر شيوعا بحيث لايمكن تمييز أزواج الالكترونات، لذا فمن الأفضل أن ينظر إلى الإلكترونات بأنها في محيط جماعي.
وهناك حالة خاصة جدا في تشكيل زوج إلكترون يحصل في الموصلية الفائقة: وهو تشكيل زوج كوبر.
مراجع
- Jean Maruani (1989)، Molecules in Physics, Chemistry and Biology: v. 3: Electronic Structure and Chemical Reactivity، Springer، ص. 73، ISBN 978-90-277-2598-1، مؤرشف من الأصل في 7 يوليو 2014، اطلع عليه بتاريخ 14 مارس 2013.
- بوابة كيمياء فيزيائية
- بوابة ميكانيكا الكم
- بوابة الفيزياء
- بوابة الكيمياء