سرطان الكبد
سرطان الكبد هو نمو وانتشار خلايا غير سليمة داخل الكبد. منشأه الخلايا الكبدية، وهذه الأورام قد يتم اكتشافُها بالّصدفة عند إجراء تصوير للبطن لسببٍ أو لآخَر وقد يتم اكتشافها عند شكوى المريض من أعراض سببها الورم ألم في البطن أو كتلة محسوسة أو اصفرار أو الغثيان أو أعراض فشل الكبد. ومرض السرطان الذي ينشأ داخل الكبد اسمه سرطان الكبد الأولي. أما السرطان الذي ينتقل إلى الكبد من عضو آخر فاسمه سرطان الكبد الثانوي (النقيلي).
| سرطان الكبد | |
|---|---|
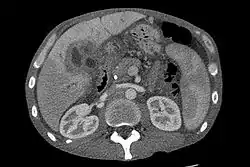 صورة طبقية للكبد تظهر سرطان الاوعية الصفراوية صورة طبقية للكبد تظهر سرطان الاوعية الصفراوية | |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | ورم الكبد، ومرض الكبد، ومرض |
| الموقع التشريحي | كبد[1] |
| الأسباب | |
| الأسباب | تشمع الكبد، وأفلاتوكسين |
| المظهر السريري | |
| الأعراض | يرقان، وألم بطني، وفقدان الوزن، وتضخم كبد |
يتم سنويا تشخيص إصابة 21.000 أمريكي بسرطان الكبد الأولي. ويعتبر سرطان الكبد الأولي واحدا من السرطانات القليلة الآخذة بالانتشار أكثر من غيرها في الولايات المتحدة الأمريكية. والسرطان الأولي أكثر شيوعا بمرتين لدى الرجال منه لدى النساء. كما تزيد نسبة حدوثهِ في الدول النامية عن باقي الدول بشكل واضح (أكثر من 80% من مرضى هذا النوع من السرطان من الدول النامية). الّسبب الأساسي لسرطان الكبد هو التّليُّف الكبدي الذي قد يَنتُج من التهاب الكبد الوبائي بي أو سي أو بسبب الكحول.[2] في عام 2013 توفيَ 300000 شخص بسبب سرطان الكبد الّناشِئ من التهاب الكبد الوبائي بي,،343000 من التهاب الكبد الوبائي سي، و 92000 من الكحول.[2] سرطان الكبد الأوَّلي يختلف عن الأورام التي تنتقل للكبد من مصادر أُخرى. سرطان الكبد إما أن ينشأ من الكبد نفسُه أو من الّتراكيب التي يحتويها الكبد، مثل الأوعية الّدموية أوالقناة الّصفراوية. سرطان الكبد هو سادس الّسرطانات انتشاراً وثاني سبب للوفاة[3] الّناتجة من الّسرطان. في عام 2012 تم تشخيص 782000 حالة وتسبّب بوفاة 746000 شخص.[3] ويُعَدّ أكثر انتشارا بالمناطق التي تحوي أعداداً أكبر من التهاب الكبد الوبائي بي وسي مثل شرق آسيا وجنوب الّصحراء الكبرى الإفريقية.[4] مُعدّل البقاء على قيد الحياة لمُدِّة 5 سنوات هو حوالي 17% في الولايات المتحدة الأمريكيّة.[5]
التصنيف
أكثر أنواع سرطان الكبد انتشاراً هو سرطان الخلايا الكبدية ويُشكِّل 75% من أنواع سرطان الكبد ( يُسَمّى أيضاً هيبا توما ولكنّه اسم خاطِئ حيثُ إنّه قد يُشير إلى ورَم حميد ولكنَّه بالحقيقة هو ورم خبيث) وينشأ من الخلايا الكبديّة (hepatocyte) التي تتحول إلى خلايا خبيثة. ثاني نوع من سرطانات الكبد التي تنشأ من الخلايا الكبديّة هو الورم الكبدي الأرومي(هيباتوبلاستوما) الذي ينشأ من الخلايا الكبدية الغير ناضجة.[6] وهو ورم نادر ويُصيب الأطفال ويشكل 1% من سرطانات الأطفال، و 79% من سرطانات الكبد في الفئة العمريّة التي تَقِل عن 15 عام. وغالبا ما يَنشأ من الفص الكبدي الأيمن.[7] سرطان الكبد قد ينشأ من الّتراكيب التي يحتويها الكبد مثل الأوعية الّدموية والقنوات الّصفراوية والخلايا المناعيّة. الّسرطانات التي تنشأ من القناة الصفراويّة (سرطان القنوات الّصفراويّة وسرطان القنوات الّصفراويّة الغدي الكيسي) تشكل 6% من سرطان الكبد.[6] وهناك نوع من أنواع سرطان الكبد يجمع بين الخلايا الكبديّة وخلايا القناة الصفراويّة.[8] الأورام التي تنشأ من الأوعيّة الّدمويّة مثل السار كوما الوعائيّة(الأنجيوساركوما) والورم البِطاني الوعائي(هيمانجيو إندوثيليوما) والسار كوما الجنينية ( إمبريونال ساروكما) والسار كوما الليفيّة. هذه الأورام تنشأ من نوع من أنواع الّنسيج الّضام الذي يُسمى باللُحمة المتوسِّطة ( mesenchyme ) .الأورام التي تنشأ من الخلايا العضليّة في الكبد هي السار كوما العضليّة الملساء والسار كوما العضليّة المخطّطة، و من الأنواع الأقل شيوعاً: السار كوما الّسرطانيّة والورم المَسحِي'(التيراتوما) وورم الكيس المحي والوَرَم الّسرطاوي ( الكارسينويد) والليمفوما.[6] غالبا ما تنتشر الليمفوما بشكل متشعِّب في الكبد ولكنَّها قد تشكِّل أورام في حالات قليلة. هنالك الكثير من الأورام التي قد نَجِدُها في الكبد ولكنّها تنشأ في مكان آخر وتنتَشِر لتَصِل إلي الكبد. في كثير من الأحيان يكون مصدر هذه الأورام هو الجهاز الهضمي مثل: القولون والأورام الّسرطاوية خاصَّة تِلك التي تنشأ من الّزائدة الّدودية. وقد يكون مصدَرُها أيضاً هو سرطان الّثدي أو الِّرئة أو المبيَض أو الكِلى أو البروستاتا.
الاسباب

يوجد العديد من عوامل الخطورة للإصابة بسرطان الكبد: تشمع الكبد والذي يؤدي إلى تندّب أو تليف الكبد ويمكن أن يؤدي إلى الإصابة بسرطان الكبد، وفي الولايات المتحدة يعتبر الإدمان المزمن على الكحول والتهاب الكبد من النوع سي السببين الرئيسيين للإصابة بتشمّع الكبد. يرتبط التهاب الكبد من النوع بي وسي طويل الأمد بسرطان الكبد لأنهما غالبا ما يؤديان إلى الإصابة بتشمّع الكبد ويمكن أن يؤدي التهاب الكبد من النوع بي إلى الإصابة بسرطان الكبد حتى بدون الإصابة بتشمع الكبد. إن السمنة قد تزيد من خطر الإصابة بسرطان الكبد. الداء السكري قد يزيد من خطر الإصابة بسرطان الكبد خاصة عند الأشخاص السكريين الذين يكثرون من تناول الكحول أو المصابين بالتهاب الكبد الفيروسي.
التهاب الكبد الوبائي سواء من الّنوع سي أو بي هو الّسبب الّرئيسي لسرطان الكبد في العالم، حيث يشكِّل ما نسبَتُه 80% من حالات سرطان الخلايا الكبديّة.[9][10][11] هذه الفيروسات تُسبِّب سرطان الخلايا الكبدية لِمَا تُسَبِّبه من التهاب واسع الانتشار وتليُّف الكبد ثم تَشَمُّعه. سرطان الخلايا الكبديّة عادة ما ينشأ بعد الّتشمُّع بنسبة 1.7% سنويا عند مرضى الّتشمُّع الكبدي بسبب التهاب الكبد الوبائي سي.[12] 5-10% من مرضى التهاب الكبد الوبائي بي يُصابون بالّشكل المُزمِن منه و 30% منهم يُصابون بِمرض الكبد المُزمِن الذي قد يؤدي إلى سرطان الخلايا الكبدية.[9] التهاب الكبد الوبائي بي له علاقة أيضا بسرطان القنوات الّصفراويّة.[13] دور الفيروسات الأُخرى في ذلك غير واضح ولكن هناك دلائِل أنَّ التهاب الكبد الوَبائي بي مع دي يَزيد من احتماليِّة تطوُّر الّسرطان.[14] العديد من الّتغيُّرات الجينيّة تَحدُث بعد الإِصابة بالتهابِ الكَبِد الوبائي بي أو سي وهذا سبب أساسي في تطوُّر الأورام. وتقوم الفيروسات بإحداث تغيُّرات خبيثة في الخلايا عن طريق تغيِّير مواقِع مجموعات الميثيل ( CH3)على جُزَيء (DNA)، وبالّتالي تَغيير مجموعة الجينات التي يتم ترجَمتها إلى بروتينات، وهذه الّتغيرات قد تَطفأ أو تشغل بعض مسارات نقل الإشارات في الخليّة، وبهذه الّطريقة يمنع الفيروس حدوث عمليّة الموت الّتلقائي المنظِّم للخلايا ((apoptosis ،و بالّتالي تعزيز بقاء الفيروس فيها ومن ثم تَكاثُره وانتشارُه.
تَشَمُّع الكَبِد
بالإضافة إلى الّتشمُّع بسبب التهاب الكبد الوبائي هناك أسباب أُخرى للتشمُّع قد تُؤدي إلى الّسرطان. يؤدي الكحول أيضاُ إلى سرطان الكبد خاصة في الأشخاص الذين أُصيبوا بتشمُّع الكبِد الناتِج عن الكحول. ومن الأسباب الأخرى التي تُؤَدي إلى التشمُّع داء الّصباغ الّدموي الوراثي hemochromatosis والتّشمُّع الّصفراوي الأولى.[15]
أفلا توكسين

التّعرُّض للافلاتوكسين قد يؤدي إلى سرطان الكبد. وهو عبارة عن مواد كيميائيّة تُنتِجُها بعض أنواع الفطريات aspergillus flavus and A.Parasiticus) ). تَلوُّث الّطعام بهذه الفطريات قد يؤدي إلى الّتعرض لهذه المواد شديدة الّسمّية للكبد. من الأطعمة الّشائع تلوُّثِها بهذه الّسموم: الحبوب والفول الّسوداني والخضار. تلوُّث الّطعام بهذه الملوِّثات شائِع بإفريقيا وجنوب شرق آسيا والّصين. تزامن الّتعرض لهذه الّسموم مع التهاب الكبد الوبائي بي يزيد خطورة الّسرطان بمعدَّل ثلاث مرّات. يعتقد أنّ هذه الّسموم تؤدي إلى حدوث طفرات جينيَّة بالجينات التي تمنع حدوث السرطان مثلp53 .[16][17]
من الأسباب الأخرى لسرطان الكبد في الكبار
- العقد قبل الّسرطانية المختلة النّسيج بدرجةٍ عالية في الكبد تزيد نسبة خطر الّسرطان خلال عامين 30-50% ، حيث ينشأ الّسرطان من تلك العقد.[18]
- الّسمنة، حيث بدأت تظهر كعامل خطير مؤدي لسرطان الكبد حيث أنَّه يؤدي التهاب الكبد الدهني.[11][17]
- الّسكري [17]
- الّتدخين[17]
- التهاب القنوات الّصفراويّة المصلب الأَوَلِي الذي يزيد خطورة سرطان القنوات الّصفراويّة بمعدَّل 5-10%.[19]
- التهاب الكبد بالّدودة المثقوبة الذي يزيد خطورة سرطان القنوات الّصفراويّة، وتُعَدّ هذه الّدودة الّسبب في شيوع هذا النّوع من الّسرطان في تايلند[4]
عوامل الخطر عند الأطفال
- [20][21] beckwith-wiedemann syndrome
- داءُ السَّلاَئِلِ القُولُونِيُّ الوَرَمِيُّ الغُدِّيّ Familial adenomatosis polyposis [21]
- الوزن القليل عند الولادة.[7]
- متلازمة الّتَثلُّث الّصبغي 18.[21]
وجميع هذه الأمراض تزيد من خطورة الإصابة بالهيباتوبلاستوما. كما أنَّ مَرَض رُكود الّسائِل الّصفراوي داخل الكَبِد العائلي يزيد من احتماليّة سرطان الخلايا الكبديّة.[22]
الأعراض
مصطلح سرطان الكبد هو مصطلح عام يضم تحت مظلته أنواعا مختلفة من الأورام ولذلك تختلف الأعراض باختلاف نوع الورم. في سرطان القنوات الصفراوية يشكو المريض من التعرق، الاصفرار، ألم في البطن، فقدان الوزن وتضخم الكبد.[23] في سرطان الخلايا الكبدية(هيباتوما) يشكو المريض من ألم في البطن، كتلة ملموسة، استفراغ، فقر دم، ألم في الظهر، اصفرار، حكة، فقدان في الوزن وحرارة.[24]
في الغالب لا تظهر أعراض الإصابة بسرطان الكبد إلا بعد وصول المرض إلى مراحل متقدمة. وعند ظهور الأعراض يشعر المريض بالإعياء والضعف والتعب العام، الانتفاخ والشعور بالتخمة، وألم في الناحية اليمنى من أعلى البطن أو الظهر والكتف ، الغثيان ، فقدان الشهية ،فقدان الوزن ، الحمى ، واليرقان : إصفرار العينين والجلد
التشخيص
هناك العديد من الوسائِل التي يُمكِن أن تستخدم في تشخيص سرطان الكبد الأوَلي، يبدأ تشخيص سرطان الكبد بالفحص السريري والقصة المرضية والفحوص الشعاعية والمخبرية . من أهم الفحوص الشعاعية المستخدمة الأمواج فوق الّصوتيّة (الإيكو) والطبقي المحوري والرنين المغناطيسي وتصوير الشراين الظليل. أما أهم التحاليل المخبرية المطلوبة فهي التعداد العام وتحري خمائر الكبد وأنزيماته والواسمات الورمية tumour marcer AFP. ولكن يبقى الاختبار المشخص والمؤكد هو خزعةPATHOLOGY الكبد والتشريح النسيجي للعينات المأخوذة.
عند الّتصوير باستخدام الأمواج فوق الّصوتية أيّ كُتلة أكبر من 2 سم لها احتماليّة 95% أن تكون سرطان الخلايا الكبديّة. أغلب سرطانات القنوات الّصفراويّة تَحدُث في المنطقة الّنقيرية ويكتَشِفُها المريض بعد أن تُسَبِب انسداد للقناة الّصفراويّة وفي هذه الحالة يتم عمل صورة باستعمال الأمواج فوق الّصوتيّة((ultrasound، صورة طبقيّة، صورة رنين مغناطيسي، ERCP و MRCP.[25]
علامات الأورام: وهي المواد التي يُمكِن أن نَجِدها في دم مرضى الّسرطان قد تساعد في تشخيص ومراقبة سرطان الكبد. مثلا قد نجد كميّات عاليّة من الالفا فيتو بروتين في العديد من حالات سرطان الخلايا الكبديّة وسرطان القنوات الّصفراويّة داخل الكبد. سرطان القنوات الّصفراويّة قد يتم اكتشافه من خلال carbohydrates antigen 19-9 (ca 19-9) , carcinoembryonic antigen CEA and Ca125. هذه المواد يمكن أن نجدها في سرطان الكبد الأولي وفي أنواع أخرى من الأورام وفي بعض الأمراض أيضا.[26][27]
العلاج
تعتمد عملية علاج سرطان الكبد على:
- حالة الكبد
- حجم وموضع وعدد العقد الورمية
- إذا ما كان السرطان قد انتشر إلى خارج الكبد
- عمر المريض وحالته الصحية العامة.
خيارات العلاج المتاحة في حال عدم انتشار السرطان وسلامة باقي أجزاء الكبد هي: الزرع إن لم يكن السرطان قد انتشر بعد قد يكون إجراء عملية زرع الكبد واستبداله بكبد سليم لدى بعض المرضى أحد الخيارات المتاحة. الجراحة إذا تم اكتشاف السرطان مبكرا وكانت بقية أجزاء الكبد سليمة يمكن للأطباء القيام بتداخل جراحي لاستئصال الورم من الكبد وذلك من خلال استئصال كبد جزئي. خيارات العلاج الأخرى المتاحة في حال انعدام إمكانية الجراحة أو الزرع تشمل: الجراحة القرّية أو الجراحة بالبرودة: في هذا النوع من الجراحة يتم استعمال مسبار معدني لتجميد خلايا السرطان والقضاء عليها. الاستئصال بالموجات اللاسلكية أو العلاج بالحرارة: تتم هذه العملية باستعمال مسبار خاص يقوم بالقضاء على الخلايا السرطانية بالحرارة. حقن الإيثانول يتم حقن الكحول مباشرة داخل الورم السرطاني الكبدي للقضاء على الخلايا السرطانية. العلاج الكيميائي والانصمام الكيميائي في العلاج الكيميائي يتم استخدام العقاقير للقضاء على الخلايا السرطانية. وفي بعض الحالات يمكن حقن الأدوية الكيميائية مباشرة داخل الورم الكبدي. العلاج بالأشعة العلاج بالأشعة يستخدم الأشعة السينية عالية الطاقة للقضاء على الخلايا السرطانية. سورافينيب (نيكسافار) Sorafenib (Nexavar) هو دواء لعلاج سرطان الخلايا الكبدية عن طريق الفم حائز على موافقة هيئة الغذاء والدواء الأمريكية (Sorafenib) وهي الطريقة الأكثر أماناً ولكنهـآ مكلفـه بعض الشئ حيث انـه تكلفـه عقـار السورافينيب200 وتحتوي علي 120 قرص أو النيكسافار400 وتحتوي علي 60 قرص في مصـر من 10.200جنيـه مصـري الي 15 الف جنيـه مصـري
سرطان الخلايا الكبدية
غالبا ما يكون الاستئصال الجراحي هو الأفضل في حالة عدم وجود تليف في الكبد. ولكن يزيد خطر المضاعفات عند الاستئصال الجراحي للكبد في المرضى المصابين بالتليف الكبدي. فرصة البقاء على قيد الحياة بعد الاستئصال الجراحي لمدة 5 سنوات تحسنت كثيرا في العقود الأخيرة وربما تتجاوز الآن 50%. حالات عودة السرطان بسبب انتشار الورم الأول أو تكون أورام جديدة بعد الجراحة تتجاوز 70%.[28] زراعة الكبد قد تستخدم في مرضى سرطان الخلايا الكبدية إذا كان المرضى قادرين على تحملها ويتبع الورم معايير خاصة مثل معايير ميلان (Milan criteria) .

أقل من 30-40% من مرضى سرطان الخلايا الكبديّة قادرين على احتمال الجراحة أو زراعة كبد لأنّهم غالبا ما يتم تشخيصهم في مراحل متأخِّرة وبالإضافة إلى ذلك سرطان الخلايا الكبديّة قد يتقدّم خلال فترة انتظار الّزراعة مما يمنع إجراء الّزراعة نتيجةً للمعايير الّصارمة التي تطلبها هذه المرحلة من تقُّدم السرطان. الاستئصال من خلال الجلد هو الّطريقة الوحيدة غير الجراحيّة التي قد تَشفي من الوَرَم. هنالك العديد من طرق الاستئصال: من خلال الجلد التي تكون من خلال حقن مواد كيميائية في الكبد( إيثانول أو أسيتك أسيد) أو من خلال درجات حرارة عالية جدا باستخدام الّترددات اللاسلكية( radiofrequency ablation)و موجات المايكرويف )(microwaves) و الليزر والعلاج بالّتبريد,(cry therapy). من هذه يُعتبَر استخدام الّتردُدات اللاسلكية ( radiofrequency ablation) الأفضل ولكن المشكلة عندما يكون الورم قريب من أعضاء أُخرى أو من أوعية دمويّة بِسبَب الحرارة التي يَنتِجُها.[29][30]
العلاج الكيميائي العام أو المجموعي ( بمعنى أنَّه يذهب عبر الّدم لجميع أجزاء الجسم) لا يُستخدَم عادة في علاج سرطان الخلايا الكبديّة، على الّرغم من أنَّ العلاجَ الكيميائي الموضعي قد يُستخدَم بِإِجراء يُسمَّى ( trans arterial chemoembolization). في هذه العمليّة يتم حقن مواد كيميائية مثل الدوكسوروبيسين أو السيسبلاتين (doxorubicin or cisplatin )ويتم سدّ الّشرايين التي تُزوِّد الكبِد بمادةٍ جيلاتينية أو مواد أُخرى.
تتركّز الأبحاث الآن على العلاج الجُزيئي الذي يَستهدِف طُرُق نقل الإِشارات داخل الخليّة لأنَّ أغلب العِلاجات الكيميائيّة الجهازيّة ( العامّة) لا تُفيد في عِلاج سرطان الكبِد، ولقد تمَّ إنتاج دواء يَمنَع الخلايا من الّتكاثر ويَمنَع نُمُوّ الأوعِيَة الّدمويّة المزوَّدة لها يُدعى بسورا فينيب (sorafenib) ، هذا العِلاج يَزيد مِن فُرصِة الّنجاة في الحالات التي يكون المرض فيها في مراحِلِه المتقدِّمة.[30]
العلاج الإشعاعيّ لا يُستخدَم عادةً في عِلاج سرطان الخلايا الكبديّة لأنّ الكبد لا يَحتَمِل الأشعَّة. لكن حاليًا باستِخدام التكنولوجيا الحديثة يُمكن عَمل عِلاج إشعاعي موَجَه للورم، الأمر الذي يقلل من جرعة الإشعاع الواصلة لباقي أجزاء الكبد. العلاج الذي يجمع الإشعاعيّ مع وسائِل أخرى مثل الكيميائي الموضعي والكيميائي العام أو العِلاج بأدويَة تَستَهدِف الوَرم فقط، أفضل من العلاج بالإشعاعِ وحده.[31]
سرطان القنوات الصفراوية

قد يتم عمل استئصال جراحي ولكن أقل من 30% من هذه الأورام يُمكِن استئصالها عندَ الّتشخيص. بعد إجراء الجراحة أكثر من 60% من الأورام تعود مجددا.[32][33] من المُمكِن عمل زِراعة كَبِد عندما لا يكون الاستئصال الجزئي ممكِناً، ومِن المُمكِن أيضا إضافة العِلاج الكيميائي والإشعاعي في بعض الحالات.[19]
60% من أورام القنوات الّصفراويّة تنشأ من المنطِقة المحيطة بالّنقير، والعلاج الّضوئي قد يُحَسِّن نوعيِّة الحياة، ويَزيد مُدَّتها في حالات الأورام التي لا يمكن استئصالها. العِلاج بالّضوء هو علاج حديث يَستخدِم جُزَيئات الّضوء المنشّطة لِعِلاج الوَرَم، والجُزَيئات الموجودة في الورم يتم تنشيطها بواسطة الليزر، مما يؤدي إلى إنتاج الجزيئات الّتفاعليّة للأُكسُجين في خلايا الوَرَم التي تَقتُل تِلك الخلايا الّسرطانية.[32][34] العلاج الكيميائي الجهازي/العام مثل ال Gemcitabine and cisplatin قد يُستَعمَل في الحالات التي لا يُمكِن استئصالها.[19]
من الوسائل الأخرى التي يُمكِن استعمالها Radiofrequency ablation, transarterial chemoembolization and internal radiotherapy (brachytherapy) [33] العِلاج الإشعاعي يُمكن أن يُستخدَم في بعضِ الحالات الخاصّة المتقدِّمة كعِلاج تلطيفي أساسي أو إضافي.[35]
الأورام الكبدِيَّة الأروميَّة ( الهيباتوبلاستوما)
استئصال الوَرَم جِراحِياً أو عمل زِراعة كبد قد يَشفي المريض. من المُمكِن أيضاُ أضافِة العِلاج الكيميائي قبل أو بعد الجراحة والزراعة.[36] العلاجات الكيميائية مثل cispaltin, vincristine, cyclophosphamide and doxorubicin تُستعمَل في عِلاج الهيباتوبلاستوما. من هذه الأدوية يُعتَبَر cisplatin الأفضَل.[37]
أساليب تقليل خطر الإصابة
- قم بزيارة طبيب متخصص بأمراض الكبد بشكل دوري.
- اسأل طبيبك عن طرق الوقاية من الالتهاب الكبدي الفيروسي بما في ذلك لقاحات التهاب الكبد من النوعين أي و بي.
- قم باتخاذ خطوات لتجنّب التعرض للإصابة بالتهاب الكبد من النوعين بي و سي.
- إن كنت مصابا بتشمع الكبد أو أي مرض كبدي مزمن، عليك إتباع توصيات الطبيب بشأن العلاج والقيام بفحوصات دورية للكشف عن
سرطان الكبد.
- إن كنت من أصحاب الوزن المفرط أو تعاني من البدانة ، أو الداء السكري ، أو تتناول الكحول بإفراط، عليك التحدث مع طبيبك عن صحة الكبد وفحوصات الكشف عن سرطان الكبد.
الوقاية من الّسرطان قد تكون أوليّة، ثانويّة أو ثالثيّة.
الوقايّة الأوليّة تُقِّلل من الّتعرُّض لعوامِل الخطر التي قد تؤدي لسرطان الكبد، ومن أنجح أشكالِها هو إعطاء مطعوم التهاب الكبد الوبائي بي. حاليّا لا يوجد مطعوم لالتهاب الكبد الوبائي سي. و من وسائل الوقايّة الأوليّة أيضا: التقليل من انتشار هذه الفيروسات باستعمال طرق الحقن المعقمة وفحص دم المتبرِّعين وعمل فحص للأشخاص المعرَّضين للإصابة بها. تقليل الّتعرُّض للأفلاتوكسين باستعمال وسائِل منع الفطريات من النموّ بعد الحصاد، وهذه الّطريقة نَجحت في غرب أفريقيا. تقليل الكحوليات ومنع الّسمنة والّسكر يُقلِّل خطر الّسرطان. التّحكم في غذاء مرضى التّصبُّغ الّدموي الوراثي قد يخفض من احتمالية زيادة الحديد في الجسم وبالّتالي يخفض احتمالية سرطان الكبد.[38]
الوقاية الّثانوية تكون بعلاج الّشيء المُسرطِن أو بمنع عملية التّسرطن. لا يمكن علاج شخص مُصاب بالفيروس بِشكل تام ولكن إعطاء الأدوية المضادّة للفيروسات مثل: الانترفيرون يُقلِّل خطر سرطان الكبد. وَوِجِد أن الكلوروفيل لين قد يقلل آثار الأفلاتوكسين.[38]
الوقاية الّثالثية تتضّمن العلاجات التي تمنع عودة سرطان الكبد الذي تم التعافي منه وذلك باستخدام العلاج الكيميائي والأدوية المضادّة للفيروسات.[38]
حقائق سريعة:
- سرطان الكبد هو نمو وانتشار خلايا غير سليمة داخل الكبد.
- السرطان الذي ينشأ داخل الكبد اسمه سرطان الكبد الأولي. أما السرطان الذي ينتقل إلى الكبد من عضو آخر فاسمه سرطان الكبد الثانوي (النقيلي).
- يتم سنويا تشخيص إصابة حوالي 21.000 أمريكي بسرطان الكبد الأولي.
- ويعتبر سرطان الكبد الأولي واحد من السرطانات القليلة الآخذ عدد الإصابات بها في الارتفاع في الولايات المتحدة الأمريكية .
- السرطان الأولي أكثر شيوعا بمرتين لدى الرجال منه لدى النساء.
• عوامل خطورة الإصابة بسرطان الكبد الأولي هي أمراض الكبد الأخرى بشكل رئيسي تشمع الكبد والتهاب الكبد المزمن من النوعين بي و سي.
- لا توجد عادة أعراض لسرطان الكبد في المراحل الأولى.
- غالبا ما ينصح الأطباء بإجراء فحوصات دورية للكشف عن السرطان عند الأشخاص الذين لديهم عوامل خطورة للإصابة بسرطان الكبد.
- يحتاج تشخيص سرطان الكبد للفحص السريري وفحوص التصوير والفحوص المخبرية والخزعة والتشريح المرضي .
- يعتمد أسلوب العلاج على حالة الكبد وحجم وموضع وعدد العقد الورمية، وإذا ما كان السرطان قد انتشر إلى خارج الكبد وعمر المريض وحالته العامة .
الوبائيات
تَسبَّبَ سرطان الكبد في عام 2010 عالمياً بوفاة 754000 شخص مُرتفِعا عن 460000 شخص عام 1990، الأمر الذي يجعله ثالث سبب للوفاة بين الّسرطانات بعد سرطان الّرئة وسرطان المَعِدة.[39] في عام 2012 شكّلت حالات سرطان الكبد 7% من الحالات المشخّصة عند الّذكور، خامس أكثر سرطان يتم تشخيصه في ذلك العام.[40] من حالات الوفاة 340000 بِسَبَب التِهاب الكبِد الوبائي بي، 196000 بسبب التِهاب الكبِد الوبائي سي، و 150000 بِسَبَب الكُحول.[39] سرطان الخلايا الكبِديّة كان الأكثر شيوعا، واتخذ توزيعاً جغرافياُ واضحاً حيث مثّلَت الّصين 50% من الحالات، وأكثر من 80% من الحالات التي شُخِّصَت في أفريقيا وشَرق آسيا كانت بِسبَب التِهاب الكبِد الوبائي بي.[4][41]

سرطان القنوات الّصفراويّة كان له أيضاً توزيعاً جغرافياً واضحاُ حيثُ كانت أعلى الِّنسَب في تايلاند بِسبَب الّدودة المثقوبة الكبدية liver fluke.[4][42]
في المملكة المتحدة يشكِّل سرطان الكبِد ثامِن أكثر السرَطانات انتشارا. والّسبَب الّثاني عشر للوفاة بِسبَب الّسرطان.[43]
في الأبحاث: Hepcortespenlisimut L- هو عِلاج مَناعي يَمُرّ حالِياً في المرحلة الّثالِثة من الّتجارب الإكلينيكيّة لِعلاج سرطان الخلايا الكبديّة.[44]
مراجع
- [www.liverfoundation.org] american liver foundation
- مُعرِّف أنطولوجيا مرض: http://www.disease-ontology.org/?id=DOID:3571 — تاريخ الاطلاع: 15 مايو 2019 — الرخصة: CC0
- GBD 2013 Mortality and Causes of Death (17 ديسمبر 2014)، "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013."، Lancet، doi:10.1016/S0140-6736(14)61682-2، PMID 25530442.
- World Cancer Report 2014، World Health Organization، 2014، ص. Chapter 1.1، ISBN 9283204298.
- Jemal, A؛ Bray, F؛ Center, MM؛ Ferlay, J؛ Ward, E؛ Forman, D (مارس–أبريل 2011)، "Global cancer statistics."، CA: a cancer journal for clinicians، 61 (2): 69–90، doi:10.3322/caac.20107، PMID 21296855.
- "SEER Stat Fact Sheets: Liver and Intrahepatic Bile Duct Cancer"، NCI، مؤرشف من الأصل في 09 فبراير 2019، اطلع عليه بتاريخ 18 يونيو 2014.
- Ahmed, Ahmed, I; Lobo D.N.؛ Lobo (يناير 2009)، "Malignant tumours of the liver"، Surgery (Oxford)، 27 (1): 30–37، doi:10.1016/j.mpsur.2008.12.005.
- Emre, S؛ McKenna, GJ (ديسمبر 2004)، "Liver tumors in children."، Pediatric transplantation، 8 (6): 632–8، doi:10.1111/j.1399-3046.2004.00268.x، PMID 15598339.
- Khan, SA؛ Davidson, BR; Goldin, RD; Heaton, N; Karani, J; Pereira, SP; Rosenberg, WM; Tait, P; Taylor-Robinson, SD; Thillainayagam, AV; Thomas, HC; Wasan, H; British Society of, Gastroenterology (ديسمبر 2012)، "Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update"، Gut، 61 (12): 1657–69، doi:10.1136/gutjnl-2011-301748، PMID 22895392.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Arzumanyan, A؛ Reis, HM؛ Feitelson, MA (فبراير 2013)، "Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma."، Nature reviews. Cancer، 13 (2): 123–35، doi:10.1038/nrc3449، PMID 23344543.
- Rosen, HR (23 يونيو 2011)، "Clinical practice. Chronic hepatitis C infection."، The New England Journal of Medicine، 364 (25): 2429–38، doi:10.1056/NEJMcp1006613، PMID 21696309.
- "General Information About Adult Primary Liver Cancer"، National Cancer Institute، مؤرشف من الأصل في 04 أبريل 2015، اطلع عليه بتاريخ 13 يناير 2013.
- Jeong, SW؛ Jang, JY؛ Chung, RT (ديسمبر 2012)، "Hepatitis C virus and hepatocarcinogenesis."، Clinical and molecular hepatology، 18 (4): 347–56، doi:10.3350/cmh.2012.18.4.347، PMID 23323249.
- Ralphs, S؛ Khan, SA (مايو 2013)، "The role of the hepatitis viruses in cholangiocarcinoma."، Journal of viral hepatitis، 20 (5): 297–305، doi:10.1111/jvh.12093، PMID 23565610.
- Kew, MC (مارس 2013)، "Hepatitis viruses (other than hepatitis B and C viruses) as causes of hepatocellular carcinoma: an update."، Journal of viral hepatitis، 20 (3): 149–57، doi:10.1111/jvh.12043، PMID 23383653.
- Fattovich, G؛ Stroffolini, T؛ Zagni, I؛ Donato, F (نوفمبر 2004)، "Hepatocellular carcinoma in cirrhosis: incidence and risk factors."، Gastroenterology، 127 (5 Suppl 1): S35–50، doi:10.1053/j.gastro.2004.09.014، PMID 15508101.
- Kensler, TW؛ Roebuck, BD؛ Wogan, GN؛ Groopman, JD (مارس 2011)، "Aflatoxin: a 50-year odyssey of mechanistic and translational toxicology"، Toxicological sciences : an official journal of the Society of Toxicology، 120 Suppl 1: S28–48، doi:10.1093/toxsci/kfq283، PMC 3043084، PMID 20881231.
- Chuang, SC؛ La Vecchia, C; Boffetta, P (1 ديسمبر 2009)، "Liver cancer: descriptive epidemiology and risk factors other than HBV and HCV infection"، Cancer letters، 286 (1): 9–14، doi:10.1016/j.canlet.2008.10.040، PMID 19091458.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Di Tommaso, L؛ Sangiovanni, A؛ Borzio, M؛ Park, YN؛ Farinati, F؛ Roncalli, M (أبريل 2013)، "Advanced precancerous lesions in the liver."، Best practice & research. Clinical gastroenterology، 27 (2): 269–84، doi:10.1016/j.bpg.2013.03.015، PMID 23809245.
- Razumilava, N؛ Gores, GJ (يناير 2013)، "Classification, diagnosis, and management of cholangiocarcinoma."، Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association، 11 (1): 13–21.e1, quiz e3–4، doi:10.1016/j.cgh.2012.09.009، PMID 22982100.
- DeBaun, MR؛ Tucker, MA (مارس 1998)، "Risk of cancer during the first four years of life in children from The Beckwith-Wiedemann Syndrome Registry."، The Journal of pediatrics، 132 (3 Pt 1): 398–400، doi:10.1016/S0022-3476(98)70008-3، PMID 9544889.
- Spector, LG؛ Birch, J (نوفمبر 2012)، "The epidemiology of hepatoblastoma."، Pediatric blood & cancer، 59 (5): 776–9، doi:10.1002/pbc.24215، PMID 22692949.
- Davit-Spraul, A؛ Gonzales, E؛ Baussan, C؛ Jacquemin, E (8 يناير 2009)، "Progressive familial intrahepatic cholestasis"، Orphanet journal of rare diseases، 4: 1، doi:10.1186/1750-1172-4-1، PMC 2647530، PMID 19133130.
- Cholangiocarcinoma في موقع إي ميديسين
- "Liver tumors in Children"، Boston Children's Hospital، مؤرشف من الأصل في 13 مايو 2013.
- Ariff, B؛ Lloyd, CR؛ Khan, S؛ Shariff, M؛ Thillainayagam, AV؛ Bansi, DS؛ Khan, SA؛ Taylor-Robinson, SD؛ Lim, AK (21 مارس 2009)، "Imaging of liver cancer"، World journal of gastroenterology : WJG، 15 (11): 1289–300، doi:10.3748/wjg.15.1289، PMC 2658841، PMID 19294758.
- Malaguarnera, G؛ Paladina, I؛ Giordano, M؛ Malaguarnera, M؛ Bertino, G؛ Berretta, M (2013)، "Serum markers of intrahepatic cholangiocarcinoma"، Disease markers، 34 (4): 219–28، doi:10.3233/DMA-130964 (غير نشط 14 يناير 2015)، PMID 23396291.
{{استشهاد بدورية محكمة}}: صيانة CS1: وصلة دوي غير نشطة منذ 2015 (link) - Zhao, Y; Qiang, J; Li, C؛ Ju؛ Li (2013)، "Tumor markers for hepatocellular carcinoma (Review)"، Molecular and Clinical Oncology، 1 (4): 593–598، doi:10.3892/mco.2013.119، PMC 3915636، PMID 24649215.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Bruix, J؛ Sherman, M; American Association for the Study of Liver, Diseases (مارس 2011)، "Management of hepatocellular carcinoma: an update"، Hepatology (Baltimore, Md.)، 53 (3): 1020–2، doi:10.1002/hep.24199، PMID 21374666.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wang, ZG؛ Zhang, GF؛ Wu, JC؛ Jia, MK (أغسطس 2013)، "Adjuvant therapy for hepatocellular carcinoma: Current situation and prospect."، Drug discoveries & therapeutics، 7 (4): 137–143، doi:10.5582/ddt.2013.v7.4.137، PMID 24071575.
- de Lope, CR؛ Tremosini, S؛ Forner, A؛ Reig, M؛ Bruix, J (2012)، "Management of HCC."، Journal of hepatology، 56 Suppl 1: S75–87، doi:10.1016/S0168-8278(12)60009-9، PMID 22300468.
- Feng, M؛ Ben-Josef, E (أكتوبر 2011)، "Radiation therapy for hepatocellular carcinoma."، Seminars in radiation oncology، 21 (4): 271–7، doi:10.1016/j.semradonc.2011.05.002، PMID 21939856.
- Ulstrup, T؛ Pedersen, FM (25 فبراير 2013)، "[Photodynamic therapy of cholangiocarcinomas]."، Ugeskrift for laeger، 175 (9): 579–82، PMID 23608009.
- Kuhlmann, JB؛ Blum, HE (مايو 2013)، "Locoregional therapy for cholangiocarcinoma."، Current opinion in gastroenterology، 29 (3): 324–8، doi:10.1097/MOG.0b013e32835d9dea، PMID 23337933.
- Ortner, MA (سبتمبر 2011)، "Photodynamic therapy for cholangiocarcinoma"، Lasers in surgery and medicine، 43 (7): 776–80، doi:10.1002/lsm.21106 (غير نشط 14 يناير 2015)، PMID 22057505.
{{استشهاد بدورية محكمة}}: صيانة CS1: وصلة دوي غير نشطة منذ 2015 (link) - Valero V, 3rd؛ Cosgrove, D؛ Herman, JM؛ Pawlik, TM (أغسطس 2012)، "Management of perihilar cholangiocarcinoma in the era of multimodal therapy."، Expert review of gastroenterology & hepatology، 6 (4): 481–95، doi:10.1586/egh.12.20، PMID 22928900.
- Meyers, RL؛ Czauderna, P؛ Otte, JB (نوفمبر 2012)، "Surgical treatment of hepatoblastoma."، Pediatric blood & cancer، 59 (5): 800–8، doi:10.1002/pbc.24220، PMID 22887704.
- Perilongo, G؛ Malogolowkin, M؛ Feusner, J (نوفمبر 2012)، "Hepatoblastoma clinical research: lessons learned and future challenges."، Pediatric blood & cancer، 59 (5): 818–21، doi:10.1002/pbc.24217، PMID 22678761.
- Hoshida, Y؛ Fuchs, BC؛ Tanabe, KK (1 نوفمبر 2012)، "Prevention of hepatocellular carcinoma: potential targets, experimental models, and clinical challenges."، Current cancer drug targets، 12 (9): 1129–59، doi:10.2174/156800912803987977، PMID 22873223.
- Lozano, R؛ Naghavi؛ Foreman؛ Lim؛ Shibuya؛ Aboyans؛ Abraham؛ Adair؛ Aggarwal؛ Ahn, S. Y.؛ Alvarado, M؛ Anderson, H. R.؛ Anderson, L. M.؛ Andrews, K. G.؛ Atkinson, C؛ Baddour, L. M.؛ Barker-Collo, S؛ Bartels, D. H.؛ Bell, M. L.؛ Benjamin, E. J.؛ Bennett, D؛ Bhalla, K؛ Bikbov, B؛ Bin Abdulhak, A؛ Birbeck, G؛ Blyth, F؛ Bolliger, I؛ Boufous, S؛ Bucello, C؛ وآخرون (15 ديسمبر 2012)، "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010"، Lancet، 380 (9859): 2095–128، doi:10.1016/S0140-6736(12)61728-0، PMID 23245604.
- World Cancer Report 2014، International Agency for Research on Cancer, World Health Organization، 2014، ISBN 978-92-832-0432-9.
- El-Serag, HB؛ Rudolph, KL (يونيو 2007)، "Hepatocellular carcinoma: epidemiology and molecular carcinogenesis."، Gastroenterology، 132 (7): 2557–76، doi:10.1053/j.gastro.2007.04.061، PMID 17570226.
- Khan, SA؛ Toledano, MB؛ Taylor-Robinson, SD (2008)، "Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma."، HPB : the official journal of the International Hepato Pancreato Biliary Association، 10 (2): 77–82، doi:10.1080/13651820801992641، PMID 18773060.
- "Liver cancer statistics"، Cancer Research UK، مؤرشف من الأصل في 12 مايو 2015، اطلع عليه بتاريخ 28 أكتوبر 2014.
- Immunitor Phase 3 trial of hepcortespenlisimut-L, Liver Cancer Immunotherapy https://clinicaltrials.gov/ct2/show/NCT02232490 نسخة محفوظة 2020-05-12 على موقع واي باك مشين.
- بوابة طب