سلسلة لايمان
مجموعة خطوط لايمان في الفيزياء والكيمياء هي سلسلة من خطوط الطيف تابعة لانتقال الإلكترون في الذرة، وتظهر تلك الخطوط في حيز الأشعة فوق البنفسجية في طيف ذرة الهيدروجين، أي أن تلك الأشعة لا يمكن رؤياها بالعين البشرية.[1][2][3]
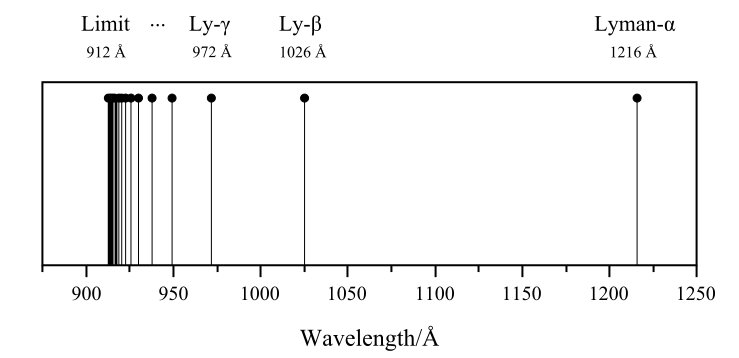
توجد أيضا لطيف الهيدروجين خطوط طيف تكون في حيز الضوء المرئي ويمكن رؤيتها بالعين، وتسمى تلك المجموعة الأخرى مجموعة خطوط بالمر، أو سلسلة بالمر وهي أول مجموعة خطوط طيف تكتشف لذرة الهيدروجين.
تظهر مجموعة طيف لايمان عندما يقفز الإلكترون الموجود في ذرة الهيدروجين من مستوى طاقة ≥ 2 إلى مستوى الطاقة n = 1 .
والعدد n هو عدد كم رئيسي يميز مستوى طاقة للإلكترون في الذرة. وانتقالاته من مستويات عالية للطاقة إلى مستوى طاقة أقل يكون مصحوبا بإصدار الإلكترون فوتونا قد يكون ضوئيا كما في حالة مجموعة خطوط بالمر أو يكون في نطاق الأشعة فوق البنفسجية ولا يُرى كما يحدث في مجموعة خطوط لايمان.
ويسمى تتبابع الانتقالات أو القفزات بالحروف الإغريقية كالآتي:
من n = 2 إلى n = 1 يسمى لايمان-الفا
من n = 3 إلى n = 1 يسمى لايمان-بيتا،
من n = 4 إلى n = 1 يسمى لايمان-جاما، وهكذا.
وتسمى خطوط الطيف هذه تبعا لاسم مكتشفها وهو العالم تيودور لايمان.
الصياغة الرياضية
تعطي المعادلة المسماة على اسم مكتشفها لايمان العدد الموجي (العدد الموجي هو عدد الموجات في 1 متر من الشعاع) لكل خط من خطوط الطيف هنا كالآتي:
حيث:
- n عدد صحيح أكبر من 1 .
ويمكن صياغة تلك المعادلة بحيث تعطي طول الموجة بدلا من العدد الموجي، كالآتي:
كما يمكن صياغتها لإعطاء طاقة الفوتون:
وفي هذه المعادلة تعني:
- c سرعة الضوء في الفراغ،
h ثابت بلانك.
يمكن باستخدام معادلة لايمان أعلاه و «ثابت ريدبرج» حساب أطوال موجات طيف لايمان:
| n | الرمز | طول الموجة (نانومتر) |
|---|---|---|
| 2 | Lyman-α-Linie | 121,5 |
| 3 | Lyman-β-Linie | 102,5 |
| 4 | … | 97,20 |
| 5 | … | 94,92 |
| 6 | … | 93,73 |
| 7 | … | 93,03 |
| 8 | … | 92,57 |
| 9 | … | 92,27 |
| 10 | … | 92,05 |
| 11 | … | 91,89 |
| … | 91,13 |

استخدماتها
تقع خطوط لايمان في نطاق الأشعة فوق البنفسجية ولذلك فلا يمكن رؤياها بالعين ويهتم بها علماء الفلك في دراستهم للنجوم والمجرات. وقد اكتشفها العالم الفيزيائي الأمريكي ثيودور لايمان عام 1906.
ويحوز الخط لايمان-ألفا عند الفلكيين اهتماما خاصا عند دراستهم للمجرات البعيدة والنجوم الزائفة أوشبه النجوم، ذلك لأن الانزياح الأحمر للضوء والأشعة الكهرومغناطيسية الصادرة من الأجرام السماوية (بسبب بعدها عنا تنزاح خطوط الطيف إلى حيز الضوء المرئي أو الأشعة تحت الحمراء)، كما أن توزيع الهيدروجين في الأنحاء المختلفة في الكون يمكن معرفته عن طريق قياس طيف لايمان (انظر تقنية لايمان).
ولكن من الأرض لا يمكن رصد خطوط لايمان بسبب امتصاص جو الأرض للاشعة فوق البنفسجية، ويمكن ذلك عندما يكون الأنزياح نحو الأحمر للجرم السماوي كافيا، عندئذ يمكن رؤيته بالعين. وإلا استخدمت ألواحا فوتوغرافية أو الأحسن إرسال تلسكوبات على متن أقمارا صناعية للتصوير من خارج الغلاف الجوي الأرضي.
أطياف الهيدروجين
وقد كان الفيزيائيون يعرفون إصدارات الذرة للأشعة الطيف قبل عام 1885 إلا أنه لم يكن في استطاعتهم حساب موقع كل خط في الطيف. واستطاع بالمر بمعادلته حساب الأربعة خطوط الموجودة في نطاق الضوء المرئي في مجموعة خطوط بالمر بدقة. وأوحت معادلة بالمر التي صاغها طبقا لمشاهداته العملية للفيزيائيين لصياغة معادلات أخرى تختص ب مجموعة خطوط لايمان، ومجموعة خطوط باشين، ومجموعة خطوط براكيت، والتي تصف خطوط انبعاث أو خطوط امتصاص لذرة الهيدروجين، وكلها توجد في نطاق الضوء الغير مرئي.
أي أنه توجد للهيدروجين خمسة أطياف مختلفة، تتميز فيما بينها بمستوى الطاقة n الذي ينحدر إليه الإلكترون قادما من مستوى طاقة عالية. فإذا هبط الإلكترون إلى المدار الأول (N= 1) فإنه يصدر فوتونات تؤول إلى مجموعة خطوط لايمان، أما إذا كان انتقاله من أعلى ألى (N=2) فإنه يصدر سلسلة بالمر، وهكذا، (قارن الصورة).
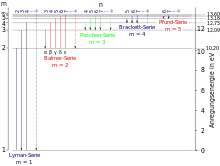
ملحوظة: يعطي المحور الرأسي اليساري أرقام المدارات في ذرة الهيدروجين m (بدلا من n). ويعطي المحور الرأسي اليميني مقدار طاقة كل شعاع بوحد إلكترون فولت.
اقرأ أيضا
مراجع
- "معلومات عن سلسلة لايمان على موقع jstor.org"، jstor.org، مؤرشف من الأصل في 3 أكتوبر 2020.
- "معلومات عن سلسلة لايمان على موقع bigenc.ru"، bigenc.ru، مؤرشف من الأصل في 29 أكتوبر 2020.
- "معلومات عن سلسلة لايمان على موقع britannica.com"، britannica.com، مؤرشف من الأصل في 29 أكتوبر 2020.