كبريتات
الكبريتات أو السلفات في الكيمياء (في التراث: الزاج) هي أملاح أو استرات لحمض الكبريتيك.[1][2][3] تحتوي تلك الأملاح على أنيون الكبريتات SO4−2 أو أنيون الكبريتات الهيدروجينية HSO4−.
| كبريتات | |
|---|---|
 The structure and bonding of the sulfate ion | |
 كبريتات |
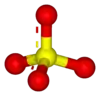 كبريتات |
| تسمية الاتحاد الدولي للكيمياء | |
Sulfate | |
| المعرفات | |
| رقم CAS | 14808-79-8 |
| بوب كيم (PubChem) | 1117 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| الصيغة الجزيئية | SO42- |
| الكتلة المولية | 96.07 g mol−1 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
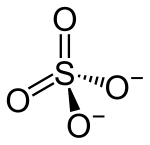
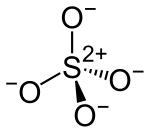
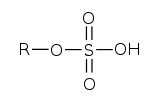
ويتميز استر حمض الكبريتيك بالصيغة الكيميائية : R−O−SO2−O−R', حيث R و/أو R' جزيئ عضوي.
التسمية
الأولية والثانوية
تنقسم أملاح حمض الكبريتيك الثنائي التكافؤ (H2SO4) إلى نوعين «كبريتات» و«كبريتات هيدروجينية» وهي تسمى أحيانا كبريتات أولية أو كبريتات ثانوية على التوالي. بالنسبة إلى الكاتيونات MI تنطبق الصيغتين: MIHSO4 و MI2SO4:
| كبريتات هيدروجينية (كبريتات أولية) | كبريتات ثانوية | |
|---|---|---|
| تسميات | كبريتات حمضية كبريتات هيدروجينية بيكبريتات | كبريتات متعادلة كبريتات |
| أمثلة | كبريتات الصوديوم الهيدروجينية, NaHSO4 كبريتات الكالسيوم الهيدروجينية, Ca(HSO4)2 | كبريتات الصوديوم, Na2SO4 كبريتات الكالسيوم, CaSO4 |
- كبريتات الكالسيوم هو الجبس المستخدم في البناء.
الشبة
مركبات الشبة أملاح ثنائية تتكون من كاتيونات أحادية التكافؤ وكاتيونات ثلاثية التكافؤ. صيغتها الكيميائية : MIMIII(SO4)2 12 H2O,. وأهمها شبة كبريتات الكالسيوم-ألمونيوم.
الخصائص
بصفة عامة
تذوب معظم السلفات في الماء. ويخرج عن تلك القاعدة كبريتات [[فلز قلوي تراب|الفلزات القلوية الترابية : كبريتات الكالسيوم وكبريتات السترونتيوم وكبريتات الباريوم وكبريتات الرصاص lead(II)-sulfate.
وتتميز كبريتات الفلزات القلوية وكبريتات الفلزات القلوية الترابية بأنها مستقرة ضد الحرارة. وتتحلل سلفات الفلزات ثلاثية التكافؤ بالحرارة وتنتج أكسيد الفلز وثالث أكسيد الكبريت:
وتعرف للسلفات الهيدروجينية أملاحا للقلويات ، وهي تذوب في الماء. وعند تسخينها تنتج ما يسمى ديسلفات.
الأنيونات و pH
يعتبر حمض الكبريتيك حمضا قويا يحتوي على بروتونين. ولا توجد في محلول منه ذو مولارية 1 في الماء جزيئات غير مفككة H2SO4 ، وإنما تكون متأينة على الصورة : , HSO4−- وأيونهيدروجين. كما توجد نسبة ضئيلة فقط (1%) من الأيونات HSO4−- في الهيئة SO42− حيث تفقد أيون الهيدروجين الثاني.
أما أنيون الكبريتات الهيدروجينية (HSO4−) فيمكن أن يعمل كحمض كما يمكن أن يعمل كقاعدة فهو ثنائي السلوك. وتبلغ قيمة ثابت تفكك الحمض pKS لأيون السلفات الهيدروجيني 89و1.
عند ذوبان أملاح الكبريتات الهيدروجينية في الماء تتفاعل مع الماء حتى يحدث توازن كيميائي حيث يتكون خليط من أيونات السلفات والسلفات الهيدروجينية. لذلك تستخدم السلفات الهيدروجينية أحيانا كحمض متوسط القوة ، ومع ذلك تكون قوة الحمض أعلى من قوة حمض الخليك (pKS = 4,76).
لهذا السبب تستخدم الكبريتات الهيدروجينية كمحاليل منظمة وهي في ذلك تقارب مفعول الأحماض القوية. ونظرا لتفاعلها الحمضي مع الماء فهي تستخدم في تنطيف الحمامات ودوراة المياة.
استخداماتها
تستخدم السلفات كثيرا في الصناعات الكيميائية ونجدها طبيعيا في بعض الأنظمة البيولوجية:
- تستخدم كبريتات الرصاص وحمض الكبريتيك في بطارية الرصاص للسيارات،
- تستخدم كبريتات المغنسيوم في العلاج الطبي خارج الجسم كحمام مائي،
- الجبس وهو المصدر الطبيعي لكبريتات الكالسيوم المتميئة ويستخدم في طلاء البنايات ،
- يستخدم أيون السلفات كمعادل لبعض الكاتيونات في العقارات.
- يستخدم كبريتات النحاس لتنقية الماء.
- كما تعيش بعض الكائنات الأولية على ينابيع طبيعية تحتوي على الكبريتات في قاع البحار حيث تختزل الكبريتات وتؤكسد مركبات عضوية أو هيدروجين. تلك البكتريا تسمى «بكتيريا مختزلة الكبريتات».
مراجع
- Metathesaurus&code=C3536965 "معلومات عن كبريتات على موقع ncim-stage.nci.nih.gov"، ncim-stage.nci.nih.gov، مؤرشف من Metathesaurus&code=C3536965 الأصل في 13 ديسمبر 2019.
{{استشهاد ويب}}: تحقق من قيمة|مسار أرشيف=(مساعدة)، تحقق من قيمة|مسار=(مساعدة) - "معلومات عن كبريتات على موقع britannica.com"، britannica.com، مؤرشف من الأصل في 27 فبراير 2016.
- "معلومات عن كبريتات على موقع ebi.ac.uk"، ebi.ac.uk، مؤرشف من الأصل في 13 يونيو 2019.
- بوابة الكيمياء