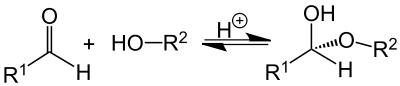
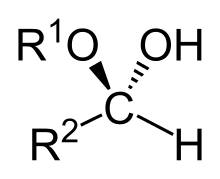
شبه اسيتال
هيمي أسيتال[1] أو نصف أسيتال أو أسيتال نصفي[1] أو شبه أسيتال (بالإنجليزية: Hemiacetals) هي مركبات كيميائية تحتوي على مجموعة أرولاوكسيد (OR-) ومجموعة هيدروكسيل (OH-) كمجموعات وظيفية والتي ترتبط بنفس ذرة الكربون. «نصف الأسيتال» يتكون كمرحلة وسيطة (ناتج وسطي) في تفاعل تشكيل الأسيتال عند إضافة مركب كحولي إلى مجموعة كاربونيل، كعامل محفز يمكن استخدام الأحماض أو القواعد. بتحفيز من حمض قوي ينشئ أخيرا استيال من خلال التفاعل مع جزئ كحول أخر.[2] لديها الصيغة العامة R1R2C(OH)OR ، حيث R لا يمكن أن يكون هيدروجين.[3] «النصف أسيتال» الحلقي يسمى لكتول Lactole .
المواد الطبيعية
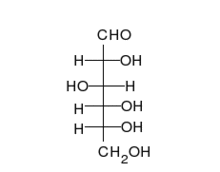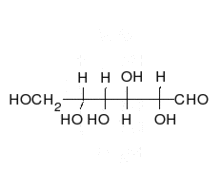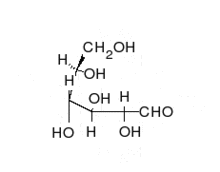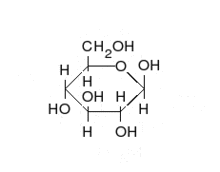
العديد من السكريات تعتبر سكريات ألدهيدية، مثل د-الجلوكوز. السكريات الألدهيدية غالبا ما تكون على هيئة شبه أسيتال حلقي.

تشكيل الجلوكوز الحلقي[4]
الجلوكوز هو أهم مصادر الطاقة للإنسان والحيوان ومخزن للطاقة الشمسية في النباتات، ونقصد هنا د-جلوكوز وهو سكر سداسي من الألدهوزات أو السكريات الألدهيدية. لكن في المحاليل غالبا ما يكون على شكل حلقي، حتى يتم تشكيل الحلقة تقوم مجموعة الألدهود في ذرة الكربون الأولى بالتفاعل مع مجموعة الكحول في الغالب من ذرة الكربون الخامسة لأن ذلك الأوفر للطاقة، وينتج عن ذلك تكون «شبه أسيتال» بحيث تكتسب ذرة الكربون الأولى مجموعة الكحول، فإذا كانت مجموعة الكحول تلك إلى الأعلى (على مستوى سطح مسقط هوارث) عندئذ يسمى الجلكوز بيتا جلوكوز (بيتا د-جلوكوز) أما إذا كان إلى الأسفل فيدعى ألفا جلوكوز (ألفا د-جلوكوز). في جسم الإنسان غالبا ما يتكون بيتا جلكوز لأنه أوفر للطاقة، حيث أن مجموعة الهيدروكسول لذرة الكربون الأولى في ألفا جلوكوز تتنافر مع مجوعة الهيدروكسول لذرة الكربون الثانية، مما يتطلب طاقة أكبر مما في بيتا جلوكوز التي تكون فيه مجموعتا الهيدروكسول أبعد عن بعض. يسمى كلا الشكلين الجلكوز ألفا وبيتا أنومير (تتشابه في الرموز الكيميائية وكذلك في المجموعات الوظيفية ولكن يختلفان فقط في موضع مجموعة الهدروكسول عند الذرة الكربون الأولى الغير طبيعية الموضع مصاوغ كربونيلي (أنومير anomer C1-Atom)، حوالي 66% من الجلوكوز المكون من نوع بيتا، و 1% من النوع الغير حلقي.
أهمية الجلوكوز الحلقي
تمثل ذرة الكربون الأولى في السكر الحلقي خصوصاً في الجلوكوز أهمية كبيرة لأنها نشطه في التفاعلات حيث يمكن تشكيل روابط جلوكوزية مع ذرات سكريات سداسية أخرى أو مع أحماض أمينية أو ببتيدات أو بروتينات. يوجد نوعين من الروابط جلوكوزية اكسجينية أو نيتروجينية:
- الرابطة الجلوكوزية الاكسجينية:
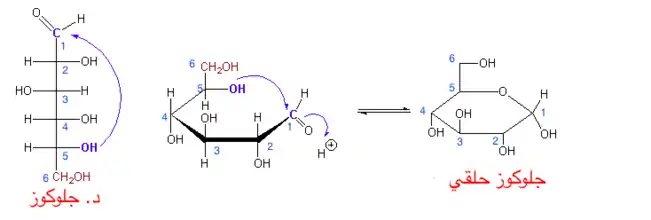 تكون الجلكوز الحلقي من الجلكوز غير الحلقي وبناء أسيتال نصفي في تفاعل إزاحة الهيدروجينات تقوم مجموعة الهيدروكسيل عادة من ذرة الكربون الخامسة بالتفاعل مع مجموعة الكيتون من الذرة الأولى للكربون لتكون أسيتال نصفي ومجموعة كاربكسول مرتبطة بذرة الكربون الأولى التي بدورها تشكل مجموعة نشطة في التفاعلات الكيمائية
تكون الجلكوز الحلقي من الجلكوز غير الحلقي وبناء أسيتال نصفي في تفاعل إزاحة الهيدروجينات تقوم مجموعة الهيدروكسيل عادة من ذرة الكربون الخامسة بالتفاعل مع مجموعة الكيتون من الذرة الأولى للكربون لتكون أسيتال نصفي ومجموعة كاربكسول مرتبطة بذرة الكربون الأولى التي بدورها تشكل مجموعة نشطة في التفاعلات الكيمائية- يمكن بنائها مع سكر أحادي أخر ويتكون بذلك سكر ثنائي، وتلعب هنا مجموعة الكحول (الهيدروكسيل) في ذرة الكربون الأولى دورا مهما كونها نشطة في التفاعلات عند إرتباط جزئي جلوكوز معها يتكون المالتوز (ألفا جلوكوز 1-4 جلوكوز)، عند إرتباط الجلاكتوز مع الجلوكوز يمكن ان يتكون اللاكتوز (سكر حليب: بيتا جلاكتوز 1-4 جلوكوز)، وهذه الرابطة الوحيدة من نوع بيتا التي يمكن أن يجزئها الجسم البشري بواسطة إنزيم اللاكتاز في حال حصول خلل في عمل الإنزيم يتكون عندئذ حساسية من اللاكتوز، إذا تفاعل الفركتوز مع الجلوكوز يمكن أن ينتج السكروز (سكر قصب: ألفا جلوكوز 1-2 بيتا فركتوز) الجدير بالذكر أن رابطة السكروز غير قابلة للتمديد كون المجموعة النشطة ضالعة في الرابطة الجلوكوزية.
- يمكن بناء رابطة جلوكوزية أكسيجينية كذلك مع الأحماض الأمينية (سيرين وثريونين) لأنها تحتوي على مجموعة كحولية في المجموعات الطرفية.
- الرابطة الجلوكوزية النيتروجينية:
- يمكن أن تنشئ رابطة نيتروجينية مع الأحماض الأمينية في الببتيدات (أرجينين: مجموعة الأمين من المجموعة الفرعية)
- يمكن أن تنشئ كذلك مع قواعد الأحماض النووية الصبغية (DNA)
التشكيل
أشباه الأسيتال هي مرحلة وسيطة في تكوين الأسيتالات.
شبة أسيتال ثنائي الثيول

إذا تم استبدال ذرتي الأكسجين بذرتي كبريت في شبه الأسيتال، سنحصل على شبه أسيتال ثنائي الثيول. تلعب أشباه الأسيتال ثنائية الثيول دورا مركزيا عند إنتاج المضاد الحيوي إريثروميسين.[5] شبه الأسيتال ثنائي الثيول هو الذي يمنح فاكهة دوريان الإستوائية رائحتها المعتادة.[6]
المراجع
- "Al-Qamoos القاموس | English Arabic dictionary / قاموس إنجليزي عربي"، www.alqamoos.org، مؤرشف من الأصل في 4 يناير 2019، اطلع عليه بتاريخ 04 يناير 2019.
- سيغفريد هالكمان: الكيمياء العضوية, 2.
- الاتحاد الدولي للكيمياء البحتة والتطبيقية. "{{{title}}}". Compendium of Chemical Terminology Internet edition.
- Horn, Florian (2009)، Biochemie des Menschen: das Lehrbuch für das Medizinstudium (باللغة الألمانية)، Georg Thieme Verlag، ISBN 9783131308849، مؤرشف من الأصل في 2 يناير 2020.
- R. B. وودوارد ، E. Logusch, K. P. نامبيار ، ك سكن, D. E. وارد B. W. Auyeung, P. بلا رام, L. J. براون, P. J. بطاقة, C. H. تشن R. B. Chenevert, A., Fliri; K. Frobel, H. J. Gais, D. G. Garratt ، ك هاياكاوا, W. Heggie D. P. Hesson, دي هوب, I. هوب, J. A., حياة, D. إيكيدا ، P. A. جاكوبي, K. S. كيم, Y. Kobuke, K., كوجيما ، K. Krowicki, V. J. Lee, T. Leutert, S. Malchenko, J. مارتنز, R. S. ماثيوز, B. S. Ong, J. B. الصحافة T. V. Rajanbabu ، ج. روسو, H. M., سوتر, M. سوزوكي, K. Tatsuta, L. M. تولبرت ، E. A. Truesdale, I. أوشيدا ، ي اده, T. Uyehara, A. T. Vasella, W. C. Vladuchick, P. A. وايد, R. M. ويليامز, H. N. C. وونغ: غير المتماثلة مجموع تركيب الاريثروميسين. 1.
- فولكر Mrasek: سر رائحة الفاكهة الألماني يدرس الباحثون الآسيوية دوريان, راديو ألمانيا "البحوث الأخبار" 11.نسخة محفوظة 04 أكتوبر 2018 على موقع واي باك مشين.
- بوابة الكيمياء