فلوروأسيتات الصوديوم
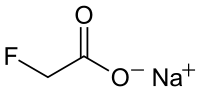
فلوروأسيتات الصوديوم مركب كيميائي له الصيغة C2H2FNaO2، ويكون على شكل مسحوق بلوري أبيض، وهو الملح الصوديومي حمض فلوروأسيتيك.
| فلوروأسيتات الصوديوم | |
|---|---|
 فلوروأسيتات الصوديوم | |
 فلوروأسيتات الصوديوم | |
| الاسم النظامي (IUPAC) | |
Sodium 2-fluoroacetate | |
| أسماء أخرى | |
1080; SFA; Sodium monofluoroacetate; Compound 1080 | |
| المعرفات | |
| رقم CAS | 62-74-8 |
| بوب كيم (PubChem) | 16212360 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C2H2FNaO2 |
| الكتلة المولية | 100.02 غ/مول |
| المظهر | مسحوق بلوري صلب عديم اللون إلى أبيض |
| نقطة الانصهار | 200 °س (يتفكك) |
| الذوبانية في الماء | منحل |
| المخاطر | |
| تحذيرات وقائية | R26 R27 R28 |
| مخاطر |  T T
 F F |
| حد التعرض المسموح به U.S | TWA 0.05 مغ/م3 (جلد)[3] |
| LD50 | 1.7 مغ/كغ (جرذان، فموي) 0.34 مغ/كغ (أرانب ، فموي) 0.1 مغ/كغ (جرذان، فموي) 0.3 مغ/كغ (خنزير غينيا، فموي) 0.1 مغ/كغ (فئران، فموي)[4] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يعد فلوروأسيتات الصوديوم من المركبات السامة التي يمكن أن تتواجد طبيعياً في بعض النباتات، كما يستخدم كمبيد آفات وله الرمز 1080.
التحضير
يحضر مركب فلوروأسيتات الصوديوم من تفاعل تعديل حمض فلوروأسيتيك مع مركب قلوي صوديومي مثل الصود الكاوي أو كربونات الصوديوم أو بيكربونات الصوديوم:
الوفرة الطبيعية
يوجد فلوروأسيتات الصوديوم طبيعياً في أكثر من 40 نبتة تتوزع في أستراليا وأمريكا الجنوبية (البرازيل) وفي أفريقيا. ومن هذه النباتات مثلاً نبات الجفبلار السنمي.
الخواص
يكون فلوروأسيتات الصوديوم على شكل صلب بلوري عديم اللون إلى أبيض، وهو سهل الانحلال في الماء. ينصهر المركب عند درجات حرارة تقارب 200 °س، ويترافق ذلك مع تفككه.
السمية
مركب فلوروأسيتات الصوديوم سام جداً، سواء أكان ذلك عن طريق استنشاق الغبار أو رذاذ المحاليل المائية، وكذلك الأمر في حال التماس مع الجلد، سواء أكان ذلك بالنسبة للإنسان أو الثدييات أوالحشرات.
تبدأ أعراض التسمم عند الإنسان لفترة تبدأ من 30 دقيقة إلى 3 ساعات. تبدأ الأعراض بالغثيان والتقيؤ مترافقاً مع آلام في البطن، بالإضافة إلى فرط التعرق والهيجان. ثم يحدث تشنج للعضلات وضيق في النفس وتزرّق في الجسم، وقد ينتهي الأمر بالوفاة بسبب اضطرابات نظم دقات القلب البطيني.
تبلغ الجرعة المميتة لمركب فلوروأسيتات الصوديوم عند الإنسان 5 - 10 مغ لكل كيلوغرام من وزن الجسم.
آلية التسمم
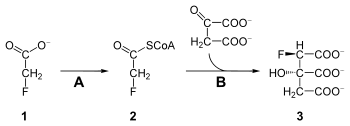
عند امتصاص فلوروأسيتات الصوديوم (1) في جسم الإنسان يستقلب في الجسم ويحول إلى (2R, 3S)- فلوروسيترات (3). يقوم هذا المشتق الفلوري من أملاح السترات (أملاح حمض الستريك أو حمض الليمون) بتعطيل إنزيم أكونيتاز Aconitase، والذي يحفز تحويل السترات إلى حمض الأكونيتيك. مما يعني في التالي تعطيل دورة حمض الستريك، وارتفاع تركيز السترات في الجسم، مما يؤثر على تزويد الطاقة إلى خلايا الجسم، وخاصة الخلايا التي تتطلب مستويات مرتفعة منها.[5]
الاستخدامات
يستخدم فلوروأسيتات الصوديوم في بعض البلدان كمبيد للآفات وكمبيد للقوارض. لكنه ممنوع الاستخدام في الدول الأوروبية.
المراجع
- العنوان : sodium fluoroacetate — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/16212360 — تاريخ الاطلاع: 6 أكتوبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/16212360
- "Sodium fluoroacetate"، Immediately Dangerous to Life and Health، المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- Proudfoot AT et al., Sodium fluoroacetate poisoning., in Toxicol Rev, 25/2006, S.213–219, ببمد 17288493.
- بوابة الكيمياء