فينول فثالين
الفينول فيثالين (بالإنكليزية Phenolphthalein) الذي يرمز له بالصيغة الكيميائية C20H14O4 هو دليل يكون عديم اللون في الوسط الحمضي ووردي في الوسط المتعادل وأحمر في الوسط القاعدي
| فينول فثالين | |
|---|---|
| الخواص | |
| الصيغة الجزيئية | C₂₀H₁₄O₄[1] |
| الكثافة | 1.296 غرام لكل سنتيمتر مكعب[2] |
| نقطة الانصهار | 262.5 درجة حرارة مئوية[3]، و260.0 درجة حرارة مئوية[4] |
| نقطة الغليان | 557.8 درجة حرارة مئوية[5] |
| المعرفات | |
| CAS | 77-09-8 |
| بوب كيم | 4764 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| فينول فثالين | |
|---|---|
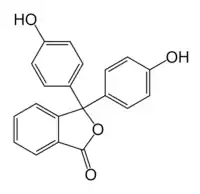 | |
| معلومات عامة | |
| الاسم النظامي | 3,3-بيس(4-هيدروكسي فينيل)
-1(H3)-إيزو بنزو الفورانون |
| أسماء أخرى | فينول فثالين |
| الصيغة الجزيئية | C20H14O4 |
| رقم CAS | [77-09-8] |
| الخواص | |
| الكتلة المولية | 318.323 غ/مول |
| المظهر | مسحوق بلوري عديم اللون |
| الكثافة | 1.28 غ/سم3 |
| الانحلالية في الماء | عملياً غير منحل
9.2 مغ/100 مل ماء عند 20 °س |
| الانحلالية في المحلات الأخرى | ينحل في الإيثانول والإيثر
لا ينحل في البنزن |
| درجة الانصهار | 262.5 °س |
| درجة الغليان | ? °س |
| في حال عدم ذكر الشروط فإن
البيانات الواردة أعلاه مقاسة في الشروط النظامية ومدونة حسب النظام الدولي للوحدات | |
الاستخدامات
كمؤشر
يعتبر أشهر استخدام للفينول فثالين هو كمؤشر في معايرة الأحماض القاعدية. كما أنه يعمل كمكون للمؤشرات العالمية، جنبًا إلى جنب مع أحمر الميثيل، وأزرق البروموثيمول، وأزرق الثيمول.[7]
يعتمد الفينول فثالين على أربع حالات مختلفة في محلول مائي: تحت ظروف حمضية شديدة للغاية، يوجد في شكل بروتوني (HIn +)، مما يعطي لونًا برتقاليًا. بين الحالات الحمضية القوية والظروف الأساسية قليلاً، يكون شكل اللاكتون (HIn) عديم اللون. يمنح شكل الفينول المستخرج بشكل مضاعف (In2-) شكل الأنيون من الفينول ذو اللون المألوف. وفي المحاليل الأساسية القوية، يخضع اللون الوردي للفينول فثالين لرد فعل بطيء إلى حد ما ويصبح عديم اللون تمامًا فوق أس هيدروجيني مقداره 13.0 pH. في بعض الأحيان، يتم استخدام تفاعل الخبو البطيء الذي ينتج عديم اللون In (OH) 3− في الفصول الدراسية لدراسة حركية التفاعل.[8]
| النمط | In | H2In | In2− | In(OH)3− | |
|---|---|---|---|---|---|
| البنية | 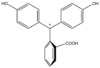 | 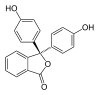 | 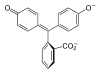 | 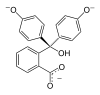 | |
| الشكل الفراغي | 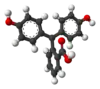 | 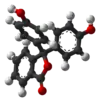 | 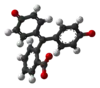 | 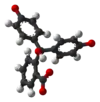 | |
| pH | < 0 | 0 - 8.2 | 8.2 − 12.0 | >12.0 | |
| الوسط | وسط حمضي قوي | حمضي أو قرب المعتدل | قلوي | قلوي قوي | |
| اللون | برتقالي | عديم اللون | زهري إلى لون الفوشيا | عديم اللون | |
| |||||
يتم استغلال حساسية درجة الحموضة في الفينول فثالين في تطبيقات أخرى: الخرسانة لديها درجة الحموضة مرتفعة بشكل طبيعي بسبب هيدروكسيد الكالسيوم فيتكون عندما يتفاعل الأسمنت البورتلاندي مع الماء. عندما تتفاعل الخرسانة مع ثاني أكسيد الكربون في الغلاف الجوي، ينخفض الأس الهيدروجيني إلى 8.5-9. وعندما يتم استخدام محلول الفينول فثالين 1 ٪ على الخرسانة العادية، فإنه يتحول إلى اللون الوردي الزاهي. ومع ذلك، إذا كان لا يزال عديم اللون، فإنه يدل على أن الخرسانة خضعت للكربنة. في تطبيق مشابه، يستخدم الفينول فثالين لإصلاح الثقوب في الحوائط الجافة. وعند استخدامه، تحتفظ مادة التلبيس الأساسية بلون وردي؛ وعندما يتشبع المزيج بالتفاعل مع ثاني أكسيد الكربون في الغلاف الجوي، يتلاشى اللون الوردي.[9]
لتطوير أنماط الشعر المرسومة السحرية، يتم رش الحبر بمحلول هيدروكسيد، مما يؤدي إلى ظهور الرسومات المخفية بنفس الآلية المذكورة أعلاه لتغير اللون في محلول قلوي. سوف يختفي النمط مرة أخرى في النهاية بسبب التفاعل مع ثاني أكسيد الكربون. يستخدم الثيمول فثالين لنفس الغرض وبنفس الطريقة، عندما يكون اللون الأزرق مرغوبًا.[10]

الاستخدام الطبي
استُخدم الفينول لأكثر من قرن بمثابة ملين، ولكن تمت إزالته الآن إزالة من قائمة المسهلات المُدرجة ضمن الأدوية المتاحة بدون وصفة[10] بسبب مخاوف من التسبب في السرطان.[11][12] يعتبر الثيمول فثالين مُلين مرتبط بالفينول فثالين لكنه مصنوع من الثيمول.
على الرغم من المخاوف بشأن مخاطر السرطان المحتملة، واستخدام الفينول كملين، إلا أنه من غير المرجح أن يسبب سرطان المبيض.[13] وقد وجد أن الفينول فثالين يثبط تدفق الكالسيوم الخلوي البشري من خلال دخول الكالسيوم في المخزن ( انظر قناة تنشيط الكالسيوم المنشّطة). ويتأثر هذا من خلال تثبيط الثرومبين والثابيسيجاجين، وهما من المنشطات التي تزيد من تدفق الكالسيوم داخل الخلايا الحرة.[14]
تمت إضافة الفينول فثالين إلى قائمة الوكالة الأوروبية للمواد الكيميائية للمواد المثيرة للقلق ذات الأهمية الشديدة (SVHC).[15]
يستخدم الفينول فثالين في اختبار لتحديد المواد التي يعتقد أنها تحتوي على الدم، والمعروف باسم اختبار كاسل ماير. يتم جمع عينة جافة باستخدام مسحة أو ورق ترشيح. توضع بضع قطرات من الكحول، ثم بضع قطرات من الفينول فثالين، وأخيرًا بضع قطرات من بيروكسيد الهيدروجين على العينة. إذا كانت العينة تحتوي على الهيموغلوبين، فإن لونها سوف يتحول فورًا إلى اللون الوردي عند إضافة البيروكسيد، نظرًا لتوليد الفينول فثالين. يشير الاختبار الإيجابي إلى أن العينة تحتوي على الهيموجلوبين، وبالتالي، من المرجح أن تحتوي العينة على الدم. يمكن أن تنتج نتيجة إيجابية كاذبة عن وجود مواد ذات نشاط تحفيزي مماثل للهيموغلوبين. لا يدمر هذا الاختبار العين، كما يمكن الاحتفاظ بها واستخدامها في اختبارات أخرى. يعطي هذا الاختبار نفس التفاعل مع الدم من أي حيوان، لذلك سيكون هناك حاجة لمزيد من الاختبارات لتحديد ما إذا كان مصدره إنسان.[16]
مراجع
- العنوان : phenolphthalein — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/4764 — تاريخ الاطلاع: 19 نوفمبر 2016 — الرخصة: محتوى حر
- https://www.pentachemicals.eu/soubory/bezpecnostni-listy/fenolftalein.pdf — تاريخ الاطلاع: 15 أغسطس 2020
- العنوان : Phenolphtalein — مُعرِّف مصرف الدواء (DrugBank): https://www.drugbank.ca/r/DB04824 — تاريخ الاطلاع: 13 يونيو 2019 — الرخصة: جميع الحقوق محفوظة
- المؤلف: Jean-Claude Bradley، أنتوني جون وليامز و Andrew S.I.D. Lang — العنوان : Jean-Claude Bradley Open Melting Point Dataset — نشر في: فيغشير — https://dx.doi.org/10.6084/M9.FIGSHARE.1031637.V2 — مُعرِّف مصرف الدواء (DrugBank): https://www.drugbank.ca/r/DB04824
- https://www.chemenu.com/products/CM157263 — تاريخ الاطلاع: 13 يونيو 2019
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/4764
- "Universal Indicator"، ISCID Encyclopedia of Science and Philosophy، مؤرشف من الأصل في 25 سبتمبر 2006.
- US 6531528, Ronald D. Kurp, "Ready to use spackle/repair product containing dryness indicator"
- Toystore نسخة محفوظة 23 مارس 2016 على موقع واي باك مشين.
- Spiller, H. A.؛ Winter, M. L.؛ Weber, J. A.؛ Krenzelok, E. P.؛ Anderson, D. L.؛ Ryan, M. L. (مايو 2003)، "Skin Breakdown and Blisters from Senna-Containing Laxatives in Young Children"، The Annals of Pharmacotherapy، 37 (5): 636–639، doi:10.1345/aph.1C439، PMID 12708936.
- Dunnick, J. K.؛ Hailey, J. R. (1996)، "Phenolphthalein Exposure Causes Multiple Carcinogenic Effects in Experimental Model Systems" (PDF)، Cancer Research، 56 (21): 4922–4926، PMID 8895745، مؤرشف من الأصل (pdf) في 5 يناير 2016.
- Tice, R. R.؛ Furedi-Machacek, M.؛ Satterfield, D.؛ Udumudi, A.؛ Vasquez, M.؛ Dunnick, J. K. (1998)، "Measurement of Micronucleated Erythrocytes and DNA Damage during Chronic Ingestion of Phenolphthalein in Transgenic Female Mice Heterozygous for the p53 Gene"، Environmental and Molecular Mutagenesis، 31 (2): 113–124، doi:10.1002/(SICI)1098-2280(1998)31:2<113::AID-EM3>3.0.CO;2-N، PMID 9544189.
- Cooper, G. S.؛ Longnecker, M. P.؛ Peters, R. K. (2004)، "Ovarian Cancer Risk and Use of Phenolphthalein-Containing Laxatives"، Pharmacoepidemiology and Drug Safety، 13 (1): 35–39، doi:10.1002/pds.824، PMID 14971121.
- Dobrydneva, Y.؛ Wilson, E.؛ Abelt, C. J.؛ Blackmore, P. F. (2009)، "Phenolphthalein as a Prototype Drug for a Group of Structurally Related Calcium Channel Blockers in Human Platelets"، Journal of Cardiovascular Pharmacology، 53 (3): 231–240، doi:10.1097/FJC.0b013e31819b5494، PMID 19247192.
- "Phenolphthalein - Substance Information - ECHA"، echa.europa.eu (باللغة الإنجليزية)، مؤرشف من الأصل في 12 يونيو 2018، اطلع عليه بتاريخ 06 نوفمبر 2017.
- U.S. Patent 2٬522٬939
روابط خارجية
- بوابة صيدلة
- بوابة ألوان
- بوابة الكيمياء
