كلوريد الروثينيوم الثلاثي
كلوريد الروثينيوم الثلاثي (أو ثلاثي كلوريد الروثينيوم) مركب كيميائي له الصيغة RuCl3، ويكون على شكل بلورات بنية إلى سوداء. يوجد منه شكل مائي سداسي الهيدرات RuCl3.6H2O. يعد المركب أهم مركبات الروثينيوم، ومنه يحضر أغلب مركباته.
| كلوريد الروثينيوم الثلاثي[1] | |
|---|---|
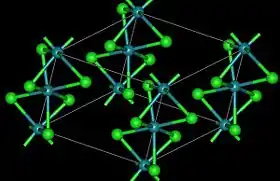 كلوريد الروثينيوم الثلاثي | |
| الاسم النظامي (IUPAC) | |
كلوريد الروثينيوم الثلاثي | |
| أسماء أخرى | |
ثلاثي كلوريد الروثينيوم | |
| المعرفات | |
| رقم CAS | 10049-08-8 13815-94-6 (سداسي هيدرات) |
| بوب كيم (PubChem) | 82323 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | RuCl3 |
| الكتلة المولية | 207.43 غ/مول |
| المظهر | بلورات بنية إلى سوداء |
| الكثافة | 3.11 غ/سم3 |
| نقطة الانصهار | >500 °س يتفكك |
| الذوبانية في الماء | غير منحل |
| المخاطر | |
| ترميز المخاطر |  C C |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخصائص
- إن مركب ثلاثي كلوريد الروثينيوم غير منحل في الماء.
- يوجد شكلين بلوريين لثلاثي كلوريد الروثينيوم، وهما الشكلان ألفا وبيتا. يكون للشكل ألفا α-RuCl3 الأسود بنية مشابهة لبنية كلوريد الكروم الثلاثي، وتبلغ المسافة بين ذرات الروثينيوم Ru-Ru في البلورة 346 بم، في حين أن الشكل بيتا β-RuCl3 البني الغامق يتبلور حسب النمط السداسي، بحيث يشكّل سلاسل طويلة من ثمانيات السطوح المتشاركة بالوجه، تكون المسافة Ru-Ru فيها 283 بم. يتحوّل الشكل بيتا إلى الشكل ألفا بشكل غير عكوس بالتسخين إلى درجات حرارة بين 450–600 °س.
- يتفاعل كلوريد الروثينيوم الثلاثي مع أحادي أكسيد الكربون بشروط معتدلة.[3] بهذا التفاعل يختزل الروثينيوم إلى الروثينيوم الثنائي أصفر اللون، إلا أنه غير ثابت وغالباً ما يحضّر في وسط التفاعل والذي غالباً ما يكون من الإيثانول. باستمرار التعرض لأحادي أكسيد الكربون تتشكل كربونيلات للروثينيوم مثل اثنا عشري كربونيل ثلاثي الروثينيوم:
- 3 RuCl3·xH2O + 4.5 Zn + 12 CO (ضغط مرتفع) → Ru3(CO)12 + 3 H2O + 4.5 ZnCl2
التحضير
يحضّر كلوريد الروثينيوم الثلاثي من تسخين فلز الروثينيوم إلى 700°س تحت جو غازي من مزيج الكلور وأحادي أكسيد الكربون بنسبة 1:4. يحمل الناتج بواسطة الغاز المتدفق ويتبلور بالتبريد.[4]
الاستخدامات
- يعد كلوريد الروثينيوم الثلاثي الأساس لتحضير العديد من مركبات ومعقدات الروثينيوم مثل حفاز غرابز.[5] بالإضافة إلى العديد من المعقدات الأخرى مثل ثنائي كلورو ثلاثي(ثلاثي فينيل فوسفين) الروثينيوم الثنائي RuCl2(PPh3)3 وكلوريد ثلاثي(ثنائي بيريدين) الروثينيوم الثنائي Ru(bipy)3]Cl2].
المراجع
- صفحة بيانات السلامة الكيميائية من Alfa [وصلة مكسورة] نسخة محفوظة 26 مايو 2020 على موقع واي باك مشين.
- العنوان : Ruthenium chloride — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/61850 — تاريخ الاطلاع: 14 أكتوبر 2016 — الرخصة: محتوى حر
- Hill, A. F. (2000)، ""Simple" Ruthenium Carbonyls of Ruthenium: New Avenues from the Hieber Base Reaction"، Angew. Chem. Int. Ed.، 39: 130–134، doi:10.1002/(SICI)1521-3773(20000103)39:1<130::AID-ANIE130>3.0.CO;2-6.
- Remy, H.; Kühn, M. (1924)، "Beiträge zur Chemie der Platinmetalle. V. Thermischer Abbau des Ruthentrichlorids und des Ruthendioxyds"، Z. Anorg. Chem.، 137 (1): 365–388، doi:10.1002/zaac.19241370127.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - P. O. Nubel, C. L. Hunt: A convenient catalyst system employing RuCl3 or RuBr3 for metathesis of acyclic olefins. In: Journal of Molecular Catalysis A: Chemical. 1999, 1455, S. 323-327, دُوِي:10.1016/S1381-1169(99)00150-8.
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.