مستقبلات الأستيل كولين النيكوتينية
مُستَقبِلات الأسِتيل كولين النيكوتينية (بالإنجليزية: Nicotinic acetylcholine receptor)، وتسمى اختصارا nAChRs3 هي مُستقبلِات متعددة البيبتيدات تستجيب للناقل العصبي أستيل كولين. تستجيب مستقبِلات النيكوتين أيضًا لعقاقير مثل ناهض النيكوتين. توجد في الجهاز العصبي المركزي والمحيطي والعضلات والعديد من الأنسجة الأخرى للعديد من الكائنات الحية. عند الموصل العصبي العضلي هُم المُستقبل الأساسي في العضلات للتواصل العضلي العصبي الحركي الذي يتحكم في انقباض العضلات. في الجهاز العصبي المحيطي: (1) ينقلون الإشارات الصادرة من قبل المشبكي إلى الخلايا ما بعد المشبكي داخل الجهاز العصبي الوُدي والجهاز العصبي اللاوُدي. و(2) هم المستقبلات الموجودة في العضلات الهيكلية التي تستقبل الأسيتيل كولين الذي يتم إطلاقه للإشارة إلى الانقباض العضلي. في جهاز المناعة تنظم مستقبلات الأستيل كولين النيكوتينية العمليات الالتهابية والإشارة من خلال مسارات متميزة داخل الخلايا.[1] في الحشرات، يقتصر الجهاز الكوليني على الجهاز العصبي المركزي.[2]
تعتبر مستقبلات النيكوتين مستقبلات كولينية، لأنها تستجيب للأسيتيل كولين. تحصل مستقبلات النيكوتين على اسمها من النيكوتين الذي لا يحفز مستقبلات الأستيل كولين المسكارينية، ولكنه يرتبط بشكل انتقائي بمستقبلات النيكوتين بدلاً من ذلك.[3][4][5] وبالمثل، فإن مستقبل الأسيتيل كولين المسكاريني حصل على اسمه من مادة كيميائية ترتبط بشكل انتقائي بهذا المستقبل - المسكارين.[6] الأسيتيل كولين نفسه يرتبط بمستقبلات الأستيل كولين المسكارينية والنيكوتين.[7]
كمستقبلات شاردية التأثير، ترتبط مستقبلات أسيتيل كولين النيكوتني مباشرة بالقنوات الأيونية. تشير الدلائل الجديدة إلى أن هذه المستقبلات يمكنها أيضًا استخدام ناقل ثانٍ (كما تفعل المستقبلات الأيضية) في بعض الحالات.[8]
نظرًا لأن مستقبلات النيكوتين تساعد في نقل الإشارات الصادرة للجهاز العصبي الوُدي واللاوُدي، فإن مضادات مستقبلات النيكوتين مثل هيكساميثونيوم تتداخل مع إرسال هذه الإشارات. وهكذا، على سبيل المثال: تتداخل مضادات مستقبلات النيكوتين مع المنعكس الضغطي [9] الذي يصحح عادة التغيرات في ضغط الدم عن طريق التحفيز الوُدي واللاوُدي للقلب.
تركيب
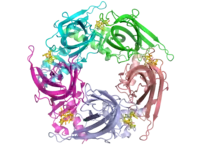
تتكون المستقبلات النيكوتينية التي تبلغ كتلتها الجزيئية 290 كيلودالتون[10] من خمس وحدات فرعية مرتبة بشكل متناظر حول مسام مركزي.[3] وتمتلك أوجه التشابه مع مستقبلات مستقبلات غابا-أ, مستقبلات الجليسين، ومستقبلات السيروتونين نوع 3، ومستقبلات حلقية سيستئين.[11]
في الفقاريات، يتم تصنيف مستقبلات النيكوتين على نطاق واسع إلى نوعين فرعيين على أساس مواقع التعبير الأساسية: مستقبلات النيكوتينية من نوع العضلات، والمستقبلات النيكوتينية من نوع الخلايا العصبية. وتكون الوحدات الفرعية لكلا النوعينين متشابهة جدا مع بعضها البعض، وخاصة في المناطق الكارهة للماء.
وقد وفر المجهر الإلكتروني ودراسات التصوير البلوري بالأشعة السينية معلومات هيكلية عالية الدقة للغاية لمُستَقبلات أسيتيل كولين النيكوتين نوعي العضلات والخلايا العصبية ومجالاتها الملزمة.[10][12][13][14]
الارتباط بالمُستَقبِل
كما هو الحال مع جميع قنوات الأيونات المسورة، فإن فتح مسام قناة مستقبل أسيتيل كولين النيكوتين يتطلب ربط ناقل كيميائي. تستخدم عدة مصطلحات مختلفة للإشارة إلى الجزيئات التي تربط المستقبلات، مثل ربيطة أو ناهض أو ناقل. ناهضات مستقبل أسيتيل كولين النيكوتين تشمل النيكوتين، والكولين. أما المضادات النيكوتينية التي تمنع مستقبلات الميكميلامين، ديهيدرو β-الإريثرويدين، والهيكساميثونيوم.
في مستقبل أسيتيل كولين النيكوتين من نوع العضلات، تقع مواقع الربط أستيل في α وإما ε أو δ واجهة الوحدات الفرعية. أما في مستقبل أسيتيل كولين النيكوتين العصبية، يقع موقع الربط في واجهة α ووحدة فرعية β أو بين اثنين من الوحدات الفرعية α في حالة مستقبلات α7. موقع الربط موجود في المجال خارج الخلية بالقرب من النهاية الأمينية.[4][15] عندما يرتبط ناهض بالموقع، تخضع جميع الوحدات الفرعية الحالية لتغيير تشكيلي ويتم فتح القناة[16] ويفتح مسام قطره حوالي 0.65 نانومتر.[4]
فتح القناة
قد توجد مستقبلات الأسِتيل كولين النيكوتينية في حالات مطابقة مختلفة قابلة للتحويل. يؤدي إرتباط ناهض إلى استقرار الحالات المفتوحة إزالة الحساسة. في الظروف الفسيولوجية العادية، يحتاج المستقبل إلى جزيئين بالضبط من أسيتيل كولين ليفتح.[17] يسمح فتح القناة للأيونات موجبة الشحنة بالتحرك عبرها؛ على وجه الخصوص، يدخل الصوديوم إلى الخلية ويخرج البوتاسيوم. التدفق الصافي للأيونات موجبة الشحنة إلى الداخل.
إن مستقبلات أسيتيل كولين النيكوتين هي قناة كاتيون غير انتقائية، مما يعني أن العديد من الأيونات الموجبة الشحنة يمكن أن تعبر من خلالها.[3] يعني أنها تسمح بمرور أيونات الصوديوم وأيونات البوتاسيوم، وبوجود بعض مجموعات الوحدات الفرعية تصبح أيضًا منفذة لأيونات الكالسيوم.[4][18][19] كمية الصوديوم والبوتاسيوم التي تسمح بها القنوات من خلال مسامها (موصليتها) تختلف من 50-110 pS، مع الموصلية اعتمادًا على تركيبة الوحدة الفرعية المحددة بالإضافة إلى أيون دائم.[20]
يمكن أن تؤثر العديد من مستقبلات أسيتيل كولين النيكوتين العصبية على إطلاق النواقل العصبية الأخرى.[5] عادة ما تفتح القناة بسرعة وتميل إلى أن تظل مفتوحة حتى ينتشر الناهض، والذي عادة ما يستغرق حوالي 1 مللي ثانية.[4] ومع ذلك، يمكن أن تفتح مستقبلات أسيتيل كولين النيكوتين تلقائيًا بدون روابط مرتبطة أو يمكن أن تغلق تلقائيًا بربط الروابط، ويمكن للطفرات في القناة أن تغير احتمالية حدوث أي من الحدثين.[21][16] لذلك، يغير ربط أسيتيل كولين احتمال فتح المسام، والذي يزداد كلما زاد ارتباط أسيتيل كولين.
إن مستقبل أسيتيل كولين النيكوتين غير قادر على ربط أسيتيل كولين عند ارتباطه بأي من السموم العصبية ألفا. ترتبط هذه السموم العصبية بشكل عدائي بإحكام وغير تساهمية مع مستقبلات أسيتيل كولين النيكوتين للعضلات الهيكلية وفي الخلايا العصبية، وبالتالي تمنع عمل أسيتيل كولين في الغشاء بعد المشبكي، مما يثبط تدفق الأيونات ويؤدي إلى الشلل والموت. يحتوي مستقبل أسيتيل كولين النيكوتين على موقعين ملزمين للسموم العصبية لسم الثعبان. ثبت أن التقدم نحو اكتشاف ديناميكيات العمل الملزم لهذه المواقع أمر صعب، على الرغم من أن الدراسات الحديثة باستخدام ديناميكيات الوضع العادي[22] قد ساعدت في التنبؤ بطبيعة كل من آليات الربط لسموم الأفعى وأسيتيل كولين إلى مستقبلات أسيتيل كولين النيكوتين. أظهرت هذه الدراسات أن الحركة الشبيهة بالالتواء الناتجة عن ارتباط أسيتيل كولين هي المسؤولة على الأرجح عن فتح المسام، وأن جزيء أو جزيئين من بنغاروتوكسين-أ (أو غيرها من السموم العصبية طويلة السلسلة) تكفي لوقف هذه الحركة. يبدو أن السموم تعمل على ربط الوحدات الفرعية للمستقبلات المجاورة معًا، مما يمنع الالتواء وبالتالي حركة الفتح.[23]
التأثيرات
تنشيط المستقبلات عن طريق النيكوتين يعدل حالة الخلايا العصبية من خلال آليتين رئيسيتين. من ناحية، تسبب حركة الكاتيونات إزالة الاستقطاب من غشاء البلازما (مما يؤدي إلى إمكانات مثيرة في الخلايا العصبية) مما يؤدي إلى تنشيط قنوات الأيونات ذات بوابات الجهد. من ناحية أخرى، فإن دخول الكالسيوم يعمل إما بشكل مباشر أو غير مباشر على سلاسل مختلفة داخل الخلايا. وهذا يؤدي، على سبيل المثال، إلى تنظيم نشاط بعض الجينات أو إطلاق الناقلات العصبية.
تنظيم المُستقبل
إبطال حساسية المُستقبِل
غالبًا ما يؤدي التعرض المطول أو المتكرر للمنبهات إلى انخفاض استجابة هذا المستقبل تجاه المنبه، وهو ما يُطلق عليه إزالة التحسس. يمكن تعديل وظيفة مستقبل أسيتيل كولين النيكوتين عن طريق الفسفرة [24] عن طريق تنشيط كينازات البروتين المعتمدة على المرسل الثاني. تم إثبات أن بروتين كيناز ألفا[25] وبروتين كيناز ج،[26] بالإضافة إلى كينازات التيروزين،[27] تعمل على فسفرة مستقبل أسيتيل كولين النيكوتين مما يؤدي إلى إزالة تحسسها. تم الإبلاغ عن أنه بعد التعرض الطويل للمستقبل للناهض، يتسبب الناهض نفسه في حدوث تغيير في تكوين المستقبِلات ناتج عن ناهض، مما يؤدي إلى إزالة حساسية المستقبل.[28]
الأدوار
تنتمي الوحدات الفرعية لمستقبلات النيكوتين إلى عائلة متعددة الجينات (16 عضوًا في البشر) وينتج عن تجميع مجموعات من الوحدات الفرعية عددًا كبيرًا من المستقبلات المختلفة . هذه المستقبلات، ذات الخصائص الحركية والفسيولوجية الكهربية والدوائية شديدة التغير تستجيب للنيكوتين بشكل مختلف، بتركيزات فعالة مختلفة جدًا. يتيح لهم هذا التنوع الوظيفي المشاركة في نوعين رئيسيين من النقل العصبي. يتضمن النقل المتشابك الكلاسيكي (نقل الأسلاك) إطلاق تركيزات عالية من الناقل العصبي، والذي يعمل على المستقبلات المجاورة مباشرة. في المقابل، يتضمن انتقال تأشير النظير الصماوي (النقل الحجمي) نواقل عصبية تطلقها محطات محوار، والتي تنتشر بعد ذلك عبر الوسط خارج الخلية حتى تصل إلى مستقبلاتها، والتي قد تكون بعيدة.[29] يمكن أيضًا العثور على مستقبلات النيكوتين في مواقع متشابكة مختلفة؛ على سبيل المثال، يعمل مستقبل النيكوتين العضلي دائمًا بعد التشابك العصبي. يمكن العثور على الأشكال العصبية للمستقبلات بعد التشابك العصبي (المشاركة في النقل العصبي الكلاسيكي) وقبل التشابك العصبي[30] حيث يمكن أن تؤثر على إطلاق العديد من النواقل العصبية.
الوحدات الفرعية
في الفقاريات تم تحديد 17 وحدة فرعية لمستقبلات أسيتيل كولين النيكوتين، والتي تنقسم إلى وحدات فرعية من النوع العضلي والنوع العصبي. ومع ذلك، على الرغم من وجود وحدة فرعية أ8 في أنواع الطيور مثل الدجاج، إلا أنها غير موجودة في الأنواع البشرية أو الثدييات.[31]
تم تقسيم الوحدات الفرعية لمستقبلات أسيتيل كولين النيكوتين إلى 4 عائلات فرعية (I-IV) بناءً على أوجه التشابه في تسلسل البروتين.[32] بالإضافة إلى ذلك، تم تقسيم الفصيلة الفرعية الثالثة إلى 3 أنواع.
| النوع العصبي | النوع العضلي | ||||
| I | II | III | IV | ||
|---|---|---|---|---|---|
| α9، α10 | α7، α8 | 1 | 2 | 3 | α1، β1، δ، γ، ε |
| α2، α3، α4، α6 | β2، β4 | β3، α5 | |||
انظر أيضاً
المراجع
- "α7 nicotinic acetylcholine receptor signaling inhibits inflammasome activation by preventing mitochondrial DNA release"، Molecular Medicine، 20 (1): 350–8، أغسطس 2014، doi:10.2119/molmed.2013.00117، PMC 4153835، PMID 24849809.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - Yamamoto (1999)، "Nicotine to Nicotinoids: 1962 to 1997"، Nicotinoid Insecticides and the Nicotinic Acetylcholine Receptor، ص. 3–27، doi:10.1007/978-4-431-67933-2_1، ISBN 978-4-431-68011-6.
- Purves, Augustine, Fitzpatrick, Hall, LaMantia, McNamara, White (2008)، Neuroscience (ط. 4th)، Sinauer Associates، ص. 122–6، ISBN 978-0-87893-697-7، مؤرشف من الأصل في 5 أغسطس 2020.
- "Basic Neurochemistry: Molecular, Cellular and Medical Aspects"، GABA Receptor Physiology and Pharmacology (ط. 6th)، American Society for Neurochemistry، 1999، مؤرشف من الأصل في 12 مايو 2009، اطلع عليه بتاريخ 01 أكتوبر 2008.
- "Neuronal nicotinic receptors: from protein structure to function"، FEBS Letters، 504 (3): 118–25، أغسطس 2001، doi:10.1016/s0014-5793(01)02702-8، PMID 11532443.
- "Muscarinic acetylcholine receptors"، Current Pharmaceutical Design، 12 (28): 3573–81، 01 أكتوبر 2006، doi:10.2174/138161206778522056، PMID 17073660.
- Lott, Jones (2020)، "Cholinergic Toxicity"، StatPearls، StatPearls Publishing، PMID 30969605، مؤرشف من الأصل في 23 مارس 2021.
- "Are nicotinic acetylcholine receptors coupled to G proteins?"، BioEssays، 35 (12): 1025–34، ديسمبر 2013، doi:10.1002/bies.201300082، PMID 24185813، S2CID 9441100، مؤرشف من الأصل في 17 يناير 2022.
- "Effect of cholinergic antagonists on sympathetic ganglionic transmission of vasomotor reflexes from the carotid baroreceptors and chemoreceptors of the dog."، The Journal of Physiology، 277 (1): 379–385، أبريل 1978، doi:10.1113/jphysiol.1978.sp012278، PMC 1282395، PMID 206690.
- "Refined structure of the nicotinic acetylcholine receptor at 4A resolution"، Journal of Molecular Biology، 346 (4): 967–89، مارس 2005، doi:10.1016/j.jmb.2004.12.031، PMID 15701510.
- "Structure and function of the glycine receptor and related nicotinicoid receptors"، The Journal of Biological Chemistry، 279 (19): 19383–6، مايو 2004، doi:10.1074/jbc.R300035200، PMID 15023997.
- "Crystal structure of an ACh-binding protein reveals the ligand-binding domain of nicotinic receptors"، Nature، 411 (6835): 269–76، مايو 2001، Bibcode:2001Natur.411..269B، doi:10.1038/35077011، PMID 11357122، S2CID 4415937، مؤرشف من الأصل في 18 يناير 2022.
- "Crystal structures of free and antagonist-bound states of human α9 nicotinic receptor extracellular domain"، Nature Structural & Molecular Biology، 21 (11): 976–80، نوفمبر 2014، doi:10.1038/nsmb.2900، PMID 25282151، S2CID 30096256، مؤرشف من الأصل في 17 يناير 2022.
- "X-ray structure of the human α4β2 nicotinic receptor"، Nature، 538 (7625): 411–415، أكتوبر 2016، Bibcode:2016Natur.538..411M، doi:10.1038/nature19785، PMC 5161573، PMID 27698419.
- Squire L (2003)، Fundamental neuroscience (ط. 2nd)، Amsterdam: Acad. Press، ص. 1426، ISBN 978-0-12-660303-3.
- "Function and structure in glycine receptors and some of their relatives"، Trends in Neurosciences، 27 (6): 337–44، يونيو 2004، CiteSeerX 10.1.1.385.3809، doi:10.1016/j.tins.2004.04.010، PMID 15165738، S2CID 19008547.
- Aidley DJ (1998)، The physiology of excitable cells (ط. 4th)، Cambridge, UK: Cambridge University Press، ISBN 978-0521574150، OCLC 38067558.[بحاجة لرقم الصفحة]
- "Muscarinic and nicotinic ACh receptor activation differentially mobilize Ca2+ in rat intracardiac ganglion neurons"، Journal of Neurophysiology، 90 (3): 1956–64، سبتمبر 2003، doi:10.1152/jn.01079.2002، PMID 12761283، S2CID 8684707، مؤرشف من الأصل في 8 فبراير 2020.
- "Intravenous anesthetics inhibit nicotinic acetylcholine receptor-mediated currents and Ca2+ transients in rat intracardiac ganglion neurons"، British Journal of Pharmacology، 144 (1): 98–107، يناير 2005، doi:10.1038/sj.bjp.0705942، PMC 1575970، PMID 15644873.
- "Molecular distinction between fetal and adult forms of muscle acetylcholine receptor"، Nature، 321 (6068): 406–11، مايو 1986، Bibcode:1986Natur.321..406M، doi:10.1038/321406a0، PMID 2423878، S2CID 4356336، مؤرشف من الأصل في 4 فبراير 2020.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - "Monod-Wyman-Changeux Analysis of Ligand-Gated Ion Channel Mutants"، The Journal of Physical Chemistry B، 121 (15): 3813–3824، أبريل 2017، arXiv:1701.06122، Bibcode:2017arXiv170106122E، doi:10.1021/acs.jpcb.6b12672، PMC 5551692، PMID 28134524.
- "Protein normal-mode dynamics: trypsin inhibitor, crambin, ribonuclease and lysozyme"، Journal of Molecular Biology، 181 (3): 423–47، فبراير 1985، doi:10.1016/0022-2836(85)90230-x، PMID 2580101.
- "Inhibition mechanism of the acetylcholine receptor by alpha-neurotoxins as revealed by normal-mode dynamics"، Biochemistry، 47 (13): 4065–70، أبريل 2008، doi:10.1021/bi702272j، PMC 2750825، PMID 18327915.
- "cAMP-dependent protein kinase phosphorylates the nicotinic acetylcholine receptor"، Proceedings of the National Academy of Sciences of the United States of America، 80 (4): 1130–4، فبراير 1983، Bibcode:1983PNAS...80.1130H، doi:10.1073/pnas.80.4.1130، PMC 393542، PMID 6302672.
- "Nicotinic acetylcholine receptor desensitization is regulated by activation-induced extracellular adenosine accumulation"، The Journal of Neuroscience، 12 (11): 4540–4، نوفمبر 1992، doi:10.1523/JNEUROSCI.12-11-04540.1992، PMC 6576003، PMID 1331363.
- "Phosphorylation of the acetylcholine receptor by protein kinase C and identification of the phosphorylation site within the receptor delta subunit"، The Journal of Biological Chemistry، 262 (22): 10506–10، أغسطس 1987، doi:10.1016/S0021-9258(18)60990-1، PMID 3038884، مؤرشف من الأصل في 24 أبريل 2005.
- "Functional modulation of the nicotinic acetylcholine receptor by tyrosine phosphorylation"، Nature، 336 (6200): 677–80، ديسمبر 1988، Bibcode:1988Natur.336..677H، doi:10.1038/336677a0، PMID 3200319، S2CID 4239105، مؤرشف من الأصل في 17 يناير 2022.
- "Agonist-mediated changes of the acetylcholine receptor in its membrane environment"، Journal of Molecular Biology، 124 (1): 1–26، سبتمبر 1978، doi:10.1016/0022-2836(78)90144-4، PMID 712829.
- "Acetylcholine as a neuromodulator: cholinergic signaling shapes nervous system function and behavior"، Neuron، 76 (1): 116–29، أكتوبر 2012، doi:10.1016/j.neuron.2012.08.036، PMC 3466476، PMID 23040810.
- "Presynaptic nicotinic ACh receptors"، Trends in Neurosciences، 20 (2): 92–8، فبراير 1997، doi:10.1016/S0166-2236(96)10073-4، PMID 9023878، S2CID 42215860، مؤرشف من الأصل في 8 نوفمبر 2021.
- "Immunohistochemical localization of nicotinic acetylcholine receptor subunits in human cerebellum"، Neuroscience، 113 (3): 493–507، 2002، doi:10.1016/S0306-4522(02)00223-3، PMID 12150770، S2CID 39839166، مؤرشف من الأصل في 4 فبراير 2020.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - "Molecular evolution of the nicotinic acetylcholine receptor: an example of multigene family in excitable cells"، Journal of Molecular Evolution، 40 (2): 155–72، فبراير 1995، Bibcode:1995JMolE..40..155L، doi:10.1007/BF00167110، PMID 7699721، S2CID 2040912، مؤرشف من الأصل في 4 فبراير 2020.
- بوابة علم وظائف الأعضاء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علوم عصبية
- بوابة طب