ميكانيكا الليبيد ثنائي الطبقة
تمثل ميكانيكا الدهن ثنائي الطبقة (بالإنجليزية: Lipid bilayer mechanics) علم دراسة خصائص المادة الفيزيائية لطبقات الليبيد الثنائية (بالإنجليزية: lipid bilayer)، المتمثل في تصنيف سلوك الطبقة الثنائية مع كلٍ من الضغط و الإجهاد بدلاً من التفاعلات الكيميائية الحيوية. وغالباً ما تتميز تلك الخصائص في حدود ثلاثة معالمٍ ميكانيكيةٍ: معامل منطقة الضغط Ka، معامل الدمج Kb، وطاقة الحافة . وبالنسبة لطبقات الموائع الثنائية (بالإنجليزية: fluid bilayers)، يكون معامل القص (بالإنجليزية: shear modulus) بالتحديد صفر، حيث أن إعادة الترتيب الحر للجزيئات ضمن الخطة (بالإنجليزية: Plane) يعني أن الهيكل لن يدعم إجهادات القص. تؤثر تلك الخصائص الميكانيكية على العديد من العمليات الحيوية التي تتوسط الغشاء الحيوي. وعلى الأخص، تؤثر قيم Ka و Kb على قدرة البروتينات والجزيئات الصغيرة على الاندماج داخل الطقبة الثنائية.[1][2] هذا وقد تم توضيح كذلك أن الخصائص الميكانيكية للطبقة الثنائية تغير وظيفة القنوات الشاردية المنشطة ميكانيكياً.[3]
معامل ضغط المساحة
انظر أيضاً: معامل المرونة الطولي
نتيجة أن طبقات الدهن الثنائية تتسم بأنها أساساً هياكلٌ ثنائية الأبعاد، فإن Ka غالباً ما يتم تحديده داخل الخطة (بالإنجليزية: Plane) فقط. وحدسياً، قد يتوقع المرء أن هذا المعامل سيتغير خطياً مع سماكة الطبقة الثنائية كما سيكون عليه الحال بالنسبة لصفيحة المادة المتماثلة (بالإنجليزية: isotropic) الرقيقة. إلا أنه في الواقع ليس هذا بالوضع وأن Ka يكون معتمداً بصورةٍ أضعف على سماكة الطبقة الثنائية. ويرجع السبب وراء هذا إلى أن الدهن في طبقة المائع الثنائية يُعاد ترتيبها بسهولة ولذلك، وعلى عكس المادة الصلبة حيث تأتي المقاومة للتمدد من الروابط البينجزيئية، فمقاومة التمدد في الطبقة الثنائية هي نتيجة منطقة إضافية كاره للماء معرضةً للماء بصرف النظر عن سحب الدهون.[4] وبناءً على هذا التفهم، فالتقريب الجيد الأوليّ للـ Ka للطبقة الأحادية هو 2γ، في حين تمثل جاما التوتر السطحي لواجهة تفاعل الماء- الليبيد (الدهن). كما أن جاما غالباً ما تتراوح بين 20- 50 mJ/m2.[5] هذا ومن الضروري ضرب قيمة الطبقة الأحادية في إثنين لحساب Ka للطبقة الثنائية، وذلك نتيجة أن الطبقة الثنائية تتكون من وريقتين أحاديتي الطبقة. وبناءً على هذا الحساب، فيجب أن يترواح تقدير Ka لطبقة الليبيد الثنائية من 80- إلى 200 mN/m (ملحوظة: N/m معادل لـ mJ/m2). كما أنه ليس من المدهش أن يتم إضافة إلى هذا التفهم للقوى المدرجة أن الدراسات قد أظهرت أن Ka تتنوع بقوة مع شروط أو ظروف المحلول [6] ولكن بصورةٍ ضعيفةٍ مع طول الذيل وعدم التشبع.[7]
ومن الصعب قياس معامل الضغط تجريبياً بسبب الطبيعة الهشة الرقيقة للطبقات الثنائية وكذلك بسبب القوى المدرجة المنخفضة تباعاً. وإحدى السبل المستخدمة تمثلت في دراسة كيفية انتفاخ الحويصلات استجابةً للجهد التنافذي (التناضحي) (بالإنجليزية: Osmotic stress). إلا أن تلك الطريقة، على الرغم من ذلك، تتسم بأنها غير مباشرةٍ، كما أن المقاييس قد يحدث بها ارتباكٍ بسبب التشتت المتعدد في حجم الحويصلة.[8] كما أن طريقة بزل الببتيد (بالإنجليزية: pipette aspiration) تُعَدُ من أكثر الطرق المباشرة المستخدمة لقياس Ka، والتي فيها يتم الإمساك بحويصلة أحادية الصفيحة عملاقة (بالإنجليزية: giant unilamellar vesicle) تمديدها باستخدام جهاز الميكروببتيد (بالإنجليزية: micropipette).[9] هذا ويستخدم مجهر الطاقة الذرية في وقتنا هذا في تحسس واستكشاف الخصائص الآلية الميكانيكية للأغشية ثنائية الطبقة المعلقة [10] ، إلا أن تلك الطريقة ما زالت في طور التجريب.
إلا أن أحد صور القلق المرتبطة بتلك الطرق يتمثل في أنه بما أن الطبقة الثنائية هي هيكلٌ مرنٌ، فتتواجد مجموعة من التقلبات الحرارية الكبيرة في الغشاء على مستوى العديد من مقاييس الطول التي تصل إلى الميكروسكوبية الثانوية. ومن ثم، فإن القوى المطبقة مبدئياً للغشاء غير المضغوط لا تغير فعلياً حزمة الدهن (ليبد) ولكنها بدلاً من ذلك «تذيل» التموجات، مما يؤدي إلى وجود قيمٍ خاطئةٍ للخصائص الميكانيكية. [7][11] ما يدعو إلى أن يكون هذا مصدراً واضحاً للخطأ. فبدون التصحيح الحراري، تكون قيم Ka في الغالب 100-150 mN/m وباستخدام التصحيح الحراري قد يؤدي هذا إلى تغيير تلك القيم إلى 220-270 mN/m.
معامل الدمج
انظر أيضاً: جائز
يُعَّرف معامل الربط على أنه الطاقة المطلوبة لتشويه غشاءٍ من انحنائه الجوهري الداخلي إلى بعض صور الانحناءات الأخرى. وبالنسبة للطبقة الثنائية المثالية، فإن الانحناء الجوهري الداخلي لها هو صفر، ومن ثم فهذا التعبير يتم تبسيطه. كما يرتبط معامل الربط، معامل الضغط وسماكة الطبقة الثنائية بواسطة ومثل هذا في حالة إذا كان إثنين من هذه العوامل معلوم، فيمكن حينئذٍ حساب الآخر. حيث تُشتق تلك العلاقة من واقع أنه لربط الوجه الداخلي يجب أن يتم ضغطه، وأن الوجه الخارجي يجب أن يتم امتداده.[4] فكلما زادت سماكة الغشاء، كلما زادت درجة تشوه كل وجه لاستيعاب انحناءٍ متوفرٍ (انظر: لحظة الربط (بالإنجليزية: bending moment)). وقد تم حساب العديد من قيم Ka في الأدبيات من قيم Kb وt التي تم قياسها تجريبياً. ونلاحظ أن مثل تلك العلاقة لا تحمل سوى بعض التشوهات الصغيرة فقط، إلا أن هذا يُعَدُ بصورةٍ عامةٍ تقريباً جيداً حيث أن أغلبية طبقات الدهن (ليبيد) الثنائية لها القدرة على دعم نسبة إجهادٍ قليلةٍ قبيل تمزيقها.[12]
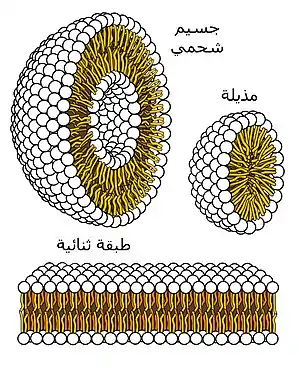
الانحناء
يُعَّرف مصطلح «ليبيد» أو الدهون بصورةٍ واسعةٍ على أنه جزيئ عضوي ويكون أكثر قابليةٍ للزوبان في الزيوت عن المياه، إلا أن فئاتٍ معينةٍ من الدهون (الليبيدات) هي من تشكل الطبقات الثنائية. هذا ويحكم عاملين إثنين بصورةٍ أساسيةٍ ما إذا كان الليبيد سيشكل طبقةً ثنائيةً أم لا: وهما يتمثلان في القابلية للانحلال والشكل. حيث يجب في حالة الهياكل ذاتية التجمع مثل الطبقة الثنائية لتتشكل، أن تكون للدهن (الليبيد) قابلية منخفضة للزوبان في المياه، والتي يمكن وصفها كذلك على أنها تركيز المذيل الحرج (بالإنجليزية: critical micelle concentration). [5] وستتجمع الجزيئات فوق تركيزات المذيل الحرجة (CMC) مشكلةً هياكلٍ أضخم منها الطبقات الثنائية، المذيلات (بالإنجليزية: micelle) أو المذيلات المقلوبة (بالإنجليزية: inverted micelles).
مع ملاحظة أن أكثر عاملٍ أساسيٍ يتحكم في منح الهيكل أشكال الدهن يتمثل في الشكل (للتوضيح؛ الانحناء الداخلي).[4] ويُعَّرف الانحناء الداخلي بواسطة نسبة قطر رأس المجموعة لذلك القطر الخاص بذيل المجموعة. حيث أنه في حالة دهون فوسفاتيد الكولين ثنائي الذيل (بالإنجليزية: Phosphatidylcholine)، فإن هذه النسبة تكون تقريباً واحدة، ومن ثم يكون قيمة الانحناء الداخلي صفر. في حين تكون المجموعات الرئيسية الأخرى ومنها فوسفاتيديل سيرين (بالإنجليزية: Phosphatidylserine) وفوسفاتيديل إيثانولامين (بالإنجليزية: Phosphatidylethanolamine) أصغر حجماً، ومن ثم فلدهون الدياسل (بالإنجليزية: diacyl) الثنائية انحناء داخلي سلبي. كما تميل الليسوليبدات (بالإنجليزية: Lysolipid) إلى أن يكون لها انحناءٌ تلقائيٌ إيجابيٌ بسبب أن لها سلسلة ألكيل بدلاً من سلسلتين في منطقة الذيل. فلو كان لليبيدٍ معينٍ انحرافٌ أضخم كثيراً من انحناءٍ داخليٍ بقيمة الصفر، فلن تتشكل الطبقة الثنائية.
طاقة الحافة

تمثل طاقة الحافي الطاقة الموجودة في كل طول وحدة لحافةٍ حرةٍ مصتلةٍ بالماء. ويمكن اعتبار هذا العمل المطلوب لإنتاج ثقب في الطبقة الثنائية لطول الوحدة L. ويتمثل مصدر تلك الطاقي في الحقيقة الكامنة أن إنتاج مثل ذلك التفاعل تكشف بعضاً من ذيول الدهون للماء، وهذا يعتبر بالأمر غير المرغوب. هذا وتعابر عاملاً آخراً في الظاهرة الحيوية حيث أنها تنظم الخصائص ذاتية التداوي والشفاء للطبقة الثنائية إثر تعرض غشاء الخلية لانثقابٍ ميكانيكي أو تثقيبٍ كهربائيٍ.[9] إلا أن تلك الصفة تتسم لسوء الحظ بأنه يصعب قياسها تجريبياً وكذلك حسابها. حيث أن من الصعاب الرئيسية التي تواجه عملية الحساب تتمثل في أن الخصائص التركيبية لهذه الحافة غير معلومة. مما يجعل النموذج الأمثل هو ألا تكون هناك شحنة في إتجاه الطبقة الثنائية، ومثال ذلك يعني أنه يتم الكشف عن الطول الكامل للذيل. ويُعَدُ هذا بالتعديل العالي للطاقة، ولاستقرار تلك الحافة، فمن الشائع أن يتم إعادة ترتيب بعض الدهون لمجموعاتها الرئيسية لتبرز في حدود مقوسة. مع ملاحظة أن الحد الذي يصل إليه هذا الأمر غير معلومٍ حتى وقتنا هذا، مع وجود بعض الأدلة أن كلاً من الثقوب أو المسام الكارهة للمياه (أذيلٍ مستقيمةٍ) والجاذبة للمياه (رؤوسٍ مقوسةٍ دائرياً) قد تتواجدان معاً.[13]
المصادر
- M. L. Garcia."Ion channels: Gate expectations." Nature. 430. (2004) 153-155.
- T. J. McIntosh and S. A. Simon."Roles of Bilayer Material Properties in Function and Distribution of Membrane Proteins." Annu. Rev. Biophys. Biomol. Struct. 35. (2006) 177–198.
- T. M. Suchyna, S. E. Tape, R. E. Koeppe, O. S. Andersen, F. Sachs and P. A. Gottlieb."Bilayer-dependent inhibition of mechanosensitive channels by neuroactive peptide enantiomers." Nature. 6996. (2004) 235-240.
- D. Boal, "Mechanics of the Cell". 2002, Cambridge, UK: Cambridge University Press.
- Israelachvili, J., Intermolecular and Surface Forces. 2nd ed. 2002: Academic Press.
- C. A. Rutkowski, L. M. Williams, T. H. Haines and H. Z. Cummins."The elasticity of synthetic phospholipid vesicles obtained by photon correlation spectroscopy." Biochemistry. 30. (1991) 5688-5696.
- W. Rawicz, K. C. Olbrich, T. McIntosh, D. Needham and E. Evans."Effect of chain length and unsaturation on elasticity of lipid bilayers." Biophysical Journal. 79. (2000) 328-39.
- Rutkowski, C.A., L.M. Williams, T.H. Haines, and H.Z. Cummins. "The elasticity of synthetic phospholipid vesicles obtained by photon correlation spectroscopy." Biochemistry. (1991). 30. 5688-5696.
- E. Evans, V. Heinrich, F. Ludwig and W. Rawicz."Dynamic tension spectroscopy and strength of biomembranes." Biophysical Journal. 85. (2003) 2342-2350.
- S. Steltenkamp, M. M. Muller, M. Deserno, C. Hennesthal, C. Steinem and A. Janshoff."Mechanical properties of pore-spanning lipid bilayers probed by atomic force microscopy." Biophysical Journal. 91. (2006) 217-226.
- Rawicz, W., K.C. Olbrich, T. McIntosh, et al. "Effect of chain length and unsaturation on elasticity of lipid bilayers." Biophysical Journal. (2000). 79. 328-39.
- F. R. Hallett, J. Marsh, B. G. Nickel and J. M. Wood."Mechanical properties of vesicles: II A model for osmotic swelling and lysis." Biophysical Journal. 64. (1993) 435-442.
- J. C. Weaver and Y. A. Chizmadzhev."Theory of electroporation: A review " Biochemistry and Bioenergetics. 41. (1996) 135-160.
- بوابة علم الأحياء