نخر
التنخر هو أحد أشكال النخر، أو موت الخلايا الالتهابي. يرتبط النخر بموت الخلايا غير المبرمج الناتج عن التلف الخلوي من قبل مسببات الأمراض، وذلك على العكس من موت الخلية المنظم والمبرمج. أظهر اكتشاف آلية التنخر أن الخلايا يمكنها تنفيذ النخر بطريقة مبرمجة وأن موت الخلايا المبرمج ليس دائمًا الشكل المفضل لموت الخلايا. بالإضافة إلى ذلك، فإن الطبيعة المناعية للنخر تفضل حدوثه في ظروف معينة، مثل المساعدة في الدفاع ضد مسببات الأمراض من قبل جهاز المناعة. يُعرَّف التنخر على أنه آلية دفاع فيروسي، ما يسمح للخلية بالخضوع للانتحار الخلوي بطريقة مستقلة عن الكاسبيز (إنزيمات السيستين اسبارتك بروتييز) في وجود مثبطات الكاسبيز الفيروسية لتقييد تكاثر الفيروس. وبالإضافة إلى كونه استجابة للمرض، يُوصف التنخر أيضًا بأنه أحد مكونات الأمراض الالتهابية، مثل: داء كرون والتهاب البنكرياس واحتشاء العضلة القلبية.[1][2]
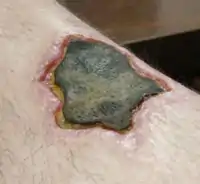
الوظيفة
يعد التنخر خاصًا بالفقاريات وقد يكون مبدئيًا كدفاع إضافي لمسببات الأمراض. يعمل التنخر أيضًا كمسار بديل لموت الخلايا في الحالات التي تكون فيها غير قادرة على الخضوع لموت الخلايا المبرمج، مثل العدوى الفيروسية التي يحجب فيها الفيروس البروتينات الخاصة بإشارات موت الخلايا المبرمج.[3][4]
في المناعة الفطرية
يُعتبر موت الخلية وسيلة فعالة لوقف انتشار العامل الممرض. في استجابة موت الخلايا المبرمج للعدوى، تحتوى مكونات الخلية المصابة (بما في ذلك العامل الممرض) وتُبتلع بالبلعمة. بعض العوامل المسببة للأمراض، مثل: الفيروس المضخم للخلايا البشرية، تعبر عن مثبطات الكاسبيز التي توقف آلية موت الخلايا المبرمج للخلية المضيفة. تسمح استقلالية الكاسبيز للنخر للخلية بتجاوز مرحلة تنشيط الكاسبيز، ما يقلل من الوقت الذي يمكن فيه للعامل الممرض أن يعيش ضمن الخلية.[5]
يمكن للمستقبلات الشبيهة بالتول (تراكيب بروتينية تنتمي إلى المناعة الطبيعية) أيضًا أن ترسل إشارات تؤدي إلى التنخر. هذه المستقبلات هي فئة من المستقبلات التي تعمل في الجهاز المناعي الفطري للتعرف على المكونات المحفوظة لمسببات الأمراض، مثل: فلاجيلين.
النقيض من موت الخلايا المبرمج
في موت الخلايا المبرمج، تؤدي الإشارات الخارجية عبر مستقبلات سطح الخلية أو الإشارات الداخلية عن طريق إطلاق سيتوكروم سي من الميتوكوندريا إلى تنشيط الكاسبيز. ينتهي التحلل للبروتين داخل الخلية بتعبئة بقايا الخلية في أجسام موت الخلايا المبرمج، والتي تتحلل ويعاد تدويرها عن طريق البلعمة. على عكس موت الخلايا المبرمج، فإن التنخر والنخر لا ينطويان على تنشيط الكاسبيز. يبلغ موت الخلايا ذروته عند تسرب محتويات الخلية إلى الفضاء خارج الخلية، على عكس التخلص المنظم للمحتويات الخلوية في أجسام موت الخلايا المبرمج.
أهميته من الناحية الطبية
ينتج التنخر في العديد من الأمراض التي يحدث قيها تلف الأنسجة الحاد الشديد، بما في ذلك احتشاء العضلة القلبية والسكتة الدماغية ونقص التروية. بالإضافة إلى ذلك، لوحظ أن التنخر يساهم في تصلب الشرايين والتهاب البنكرياس وأمراض التهابات الأمعاء والتنكس العصبي وبعض أنواع السرطان.
في زراعة الأعضاء، يمكن أن يحدث نقص في التروية وذلك عند ضعف عودة الدم إلى الأنسجة لأول مرة عند المتلقي. يعد عامل تنشيط التنخر المساهم الرئيسي في تلف الأنسجة، والذي يمكن أن يساهم في كل من التنخر وانتقال نفاذية الميتوكوندريا. يكون العلاج باستخدام عقار السيكلوسبورين، الذي يثبط المؤثر الانتقالي لنفاذية الميتوكوندريا، أما سيكلوفيلين دي، فهو يحسن من بقاء الأنسجة بشكل أساسي عن طريق تثبيط موت الخلايا النخرية، بدلاً من وظيفتها الإضافية في تثبيط المناعة.
مراجع
- Nirmala GJ and Lopus M (2020) Cell death mechanisms in eukaryotes. Cell Biol Toxicol, 36, 145–164. doi: /10.1007/s10565-019-09496-2. PMID 31820165
- "Regulated necrosis: the expanding network of non-apoptotic cell death pathways"، Nature Reviews. Molecular Cell Biology، 15 (2): 135–47، فبراير 2014، doi:10.1038/nrm3737، PMID 24452471.
- "Caspase-8 regulates TNF-α-induced epithelial necroptosis and terminal ileitis"، Nature، 477 (7364): 335–9، سبتمبر 2011، doi:10.1038/nature10400، PMC 3373730، PMID 21921917.
- "Necroptosis"، The New England Journal of Medicine، 370 (5): 455–65، يناير 2014، doi:10.1056/nejmra1310050، PMC 4035222، PMID 24476434.
- "A plug release mechanism for membrane permeation by MLKL"، Structure، 22 (10): 1489–500، أكتوبر 2014، doi:10.1016/j.str.2014.07.014، PMC 4192069، PMID 25220470.
- بوابة موت
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي