نظائر الهيدروجين
لدى الهيدروجين (H) (الكتلة الذرية القياسية 1.00794 دالتون) ثلاث نظائر متوفرة طبيعياً وهي 1H و 2H و 3H. أكثر نظير مشع ثابت للهيدروجين هو 3H وله عمر نصف مقداره 12.32 سنة. هنالك نظائر أخرى أثقل (4H إلى 7H)ولكنها غير ثابتة بالمرة (عمر النصف لها أقل من زبتو ثانية (10−21 من الثانية) ومصنعة فقط مخبرياً. من هذه النظائر الثقيلة، يعد 5H أكثرها ثباتاً، أما أقلها فهو 7H.[1][2]
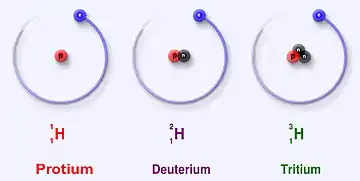
يعد الهيدروجين العنصر الكيميائي الوحيد الذي تختلف أسماء نظائره، حيث أن نظائر العناصر الأخرى تميز عن بعضها بعدد الكتلة الموافق. يسمّى النظير هيدروجين-2 ديوتيريوم، في حين أن النظير هيدروجين-3 يسمّى تريتيوم. النظير الشائع للهيدروجين وهو هيدروجين-1، والذي لا يحوي نيوترونات، يدعى بروتيوم.

هيدروجين-1 (بروتيوم)
يعد 1H أكثر نظائر الهيدروجين شيوعاً وله وفرة تفوق 99.98%. سمّي هذا النظير بالبروتيوم لأن نواته تتكون من بروتون وحيد، لكن هذه التسمية غير شائعة.
لم يلاحظ حدوث اضمحلال شعاعي للهيدروجين-1، لذلك فهو نظير مستقر ثابت.
هيدروجين-2 (الديوتيريوم)
إن 2H هو النظير الآخر المستقر للهيدروجين ويعرف باسم الديوتيريوم وتتألف نواته من بروتون واحد ومن نيوترون واحد.
إن الدويتيريوم ليس نظيراً مشعاً، وليس لديه أي سميّة. يدعى الماء المثرى بجزيئات تحوي الدويتيريوم بدل الهيدروجين (البروتيوم) بالماء الثقيل. يستخدم الديوتيريوم ومركباته في الوسم غير المشع في تجارب ومحلات مطيافية الرنين النووي المغناطيسي.
هيدروجين-3 (التريتيوم)
يعرف النظير 3H باسم التريتيوم وتتألف نواته من بروتون واحد ونيوترونان اثنان. وهو مشع ويضمحل إلى الهيليوم-3 من خلال اضمحلال بيتا وذلك بعمر نصف مقداره 12.32 سنة.[3]
توجد في الطبيعة كميات قليلة من التريتيوم بسبب تأثير الأشعة الكونية مع غازات الغلاف الجوي. يطلق التريتيوم أيضاً أثناء اختبارات الأسلحة النووية. أكثر طرق تحضير التريتيوم شيوعاً تتضمن قذف نظير الليثيوم الطبيعي ليثيوم-6 بالنيوترونات في مفاعل نووي.
استخدم التريتيوم مسبقاً في تجارب الوسم الكيميائية والحيوية في الوسم النظائري. ويستخدم التريتيوم حالياً في جيوكيمياء النظائر وفي إضاءة التريتيوم. يستعمل التريتيوم في الاندماج النووي ديوتيريوم-تريتيوم كمتفاعل أساسي مع الدويتيريوم، من خلال تحرير الطاقة عن طريق ضياع الكتلة عندما تصطدم النواتان تندمجان عند درجات حرارة مرتفعة.
هيدروجين-4
يحنوي 4H على بروتون واحد وثلاث نيوترونات في نواته. وهو نظير مشع غير ثابت. حضّر مخبرياً من جرّاء قذف التريتيوم بنوى دويتيريوم سريعة الحركة.[4]
اتبع أثر الهيدروجين-4 من البروتونات الصادرة. للهيدروجين-4 كتلة ذرية مقدارها 4.02781 ± 0.00011 دالتون.[5] يضمحل من خلال انبعاث نيوترون وله عمر نصف مقداره (1.39 ± 0.10) × 10−22 ثانية.[6]
هيدروجين-5
إن النظير 5H للهيدروجين غير ثابت وهو له نواة مؤلفة من بروتون واحد وأربع نيوترونات.
حضّر النظير هيدروجين-5 مخبرياً من قذف التريتيوم بنوى تريتيوم سريعة الحركة.[4][7] في هذه التجربة، التقطت نواة التريتوم نيوترونين من الأخرى مشكلة نواة ببروتون واحد وأربع نيوترونات.
يضمحل الهيدروجين-5 من خلال انبعاث نيترون مضاعف ولديه عمر نصف 9.1 × 10−22 ثانية على الأقل.[6]
هيدروجين-6
تتألف نواة الهيدروجين-6 من بروتون واحد وخمس نيترونات. يضمحل 6H من خلال انبعاث نيوترون ثلاثي ولديه عمر نصف 2.90 × 10−22 ثانية.[6]
هيدروجين-7
تتألف نواة 7H من بروتون واحد وست نيترونات. حضّر لأول مرة عام 2003 من قبل فريق من العلماء الروس واليابانيين والفرنسيين في مختبرات الأشعة في ريكن عن طريق قذف البروتيوم بذرات النظير هيليوم-8. في التفاعل الحاصل، جرى منح النيوترونات الستة لنظير الهيليوم إلى نواة ذرة الهيدروجين. تم تأكيد التفاعل من خلال تتبع البوتونين المتبقيين من خلال تلسكوب ريكن، وهو جهاز مؤلف من عدة طبقات من الحساسات المتموضعة خلف الهدف لحزمة أشعة المسرع الدوراني.[2]
جدول النظائر
| الرمز | Z(ب) | N(ن) | كتلة النظير (u) | عمر النصف | نمط الاضمحلال[8] |
ناتج الاضمحلال [n 1] | لف مغزلي |
تركيب النظائر التمثيلي (كسر مولي)[n 2] |
مجال التفاوت الطبيعي (كسر مولي) |
|---|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1.00782503207 | مستقر[n 3][n 4] | 1⁄2+ | 0.999885 | 0.999816–
0.999974 | ||
| 2H [n 5] | 1 | 1 | 2.0141017778 | مستقر | 1+ | 0.000115[n 6] | 0.000026–
0.000184 | ||
| 3H [n 7] | 1 | 2 | 3.0160492777 | 12.32 سنة | β- | 3He | 1⁄2+ | نادر[n 8] | |
| 4H | 1 | 3 | 4.02781 | 1.39×10−22 ثانية [4.6 ميغا إلكترون فولت] |
n | 3H | 2− | ||
| 5H | 1 | 4 | 5.03531 | >9.1×10−22 ثانية | n | 4H | (1⁄2+) | ||
| 6H | 1 | 5 | 6.04494 | 2.90×10−22 ثانية [1.6 ميغا إلكترون فولت] |
3n | 3H | 2−# | ||
| 4n | 2H | ||||||||
| 7H | 1 | 6 | 7.05275 | 2.3×10−23 ثانية | 4n | 3H | 1⁄2+ | ||
- النظائر المستقرة بالخط الغليظ
- يشير إلى الموجود في الماء.
- أكبر من 6.6×1033 سنة.
- هذا النظير مع 3He يعدان النظيران الثابتان الوحيدان اللذان لهما عدد بروتونات أكبر من عدد النيوترونات
- ينتج أثناء الاصطناع النووي أثناء الانفجار الكبير
- وعاء من الهيدروجين يحوي على 2H أقل من 3.2×10−5 (كسر مولي).
- ينتج أثناء الاصطناع النووي أثناء الانفجار الكبير
- آثار قليلة ناتجة عن الأشعة الكونية
المراجع
- Y. B. Gurov؛ وآخرون (2004)، "Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei"، Physics of Atomic Nuclei، 68 (3): 491–497، Bibcode:2005PAN....68..491G، doi:10.1134/1.1891200.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة) -
A. A. Korsheninnikov؛ وآخرون (2003)، "Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He"، Physical Review Letters، 90 (8): 082501، Bibcode:2003PhRvL..90h2501K، doi:10.1103/PhysRevLett.90.082501.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة) - G. L. Miessler, D. A. Tarr (2004)، Inorganic Chemistry (ط. 3rd)، Pearson Prentice Hall، ISBN 978-0-13-035471-6.
-
G. M. Ter-Akopian؛ وآخرون (2002)، "Hydrogen-4 and Hydrogen-5 from t+t and t+d transfer reactions studied with a 57.5-MeV triton beam"، AIP Conference Proceedings، 610: 920، doi:10.1063/1.1470062.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة) - "The 2003 Atomic Mass Evaluation"، Atomic Mass Data Center، مؤرشف من الأصل في 16 سبتمبر 2008، اطلع عليه بتاريخ 15 نوفمبر 2008.
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003)، "The NUBASE evaluation of nuclear and decay properties" (PDF)، Nuclear Physics A، 729: 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل (PDF) في 12 أغسطس 2013.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
A. A. Korsheninnikov؛ وآخرون (2001)، "Superheavy Hydrogen 5H"، Physical Review Letters، 87 (9): 92501، Bibcode:2001PhRvL..87i2501K، doi:10.1103/PhysRevLett.87.092501.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة) - Universal Nuclide Chart نسخة محفوظة 19 فبراير 2017 على موقع واي باك مشين.
مصادر عامة
- كتل النظائر:
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003)، "The NUBASE evaluation of nuclear and decay properties" (PDF)، Nuclear Physics A، 729: 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل (PDF) في 09 أغسطس 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - J. R. de Laeter, J. K. Böhlke, P. De Bièvre, H. Hidaka, H. S. Peiser, K. J. R. Rosman and P. D. P. Taylor (2003)، "Atomic weights of the elements. Review 2000 (IUPAC Technical Report)"، Pure and Applied Chemistry، 75 (6): 683–800، doi:10.1351/pac200375060683، مؤرشف من الأصل في 04 يناير 2019.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - M. E. Wieser (2006)، "Atomic weights of the elements 2005 (IUPAC Technical Report)"، Pure and Applied Chemistry، 78 (11): 2051–2066، doi:10.1351/pac200678112051، مؤرشف من الأصل في 04 يناير 2019.
{{استشهاد بدورية محكمة}}: الاستشهاد يستخدم وسيط مهمل|lay-url=(مساعدة)، روابط خارجية في|laysummary=
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003)، "The NUBASE evaluation of nuclear and decay properties" (PDF)، Nuclear Physics A، 729: 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل (PDF) في 09 أغسطس 2020.
- معلومات الجدول
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003)، "The NUBASE evaluation of nuclear and decay properties" (PDF)، Nuclear Physics A، 729: 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل (PDF) في 09 أغسطس 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - National Nuclear Data Center، "NuDat 2.1 database"، Brookhaven National Laboratory، مؤرشف من الأصل في 14 أكتوبر 2019، اطلع عليه بتاريخ September 2005.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - N. E. Holden (2004)، "Table of the Isotopes"، في D. R. Lide (المحرر)، CRC Handbook of Chemistry and Physics (ط. 85th)، CRC Press، Section 11، ISBN 978-0-8493-0485-9.
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003)، "The NUBASE evaluation of nuclear and decay properties" (PDF)، Nuclear Physics A، 729: 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل (PDF) في 09 أغسطس 2020.
- بوابة العناصر الكيميائية
- بوابة الكيمياء
- بوابة الفيزياء