هاليد الأسيل
هاليد الأسيل (يعرف أيضاً هاليد الحامض) مركب كيميائي مشتق من حمض أكسجيني[1] عن طريق استبدال مجموعة هيدروكسيل بمجموعة هاليد.[2]
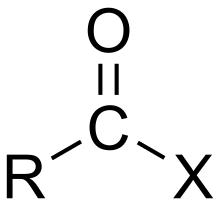
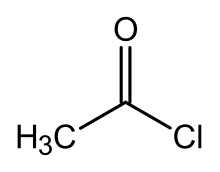
إذا كان الحامض حامضاً كربوكسيلياً، يحتوي المركب على مجموعة -COX كمجموعة وظيفية والتي تتألف من مجموعة كربونيل، مرتبطة بارتباط أحادي مع ذرة هالوجين. يمكن كتابة الصيغة العامة لهكذا أسيل هاليد بالشكل RCOX، حيث: يمكن أن تكون R مجموعة ألكيل على سبيل المثال، وCO هي مجموعة الكربونيل، وتمثل X الهاليد مثل الكلوريد. يعتبر كلوريد الأسيل أكثر أنواع الأسيل هاليد شيوعاً ولكن يصنع (لفترة مؤقتة) أسيل اليوديد بشكل واسع جداً، حيث تصنيع بلايين الكيلوغرامات سنوياً في عملية تصنيع حمض الخليك.
كما يمكن استبدال مجموعة الهيدروكسيل في حمض السلفونيك بهالوجين لإنتاج هاليد السلفونيل المقابل. عملياً غالباً ما يكون الكلوريد هو الهاليد ليعطي سلفونيل كلوريد.
التحضير
الطريقة الشائعة مختبرياً لتصنيع هاليد الأسيل تتضمن تفاعل الأحماض الكربوكسيلية مع كاشف مثل كلوريد الثيونيل أو خماسي كلوريد الفوسفور لإنتاج كلوريد الأسيل، أو خماسي بروميد الفوسفور لإنتاج بروميد الأسيل، أو فلوريد السيانوريك لإنتاج فلوريد الأسيل.
كلوريد الأسيل العطري يحضر بواسطة طريقة خاصة من طرق فريدل كرفت للأسيلة باستخدام فورمالدهيد ككاشف.
التفاعلات
هاليدات الأسيل مركبات فعالة نوعاً ما، وتصنع غالباً لتستخدم كوسيط في تصنيع مركبات عضوية أخرى. فعلى سبيل المثال يتفاعل أسيل هاليد مع:
- الماء لتكوين حمض كربوكسيلي وهو أكثر التفاعلات المستخدمة للأسيل هاليد حيث يحدث هذا التفاعل خلال عملية تصنيع حمض الخليك.
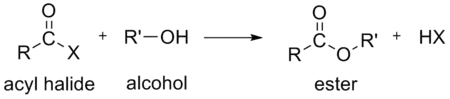

كما ينتج من التفاعلات أعلاه HX هيدروجين هاليد أو حمض الهيدروهاليك. على سبيل المثال عند استخدام كلوريد الأسيل ينتج كلوريد هيدروجين أو حمض الهيدروكلوريك.
مجموعات وظيفية متعددة
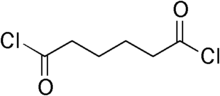
يمكن أن تمتلك الجزيئة الواحدة أكثر من مجموعة أسيل هاليد وظيفية. مثلاً «ثنائي كلوريد الأديبول» يسمى أيضاً أديبويل كلوريد يحتوي على مجموعتي أسيل كلوريد وظيفية. وهو عبارة عن ثنائي كلوريد لحمض كربوكسيلي سداسي ذرات الكاربون المسمى حمض الأديبيك. من أهم استخدامات كلوريد الأديبويل هي في الكوثرة مع مركب أمينو مزدوج عضوي لتكوين متعدد الأميد المسمى نايلون أو الكوثرة مع مركبات عضوية معينة أخرى لتكوين متعدد الإستر.
الفوسجين (ثنائي كلوريد الكاربونيل، Cl-CO-Cl) غاز سام جداً هو ثنائي كلوريد لحمض الكربونيك (HO-CO-OH). وبإمكان جذري الكلوريد في الفوسجين الخضوع لنفس التفاعلات السابقة لهاليد أسيل. يستخدم الفوسجين كمادة متفاعل في إنتاج متعدد الكاربونات.
المخاطر
هاليد الأسيل المتطاير مادة مدمعة للعين، لأنها تتفاعل مع الماء الموجود على سطح العين مكوناً أحماضاً هيدروهاليكية وأحماضاً عضوية مهيجة للعين. وتحدث نفس المشاكل عند استنشاق أبخرة أسيل الهاليد. بشكل عام تهيج أسيلات الهاليد (حتى غير المتطاير منها) العيون والجلد والأغشية المخاطية.
مراجع
- الاتحاد الدولي للكيمياء البحتة والتطبيقية. "acyl groups". Compendium of Chemical Terminology Internet edition.
- الاتحاد الدولي للكيمياء البحتة والتطبيقية. "acyl halides". Compendium of Chemical Terminology Internet edition.
- بوابة الكيمياء