1,1,1,9-tetraclorononano
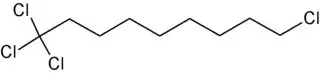
El 1,1,1,9-tetraclorononano es un compuesto orgánico de fórmula molecular C9H16Cl4. Es un haloalcano lineal de nueve carbonos con cuatro átomos de cloro: tres de ellos están unidos a uno de los carbonos terminales mientras que el otro átomo de cloro lo está al otro carbono terminal.[2][3]
| 1,1,1,9-tetraclorononano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,1,1,9-tetraclorononano | ||
| General | ||
| Fórmula semidesarrollada | Cl3C-(CH2)7-CH2Cl | |
| Fórmula molecular | C9H16Cl4 | |
| Identificadores | ||
| Número CAS | 1561-48-4[1] | |
| ChemSpider | 14538 | |
| PubChem | 15273 | |
|
C(CCCCCl)CCCC(Cl)(Cl)Cl
| ||
| Propiedades físicas | ||
| Densidad | 1200 kg/m³; 1,2 g/cm³ | |
| Masa molar | 2660 g/mol | |
| Punto de fusión | 41 °C (314 K) | |
| Punto de ebullición | 257 °C (530 K) | |
| Presión de vapor | 0,0 ± 0,6 mmHg | |
| Índice de refracción (nD) | 1,479 | |
| Propiedades químicas | ||
| log P | 5,51 | |
| Familia | Haloalcano | |
| Peligrosidad | ||
| Punto de inflamabilidad | 389 K (116 °C) | |
| Compuestos relacionados | ||
| cloroalcanos | 1-clorononano | |
| dicloroalcanos | 1,9-diclorononano | |
| policloroalcanos |
1,1,1-triclorononano 1,1,1,5-tetracloropentano 1,5,5,6,6,10-hexaclorodecano 2,3,4,5,6,8-hexaclorodecano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
El 1,1,1,9-tetraclorononano tiene una densidad aproximada de 1,2 g/cm³. Hierve a 257 °C mientras que su punto de fusión es 41 °C. Su punto de inflamabilidad es 116 °C, siendo todos estos valores estimados. El valor del logaritmo de su coeficiente de reparto, logP = 5,51, indica que es considerablemente más soluble en disolventes apolares —como el 1-octanol— que en disolventes polares como el agua.[3]
Síntesis
El 1,1,1,9-tetraclorononano se sintetiza haciendo reaccionar tetraclorometano, agua y peróxido de benzoílo en un reactor a una temperatura de 95 °C. La presión se mantiene en el rango 1200-1400 lb/in2 por inyección de etileno y el tiempo de reacción es de 5 horas. Se obtienen, además de 1,1,1,9-tetraclorononano, cloropentanos y cloroheptanos.[4]
Usos
A su vez, el 1,1,1,9-tetraclorononano es precursor de otros cloroalcanos. Así, la hidrogenación a presión atmosférica durante 10 horas de 1,1,1,9-tetraclorononano con óxido de paladio previamente reducido rinde un 51,7% de 1,9,9,10,10,18-hexaclorooctadecano.[5] Asimismo, el 1,1,1,9-tetraclorononano se puede reducir con un sistema de pentacarbonilo de hierro-hexametilfosforamida a 140 °C durante 3 horas en una corriente de nitrógeno para obtener 1,1,9-triclorononano. El rendimiento alcanza el 95%.[6][7]
Junto al 1,1,1,7-tetracloroheptano, este cloroalcano se ha empleado para la preparación de los ácidos 15-hidroxipentadecanoico y 16-hidroxihexadecanoico,[8] así como de los ésteres metílicos de los ácidos 7-oxoheptanoico y 9-oxononanoico.[9]
Por otra parte, el 1,1,1,9-tetraclorononano se puede utilizar en la vulcanización de cauchos de copolímeros de butadieno.[10]
Véase también
El siguiente compuesto es isómero del 1,1,1,9-tetraclorononano:
Referencias
- Número CAS
- 1,1,1,9-Tetrachlorononane (PubChem)
- 1,1,1,9-Tetrachlorononane (ChemSpider)
- Joyce, R.M.; Hanford, W.E.; Harmon, J. (1948). «Free Radical-initiated Reaction of Ethylene with Carbon Tetrachloride». J. Am. Chem. Soc. 70 (7): 2529-2532. Consultado el 7 de enero de 2020.
- Freidlina, R. Kh.; Kost, T.A. (1957). «Action of nucleophilic reagents on compounds of the type [Cl(CH2)nCCl2-]2». Bulletin of the Academy of Sciences of the USSR, Division of chemical science 6 (5): 656-658. Consultado el 7 de enero de 2020.
- Kiseleva, L.M.; Rybakova, N.A.; Kuz'mina, N.A.; Vasil'eva, T.T.; Dostovalova, V.I. (1981). «Hydrogen migration in 1,1-dichloroalkyl radicals». Bulletin of the Academy of Sciences of the USSR, Division of chemical science 30 (9): 1719-1722. Consultado el 7 de enero de 2020.
- Nikiforov, V.A. (2010). «Synthesis of Polychloroalkanes». Chlorinated Paraffins. pp. 41-82.
- Nesmeyanov, A.N.; Zakharkin, L.I.; Kost, T.A.; Friedlina, R.Kh. (1960). «Synthesis of 15-Hydroxypentadecanoic and 16-hydroxyhexadecanoic acids». Bulletin of the Academy of Sciences of the USSR, Division of chemical science 9 (2): 195-199. Consultado el 7 de enero de 2020.
- Zakharkin, L.I.; Zhigareva, G.G.; Podvlsotskaya, L.S. (1984). «Simple synthesis for methyl esters of 7-oxoheptanoic and 9-oxanonanoic acids». Bulletin of the Academy of Sciences of the USSR, Division of chemical science 33 (12): 2574-2575. Consultado el 7 de enero de 2020.
- Vulcanization of butadiene copolymer rubbers by means of halogenated aliphatic hydrocarbons (1946) Baum, A.A. Patente US2478036A