1-butanamina
La 1-butanamina o n-butilamina es una amina primaria con fórmula molecular C4H11N.
| 1-Butanamina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1-butanamina | ||
| General | ||
| Otros nombres | n-butilamina | |
| Fórmula molecular | C4H11N | |
| Identificadores | ||
| Número CAS | 109-73-9[1] | |
| Número RTECS | EO2975000 | |
| ChEBI | 43799 | |
| ChEMBL | CHEMBL13968 | |
| ChemSpider | 7716 | |
| DrugBank | 03659 | |
| PubChem | 8007 | |
| UNII | N2QV60B4WR | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 740 kg/m³; 0,74 g/cm³ | |
| Masa molar | 73,41 g/mol | |
| Punto de fusión | −50/273,15 K (−323/0 °C) | |
| Punto de ebullición | 77,8/273,15 K (−195/0 °C) | |
| Propiedades químicas | ||
| Acidez | 10.59[2] pKa | |
| Solubilidad en agua | miscible | |
| Peligrosidad | ||
| Punto de inflamabilidad | −12/273 K (−285/0 °C) | |
| Temperatura de autoignición | 312/273 K (39/0 °C) | |
| Frases R | R11 R20/21/22 R35 | |
| Frases S | S1/2 S3 S16 S26 S29 S36/37/39 S45 | |
| Riesgos | ||
| Ingestión | Tos, vértigo, náuseas, pérdida del conocimiento, vómitos.[3] | |
| Inhalación | Sensación de quemazón, tos, vértigo, pérdida del conocimiento.[3] | |
| Piel | Enrojecimiento, aspereza, quemaduras cutáneas, sensación de quemazón, ampollas.[3] | |
| Ojos | Dolor, quemaduras, pérdida de visión.[3] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
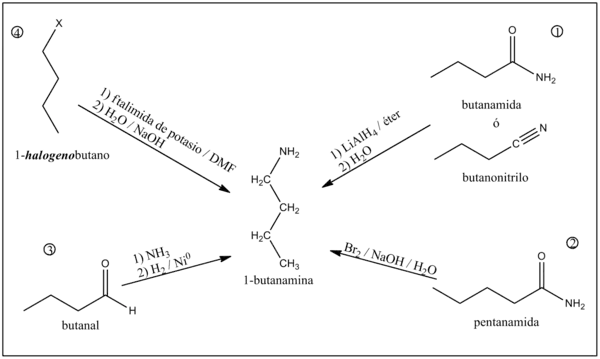
1) A partir de butanamida o butanonitrilo
La reducción de butanamida o butanonitrilo con HLi e AlH3 produce 1-butanamina.[4]
2) A partir de pentilamida
Como producto de la reacción de la pentanamida con bromo en medio acuoso fuertemente alcalino se obtiene 1-butanamina y dióxido de carbono.[4]
3) A partir de butanal
El butanal al reaccionar con el amoníaco produce 1-butilimina. Al ser tratada posteriormente con un reductor como H2/Ni0 o HNa se sintetiza la 1-butanamina.[4]
4) A partir de halogenuros de n-propilo
La 1-butanamina puede ser preparada a partir de halogenuros de n-butilo (P.Ej.: 1-clorobutano o 1-bromobutano) utilizando ftalimida de potasio con N,N-Dimetilformamida (DMF) como solvente y posterior hidrólisis alcalina.[4]
.png.webp)
Referencias
- Número CAS
- Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441.
- n-butilamina. Fichas Internacionales de Seguridad Química.
- McMurry, John (2004). «Aminas». Química Orgánica (sexta edición). Thompson. pp. 903-911. ISBN 970-686-354-0.
Este artículo ha sido escrito por Wikipedia. El texto está disponible bajo la licencia Creative Commons - Atribución - CompartirIgual. Pueden aplicarse cláusulas adicionales a los archivos multimedia.