2-Propanol
El propan-2-ol, anteriormente nombrado como 2-propanol, es también conocido como isopropanol o alcohol isopropílico (abreviado habitualmente como iPrOH o IPA[3]). Es un alcohol incoloro, inflamable, con un olor intenso y muy miscible con el agua. Es un isómero del propan-1-ol y el ejemplo más sencillo de alcohol secundario, donde el carbono del grupo alcohol está unido a otros dos carbonos.
| 2-Propanol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Propan-2-ol | ||
| General | ||
| Otros nombres |
Alcohol isopropílico isopropanol dimetil carbinol alcohol propílico secundario alcohol seudopropílico propan-2-ol | |
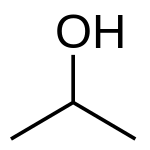
| Fórmula semidesarrollada | CH3CH(OH)CH3 | |
| Fórmula estructural |
 | |
| Fórmula molecular | C3H8O | |
| Identificadores | ||
| Número CAS | 67-63-0[1] | |
| Número RTECS | NT8050000 | |
| ChEBI | 17824 | |
| ChEMBL | CHEMBL582 | |
| ChemSpider | 3644 | |
| DrugBank | 02325 | |
| PubChem | 3776 | |
| UNII | ND2M416302 | |
| KEGG | C01845 D00137, C01845 | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 786,3 kg/m³; 0,7863 g/cm³ | |
| Masa molar | 60,09 g/mol | |
| Punto de fusión | 184 K (−89 °C) | |
| Punto de ebullición | 355,8 K (83 °C) | |
| Temperatura crítica | 508 K (235 °C) | |
| Presión crítica | 47 atm | |
| Viscosidad |
2,86 cP a 288 K (15 °C) 2,08 cP a 298 K (25 °C) 1,77 cP a 303 K (30 °C) | |
| Índice de refracción (nD) | 1,3756 (20 °C) | |
| Propiedades químicas | ||
| Acidez | 16,5 pKa | |
| Momento dipolar | 1,66 D | |
| Termoquímica | ||
| Capacidad calorífica (C) | 0,65 | |
| Peligrosidad | ||
| SGA |
  | |
| Punto de inflamabilidad | 285 K (12 °C) | |
| NFPA 704 |
3
2
0
| |
| Riesgos | ||
| Ingestión | Somnolencia, inconsciencia, y hasta muerte. A veces dolor gastrointestinal, calambres, náuseas, vómitos, y diarrea. La dosis mortal para un adulto humano está cerca de 250 ml. | |
| Inhalación | En altas concentraciones puede causar problemas en el sistema nervioso central: dolor de cabeza, vértigo, inconsciencia y hasta coma. La inhalación del vapor puede causar la irritación de la zona respiratoria y efectos narcóticos. | |
| Piel | Sensibilidad, reacción alérgica, irritación con dolor y picazón. El contacto prolongado o repetido puede causar el desengrase de la piel y dermatitis. | |
| Ojos | Irritación (ardor, rojez), rasgado, inflamación, y lesión córnea | |
| Compuestos relacionados | ||
| Alcoholes relacionados |
Etanol Propan-1-ol Butan-2-ol | |
| Otros compuestos relacionados |
Acetona Propileno Propanal 2-Bromopropano Propilacetato | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Cuando este alcohol se oxida se convierte en acetona ya que los alcoholes secundarios se convierten en cetonas (a diferencia de los alcoholes primarios que se convierten en aldehídos).
Síntesis
Su obtención se realiza fundamentalmente por medio de una reacción de hidratación con propileno. También se produce, aunque con menor importancia, por hidrogenación de la acetona.[cita requerida]
Existen dos vías principales para el proceso de hidratación del propileno: hidratación indirecta por medio de ácido sulfúrico e hidratación directa.
Método indirecto
Se realiza en dos etapas, mediante la hidratación del propeno en fase líquida con ácido sulfúrico. El propeno reacciona con el ácido formando ésteres de sulfato y, por hidrólisis de estos, se forma agua y alcohol isopropílico y eter diisopropílico
Método directo
Se realiza en una sola etapa, mediante hidrataciones catalíticas en fase gaseosa, líquida y forma de lluvia. Se combina el agua con el propeno y, para que reaccione, se utilizan catalizadores ácidos sólidos: ácidos minerales o heteropoliácidos para gas, cambiadores ácidos de iones para fase de lluvia y heteropoliácidos de wolframio solubles en agua para la fase líquida.
Aplicaciones
Entre las aplicaciones del isopropanol, una de las más conocidas es, sin duda, la de agente limpiador. Debido a que deja muy pocos residuos, se utiliza para limpiar dispositivos electrónicos, pantallas, lentes, etc. Es un buen quitagrasas y resulta eficaz en la eliminación de restos de pegamento de algunas etiquetas adhesivas (aunque algunos adhesivos lo resisten). Además, quita manchas en madera, algodón, etc. y se puede utilizar para limpiar pinturas u otros productos fabricados a base de aceite.
Otros usos comunes son:
- Química analítica: Como disolvente de determinados analitos con grupos hidroxilo, indicadores y reactivos químicos; como disolvente en cromatografías de placa fina, cromatografías líquidas, HPLC, supresor de espumación, estándar para cromatografía gaseosa de mezclas de alcoholes.
- Medicina: se usa en el secado de oídos para evitar la otitis externa. Diluido, se utiliza como desinfectante de manos. También es posible emplearlo como antiséptico o alcohol para frotar (de la misma manera que se emplearía el alcohol etílico desnaturalizado).
- Automotores: el isopropanol es un aditivo de la gasolina que actúa disolviendo el agua. Por ello, se utiliza como anticongelante en motores y parabrisas. También se usa para eliminar restos de fluidos en el sistema de frenado.
- Laboratorios biológicos: se utiliza como conservante de especímenes biológicos. En la extracción del ADN es muy útil, ya que permite la precipitación del mismo (después de un centrifugado) debido a que el ADN es insoluble en isopropanol.
- Estética: se utiliza en lociones para la piel, en tónicos para el pelo y en la preparación de ondulados permanentes.
- Fabricación de productos: como ésteres, plastificantes, emolientes, aminas, resinas, tintas, derivados de la celulosa, etc.
Medidas de seguridad
Ante el fuego
A menos que el flujo pueda ser cortado, se debe utilizar: abundante agua pulverizada, espuma resistente al alcohol, extintor de polvo químico, extintor de dióxido de carbono. Las corrientes sólidas de agua pueden ser ineficaces.[2]
Vestimenta
Lentes de seguridad, guantes, delantal.[2]
Propan-2-ol a nivel mundial
La producción mundial de isopropanol es de 2,1x106 Tm, de las cuales 0,65; 0,76 y 0,18x106 Tm por año estuvieron localizadas en USA, Europa Occidental y Japón, respectivamente.
Referencias
- Número CAS
- «Alcohol isopropílico, en Cosmos Online». Consultado el 3 de octubre de 2012.
- PubChem. «iPrOH isopropylalcohol». pubchem.ncbi.nlm.nih.gov (en inglés). Consultado el 27 de junio de 2023.
